III. RECEPTORES, PROTEÍNAS G Y SEGUNDOS MENSAJEROS
COMO YA MENCIONAMOS, en el caso de los receptores membranales, el hecho de que la hormona pueda o no atravesar la membrana es intrascendente. El factor crucial para desencadenar el efecto es la interacción hormona-receptor. Se debe considerar ahora que para los receptores localizados en la membrana plasmática, dicha interacción ocurre en el exterior de la célula y que los efectos tienen lugar en el interior. En otras palabras, la membrana es una barrera, no tanto de permeabilidad, cuanto de flujo de información.
Una pregunta importante es: ¿qué sucede para que se desencadene el efecto una vez que el receptor se activa? Dado que la hormona (el mensajero) no necesita penetrar a la célula, se establece la imperiosa necesidad de que se genere alguna señal en el interior de ésta para que se produzcan los efectos esperados. Ya mencionamos que los receptores son proteínas que atraviesan la membrana plasmática, de tal suerte que la interacción hormona-receptor en el exterior ocasiona un cambio conformacional (es decir, un cambio en la forma, en el espacio) del receptor, que puede afectar la parte extracelular, la zona o zonas transmembranales (que atraviesan la membrana) y las zonas intracelulares. A estas zonas de los receptores las podemos llamar también "dominios". Es posible imaginarnos estos cambios si pensamos en una de nuestras manos con los dedos hacia arriba esperando la llegada de una pequeña pelota de hule; al recibirla, nuestra mano se adapta a la forma de la pelota, para tomarla mejor. El cambio de forma en nuestra mano afectó a todos nuestros dedos e incluso a la palma. Así, al interactuar la hormona y el receptor, la forma en el espacio de éste cambia, y cambia no sólo en las zonas inmediatamente cercanas a la hormona, sino en zonas más alejadas. Estos cambios conformacionales son los que detetminan que un receptor esté activo o en reposo. Pero empecemos con los diferentes tipos de receptores.
A) RECEPTORES QUE SE ACOPLAN A PROTEÍNAS G
A estos receptores acoplados a proteínas G se los llama así por la forma en que funcionan: interactúan con componentes intermedios en el proceso, las proteínas G, de las que platicaremos más adelante. Por su estructura, también se los llama receptores de los siete dominios transmembranales. Empecemos por describir su estructura general antes de pasar a su funcionamiento.
Estos receptores (cuya estructura se ilustra en la figura 5), podemos imaginarlos como un hilo en el que hemos enhebrado muchas perlas. Cada perla representa un aminoácido, los ladrillos con que se forman nuestras proteínas. Esta larga hebra atraviesa la membrana plasmática en siete ocasiones. Uno de los extremos, el extremo amino terminal de la proteína, queda ubicado en el exterior de la célula; si seguimos la hebra, penetra en la membrana por el primer segmento transmembranal, llega al interior celular y se dirige hacia fuera formándose un nuevo segmento transmembranal, vuelve a entrar, y así sucesivamente hasta formar los siete dominios transmembranales y quedando el extremo final, el carboxilo terminal de la proteína, en el interior. De tal forma, que se tienen: los dos extremos, siete segmentos transmembranales y las asas que los unen tanto en su parte extracelular como en la intracelular (tres en cada caso, véase la figura 5). Así observamos a estos receptores vistos lateralmente. Si ahora ponemos esos dominios transmembranales como columnas que atraviesan la membrana plasmática, podremos imaginar su aspecto mirando al receptor desde afuera de la célula (ver figura 5), como lo vería la hormona. Si miramos con cuidado, veremos que entre las columnas se forma un espacio, una bolsita o nido, que es donde la hormona se une en muchos de los casos. Recordemos por un momento el ejemplo de la mano que recibe a la pelota.
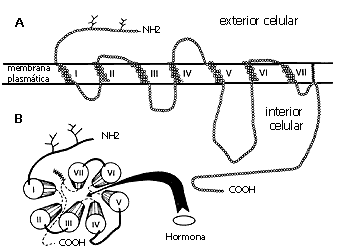
Figura 5. Estructura de un receptor de la familia de los receptores acoplados
a proteínas G o de los siete dominios transmembranales. En la parte superior
(A) se ilustra una representación de estos receptores, en plano, sañalando su
topología. En la parte inferior (B), se ilustra una representación del receptor
en tres dimensiones, visto desde la cara extracelular y señalando la zona de
interacción con la hormona.
Este tipo de receptores es muy común, hay receptores de este tipo para muchos de los neurotransmisores más conocidos y para muchas hormonas. Podemos indicar, sólo a manera de ejemplos, que hay receptores de este tipo para la adrenalina, la histamina, la serotonina, la adenosina, la angiotensina, la vasopresina y muchas otras.
Como mencionamos anteriormente, los receptores son ahora entidades químicas concretas, que se pueden estudiar para entender su funcionamiento. Así, por técnicas de ingeniería genética se han podido producir cambios en lugares específicos de la estructura de algunos de estos receptores para conocer exactamente con cuáles aminoácidos hace contacto la hormona para activar a los receptores. Es decir, se ha podido localizar el sitio de unión para el mensajero. Es notable que no sólo receptores para hormonas, neurotransmisores y autacoides tengan esta estructura. Otros receptores que nos ponen en contacto con el mundo externo también tienen esta estructura de siete dominios transmembranales. Así, el receptor para la luz que se encuentra en los conos y bastones de nuestra retina, la rodopsina, también tiene este tipo de estructura, y lo mismo sucede con los receptores para diferentes olores de nuestra mucosa nasal y con los receptores para diversos sabores de nuestra mucosa gustativa. Es realmente maravilloso observar cómo la naturaleza ha conservado ciertas estructuras bioquímicas fundamentales y las usa para muy diversos fines.
Ahora bien, estos receptores para ejercer muchos de sus efectos se comunican con enzimas que generan señales en el interior celular. Estas señales son sustancias que se forman por la acción catalítica de las enzimas. Si a la hormona se le llama mensajero, a la señal intracelular se le ha llamado segundo mensajero. Al proceso que se lleva a cabo desde el momento de la activación del receptor hasta la formación del segundo mensajero se le llama transducción, porque es la transformación de un tipo de señal en otra; es decir, de señal extracelular a señal intracelular. Estos segundos mensajeros son los encargados de iniciar una serie de eventos que conducen a la propagación intracelular de la señal y finalmente a los efectos fisiológicos que conocemos. Pasemos ahora a ver dos de los sistemas de transducción mejor conocidos.
B) EL SISTEMA DE LA ADENILIL CICLASA
Durante los años sesenta el doctor Sutherland y sus colaboradores llegaron a la conclusión de que bajo la acción de algunas hormonas, como la adrenalina o el glucagon, se formaba un compuesto en el interior de las células hepáticas que era el responsable de los efectos producidos por las hormonas anteriormente mencionadas. Poco tiempo después, el mismo grupo, en colaboración con otro, identificó este compuesto como el AMP cíclico y no pasaron muchos años sin que se contara con métodos para cuantificarlo en las células; incluso se identificó a la enzima que los sintetiza, la adenilil ciclasa, y la reacción en la que esto se lleva a cabo. Toda una década, o quizá un poco más (de 1965 a 1975 aproximadamente), estuvo ocupada por el estudio del AMP cíclico; se mejoraron las técnicas para cuantificarlo, se establecieron criterios para determinar si un efecto era mediado por este segundo mensajero o no, y se asoció la acción de muchísimas hormonas y neurotransmisores a este segundo mensajero. De hecho, se exageró notablemente; si se revisa la bibliografía científica publicada durante esos años, se notará que casi todos los fenómenos se atribuían a cambios en los niveles de AMP cíclico. Era la moda. La ciencia, como todas las actividades humanas, está sujeta a cambios. De pronto, algo surge como importante y miles de investigadores en todo el mundo tratan de determinar la relación que este hecho tiene con el problema que están estudiando. Es la moda, sí, pero también es un esfuerzo honesto por avanzar en el conocimiento. A todo avance técnico o conceptual sigue una explosión de publicaciones científicas. El tiempo y sólo el tiempo nos da su valor real. Con el AMP cíclico sucedió exactamente esto: una explosión. Pero una explosión que en aproximadamente 20 años ha permitido tener un conocimiento bastante detallado del sistema. El esfuerzo pionero de Sutherland fue reconocido con el premio Nobel en Fisiología y Medicina. Desafortunadamente Sutherland falleció poco tiempo después de recibir este reconocimiento.
Decíamos anteriormente que bajo la acción de algunas hormonas se incrementan los niveles de AMP cíclico en las células, y que este compuesto continúa llevando el mensaje hasta que se produce el efecto (esto se verá detalladamente más adelante). Tiempo después se observó que algunas otras hormonas, a través de sus receptores, producen un efecto opuesto, es decir, disminuyen los niveles de este segundo mensajero. En otras palabras, se reconoció que muchas hormonas, neurotrasmisores o autacoides, actúan como moduladores; esto es, aumentando o disminuyendo los niveles de AMP cíclico en el interior de la célula. Pero, ¿cómo es que la acción de una hormona puede producir estos efectos? Al estudiar a la enzima que genera al AMP cíclico se observó que ésta se localiza en las células de mamíferos, preferentemente en la membrana plasmática. ¡Vamos, igual que el receptor! Se pensó entonces que cada receptor tenía una enzima adenilil ciclasa asociada; múltiples experimentos mostraron que la activación simultánea de varios tipos de receptores que estimulan a la enzima no resultaba en una acumulación aditiva del segundo mensajero. Esto sugería que los receptores capaces de activar la adenilil ciclasa comparten una poza común de la enzima, con la cual interactúan al desplazarse en la membrana plasmática. Ahora sabemos que no se trata de una adenilil ciclasa sino de una familia de enzimas, capaces de catalizar la formación de AMP cíclico. Hemos aprendido que las adenilil ciclasas de la mayoría de los eucariontes son enzimas membranales realmente grandes formadas por dos porciones similares unidas. Cada una de estas porciones tiene seis segmentos transmembranales y una gran asa citoplásmica; es decir, la enzima tiene doce segmentos transmembranales y dos grandes asas citoplásmicas (además de las pequeñas asas que unen a los segmentos transmembranales). Es en esas grandes asas donde parece residir la actividad catalítica. Vale la pena mencionar que en algunas células, especialmente en microorganismos, existen adenilil ciclasas con un solo segmento transmembranal e incluso algunas citoplásmicas.
Pero, volvamos ahora a la regulación de la actividad de la adenilil ciclasa membranal. Martin Rodbell, investigador de los Institutos Nacionales de Salud de Estados Unidos, y su grupo agregaron un tercer elemento al sistema de la adenilil ciclasa. Usando preparaciones de membrana observaron que las hormonas no eran capaces de activar a la ciclasa a menos de que se agregara GTP (guanosina trifosfata, un nucleótido de guanina) al ensayo. Este investigador sugirió entonces que no sólo se requerían al receptor y a la adenilil ciclasa para que se produjera la activación de dicha enzima, sino que participaba un tercer elemento igualmente localizado en la membrana: una proteína, que acopla al receptor con la adenilil ciclasa. Estas proteínas acopladoras han recibido el nombre de proteínas G (también han sido llamadas proteínas N y G/F), por requerir para su funcionamiento nucleótidos de guanina. El trabajo pionero de Rodbell fue continuado por estudios detallados que han conducido a la purificación, reconstitución funcional, donación y determinación de la estructura de las diversas proteínas G. Varios grupos participaron en este enorme trabajo con un claro liderazgo del grupo del doctor Alfred G. Gilman. Rodbell y Gilman compartieron el Premio Nobel en Fisiología y Medicina en 1994.
Así como hay hormonas que activan y otras que inhiben a la ciclasa, se ha demostrado que hay variedades de proteínas G: unas que actúan sobre la enzima en forma activadora, llamadas Gs ( "s" por stimutation = estimulación), y otras que lo hacen en forma inhibidora, llamadas Ci ("i" por inhibición). En la figura 6 se presenta un modelo actual del sistema de la adenilil ciclasa. Se tratará de explicar, en forma sencilla, su funcionamiento. Al acoplarse un agonista a su receptor, este último sufre una modificación conformacional, de modo que ahora ya es capaz de interactuar con su respectiva proteína G; si se trata de un agente que activa a la adenilil ciclasa, su receptor se asociará con Gs; mientras que si se trata de uno que inhibe a la ciclasa, su receptor lo hará con Ci. Esto necesariamente implica que existe un reconocimiento selectivo en la membrana plasmática; unos receptores actúan sobre Cs y otros con Ci. La interacción del receptor activado con la proteína G respectiva hace que ésta pase a la forma activada y a su vez modifique, ya sea que active o inhiba, a la enzima adenilil ciclasa.
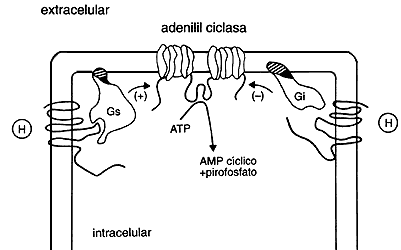
Figura 6. Representación de la modulación de la actividad de la adenil
ciclasa por hormonas (H) que interactúan con receptores de siete dominios transmembranales.
Los receptores que activan a la adenil ciclasa lo hacen a través de Gs y los
que la inhiben a través de Gi. Nótese que las proteínas G están formadas por
tres componentes o subunidades. (ATP=adenosina trifosfato.)
Resumiendo el proceso: el agonista hace que el receptor se active; éste, una vez activado, hace que la proteína G también se active, y son precisamente estas proteínas las que, en última instancia, regulan la actividad de la adenilil ciclasa, estimulándola o inhibiéndola, según se trate de Gs o de Gi, respectivamente. Existen varias isoformas de las proteínas Gs y Gi. No sabemos con precisión por qué o para qué existe esta diversidad. Sin embargo, en estudios muy elegantes, en que se ha bloqueado la expresión de alguna de las isoformas de estas proteínas, ha sido posible ver que la acción de ciertas hormonas o neurotransmisores se bloquea parcial o totalmente. Esto indica que esta heterogeneidad tiene significado fisiológico, es decir, que algunos receptores "prefieren" a ciertas proteínas G respecto a otras. Aún no entendemos completamente, pero con más investigación esto se irá aclarando en los próximos años. Ciertamente es cuestión de afinidades relativas, pero ¿cuáles son las "parejas" de cada receptor?
Una característica de las acciones hormonales de este tipo es que las señales se producen en segundos y desaparecen también en forma relativamente rápida. La separación del agonista de su receptor hace que gran parte del proceso se revierta y cese el efecto. El mismo segundo mensajero, el AMP cíclico se transforma en AMP (no cíclico) por una enzima llamada fosfodiesterasa, este AMP lineal no es activo en el sistema y de este modo se suspende la señal intracelular.
Las proteínas G han sido muy estudiadas en los últimos años. Algunas toxinas bacterianas han constituido una herramienta de gran utilidad para su estudio. Las bacterias, a través de millones de años de experiencia, han diseñado métodos muy refinados para atacar a las células animales.
El cólera es una grave enfermedad causada por una bacteria: el Vibrio cholerae. Tristemente ha reaparecido en nuestro país y en otros de nuestro continente, donde las condiciones higiénicas y de distribución de agua y alimentos son muy deficientes. Esta bacteria se instala en el tubo digestivo y produce una terrible diarrea, dando por resultado una deshidratación tan grave que, de no corregirse a tiempo, ocasiona la muerte. La bacteria no causa directamente daño al paciente, es decir, no lo invade, simplemente produce una toxina que se encarga de alterar el funcionamiento intestinal. Dicha toxina viaja por la luz del intestino grueso y se fija a las células de la mucosa; lentamente penetra la membrana plasmática y una vez dentro hace lo siguiente: con la utilización de una de las sustancias de la célula, el NAD, pega una parte de esta molécula (la fracción ADP-ribosa) a la proteína Gs. Esto carecería de importancia si no fuera porque la proteína queda en forma permanentemente activa, estimulando a la adenilil ciclasa de las células intestinales. El enorme aumento en el AMP cíclico que ocasiona la toxina al modificar a Gs, altera el funcionamiento normal de las células de la mucosa intestinal, impidiendo que absorban los líquidos intestinales (una de las principales funciones del intestino grueso), dando como resultado la terrible diarrea.
Sin embargo, hay otros enemigos que nos son más familiares y que tienen un modus operandi parecido. La Escherichia coli es una de las bacterias que normalmente se encuentran en nuestro intestino; algunas cepas, sin embargo, producen una toxina que actúa en forma similar a la del cólera y que parece ser, en parte (ya que esta bacteria también produce otras toxinas), responsable de los cuadros diarreicos de algunos lactantes infectados con este germen, y de la llamada "diarrea de los turistas".
En la naturaleza, estas toxinas sólo afectan a las células de la mucosa intestinal, puesto que no pasan al torrente circulatorio; pero se las puede administrar a células aisladas y observar los efectos que se producen. Bajo estas condiciones, las células desquician su funcionamiento al acumular grandes cantidades de AMP cíclico; por otro lado, los agentes, que estimulan a la ciclasa, ya ejercen muy poco o ningún efecto adicional. Estos experimentos han ayudado a establecer el papel acoplador de la proteína Gs. Pero, no queda ahí la ayuda que nos han prestado las toxinas; también nos han auxiliado a identificar a las proteínas Gs en la membrana. Utilizando membranas aisladas de células y NAD radiactivo se ha podido demostrar cuál de todas las miles de proteínas que se encuentran en la membrana es Gs. Como se mencionó anteriormente, la toxina rompe el NAD y une una parte de la molécula a Gs; dado que la parte unida está radiactiva, se puede buscar a la proteína que contiene la radiactividad y ésta es Gs.
Como puede observarse en la figura 6, las proteínas Gs y Gi están formadas por tres partes o subunidades, como las llamamos técnicamente; éstas son: las subunidades alfa, beta y gamma. Las toxinas bacterianas atacan a las subunidades alfa. Hace algunos años se pensaba que eran estas subunidades alfa las únicas que tenían una acción para continuar la señal, ahora sabemos que tanto las subunidades alfa como los complejos que forman las subunidades beta y gamma son importantes para la acción global que se produce al activarse las proteínas G.
La toxina pertussis actúa en una forma similar a la toxina del cólera, es una proteína producida por el germen que causa la tosferina: la Bordetella pertussis. Esta toxina, al igual que la del cólera, se fija a la membrana de las células, penetra y, utilizando el NAD del citoplasma celular, produce la ADP-ribosilación de una proteína G, sólo que en este caso el blanco de la toxina es la subunidad alfa de Gi. La ADP- ribosilación de Gi conduce al bloqueo de su acción, es decir, se bloquea toda inhibición hormonal de la adenilil ciclasa.
Mencionaremos aquí que otra proteína de transducción, la transducina (llamada también Gr), participa en el proceso de la visión. Cuando la luz penetra en el ojo, a través de la pupila, llega a la retina y ahí excita a la rodopsina, una proteína que está en los bastones (la opsina de los bastones). Esta proteína activa a la fosfodiesrerasa del GMP cíclico y así se inicia el proceso de la visión. Es muy interesante el hecho de que la rodopsina no se asocie directamente con la fosfodiesterasa, sino que lo haga a través de la transducina. La transducina (véase la figura 7) también está formada por tres subunidades que se denominan alfa, beta y gamma, y es atacada tanto por la toxina del cólera como por la toxina pertussis en su subunidad alfa. Nótese la semejanza funcional de los sistemas de transducción en los diferentes tipos celulares. En el caso de la visión, el "mensajero" es la luz y el" receptor es la rodopsina, la cual se acopla con una enzima, la fosfodiesterasa, a través de una proteína G acopladora, la Gr o transducina. No puede uno dejar de asombrarse y considerar nuevamente la posibilidad de que, en un momento de la evolución, las células primigenias diseñaran mecanismos de transducción para las señales extracelulares y que éstos se hayan ido especializando, pero sin cambiar sus aspectos esenciales, en función de las necesidades particulares de cada tipo celular.
Hagamos un resumen de lo dicho: el receptor, una vez activado, se va a asociar con una proteína acopladora G, la cual pasa la información a la adenilil ciclasa. Si el receptor es activador, se unirá con Gs y ésta activará a la ciclasa, resultando en un aumento en la producción de AMP cíclico por la célula; si por el contrario, el receptor es de tipo inhibidor, se unirá a Gi, la cual inhibe a la ciclasa, y por tanto, la producción de AMP cíclico por la célula disminuye.
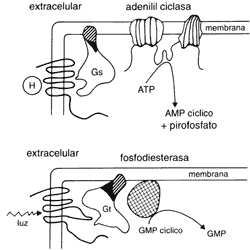
Figura 7. Similitud entre la actividad de la adenilil ciclasa (parte
superior de la figura) por una hormona y la activación de la fosfodiesterasa
del GMP ciclíco por la luz (parte inferior de la figura). Nótese
que los receptores para la hormona y la luz pertenecen a la familia de los siete
dominios transmembranales, que interactúan con proteínas G con tres subunidades
(tranductoras y que éstas a su vez modulan la actividad de enzimas (efectores).
Nótese también que en un caso (adenilil ciclasa la enzima es integral de la
membrana, y en el otro (fosfodiesterasa) es una enzima que se asocia a la membrana.
Esta explicación es una gran simplificación de lo que sucede en la célula, ya que, aunque de hecho Gs y Gi interactúan con la adenilil ciclasa, no significa que sea lo único que se lleve a cabo en la realidad. Hace algunos años se pensaba en sistemas totalmente lineales en la comunicación celular; esto es, un receptor activa una proteína G que modula a un efector membranal como la adenilil ciclasa. Hoy sabemos que esto sólo es parcialmente cierto. Si pensamos en un receptor, éste puede interactuar con varios tipos de proteínas G y éstas a su vez modular la actividad de diversos efectores, como la misma adenilil ciclasa, fosfolipasas, canales iónicos, etc. Es claro que ahora ya no debemos pensar en señalamientos lineales en la transducción, sino en el encendido de redes de transducción. Por lo tanto la acción de una hormona en una célula determinada depende del tipo de receptores, el tipo de proteínas G y el tipo de efectores que expresa. Desde luego hay parámetros generales que se aplican a muchísimos tipos celulares, pero en realidad hay que estudiar a cada uno de ellos, y como ya hemos visto, esto puede variar según las condiciones fisiológicas o experimentales.
D) EL SISTEMA FOSFOINOSÍTIDOS-CALCIO
La membrana plasmática en su porción lipídica está formada básicamente por fosfolípidos. Estos son lípidos que contienen glicerol, dos ácidos grasos, fosfato y un alcohol frecuentemente aminado. Uno de estos fosfolípidos es el fosfatidilinositol (PI) el cual puede ser fosforilado a fosfatidilinositol monofosfato (PIP) y a fosfatidilinositol bifosfato (PIP2). Hace unos 30 años, por allá de la primera mitad de los años cincuenta, Mabel y Lowell Hokin descubrieron que al estimular algunas células con hormonas se producían cambios muy importantes en la síntesis y degradación de un fosfolípido: el fosfatidilinositol. Otros muchos investigadores lograron observar efectos semejantes, con una gran variedad de agentes y en múltiples modelos celulares. Sin embargo, este hallazgo permaneció sólo como descripción, ya que no se había encontrado una explicación para el fenómeno. ¿Para qué hacía la célula algo así? En 1975, Bob Michell, un investigador inglés, hizo una revisión de los hallazgos en el campo. Pero no se limitó a hacer un mero inventario; durante su revisión encontró una asociación estrecha entre el recambio (síntesis y degradación) del fosfatidilinositol y las variaciones en la concentración del calcio libre en el citoplasma de la célula (el calcio libre citosólico ya era considerado como un segundo mensajero). Entonces propuso que el mecanismo de transducción para un gran número de mensajeros involucra, como paso inicial, un aumento en el recambio de fosfoinosítidos, el cual, a su vez, conduce a cambios en la concentración intracelular de calcio libre. Resultará innecesario explicar la revolución que esto causó en el campo; se publicaron muchos trabajos a favor y en contra de esta hipótesis. Aunque todavía hay lagunas importantes en el conocimiento de los pasos que se llevan a cabo en este proceso, el mecanismo que parece ser el más viable es el que se explicará a continuación. La figura 8 nos ayudará a entenderlo más fácilmente.
Al acoplarse los mensajeros con receptores de la familia de los siete dominios transmembranales, estos últimos activan a algunas proteínas del grupo Gq (Gq, G11, G14, y otras, que constituyen un grupo de la familia de las proteínas G). Dichas proteínas a través de sus subunidades alfa y beta-gamma, son capaces de amplificar la actividad de una enzima: la fosfolipasa C, específica para el fosfatidilinositol bifosfato (PIP2), a la que también en algunos trabajos se le llama fosfoinositidasa, de éstos se generan productos como el inositol 1, 4, 5 trisfosfato (IP3) y los diacilglicéridos. Es interesante mencionar que existen diversas isoformas también de la fosfolipasa C y que para este sistema las isoformas beta son las importantes. Más adelante, cuando se hable de los receptores fosforiladores se mencionará que ellos son capaces de activar este sistema de transducción por un mecanismo diferente y utilizando otras isoformas de la fosfoinositidasa.
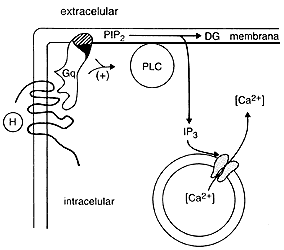
Figura 8. Representación del sistema de transducción de los fosfoinosítidos
y el calcio. (PIP2 = fosfatidil inositol bifosfato; DG =diacilglicérido;PLC
= fosfolipasa C.)
Regresemos en este momento a la generación de los segundos mensajeros, el IP3 y el diacilglicerol. El IP3 es una molécula hidrofílica que es liberada por la fosfoinositidasa al citosol. Antes de mencionar qué relación tiene el IP3 con el calcio en el citoplasma debemos mencionar lo siguiente: la concentración de calcio libre que normalmente hay en el citoplasma de las células es muy baja, unas 10 000 veces menor que la concentración que existe en el exterior de la célula. El cuidado que tiene la célula en mantener bajo su calcio citosólico opera mediante la expulsión del catión al exterior y el secuestro en vesículas intracelulares. Ambos procesos cuestan energía a las células en forma de ATP. Dicho lo anterior, regresemos al IP3. Al ser liberado este segundo mensajero, difunde al citosol donde encuentra receptores localizados en esas vesículas encargadas de secuestrar al calcio. Estos receptores son receptores canal y al encontrarse con el IP3 se abren, permitiendo que el calcio salga de las vesículas y difunda al citosol. Además, a través de mecanismos no totalmente explicados, parece que este mismo mensajero o productos de su metabolismo son capaces de inducir la apertura de proteínas canal de la membrana plasmática, que dejan entrar más calcio al citoplasma. El resultado de estos eventos es que se incrementa tres, cuatro o más veces la concentración de calcio en el citoplasma celular, dando lugar a la propagación del efecto en el citoplasma.
Muchos de los descubrimientos pioneros acerca del IP3 y de su acción han sido hechos por Mike Berridge, quien estudia principalmente la glándula salival de la mosca. Hay que pensar que esto no hubiera sido posible hacerse en México, ni aun contando con el genio de Mike Berridge, pues si a dicho investigador o a alguno otro, en nuestro México lindo y querido, se le hubiese ocurrido solicitar apoyo económico para estudiar cómo escupen las moscas, le habría sido negado de inmediato. ¡No faltaba más!... Triste incomprensión para la ciencia básica; afortunadamente, las cosas parecen estar cambiando. Lo que es claro, es que la glándula salival de la mosca permitió realizar avances sin precedente, aplicables a muchísimos otros modelos. Es posible que Berridge y Michell reciban el premio Nobel en el futuro por sus contribuciones al conocimiento.
Ahora bien, con la hidrólisis del PIP2 se generan no sólo el IP3 sino también diacilgliceroles, que habíamos dejado olvidados por un momento. Estas moléculas son de naturaleza lipídica y parecen permanecer en la membrana hasta ser metabolizadas. Lo interesante es que también participan en el proceso de propagación intracelular de la señal, como veremos en un momento. Resumiendo, en este sistema de transducción no se genera un mensajero sino dos: el IP3 y los diacilglicéridos. El IP3 libera al calcio, que podemos también considerar como segundo (en realidad tercer) mensajero o factor de acoplamiento.