V. RECEPTORES CON ACTIVIDAD ENZIMÁTICA
EN ESTE CAPÍTULO revisaremos el caso de algunos receptores hormonales que poseen actividad enzimática. Existen ya diversos subtipos entre ellos y seguramente se encontrarán más en un futuro no muy distante. Estos receptores se dividen en varios subgrupos: a) los receptores fosforiladores, es decir que tienen actividad de proteína cinasa; b) los receptores que tienen actividad de proteína fosfatasa, y c) los que tienen actividad de guanilil ciclasa.
Durante los últimos años se ha reportado que algunos receptores como el de la insulina o el del factor de crecimiento epidérmico poseen, en su estructura, actividades enzimáticas de proteína cinasa; es decir, que tienen la capacidad de fosforilar a otras proteínas y aun a sí mismos. Aunque la evidencia es incompleta, es muy posible que esta actividad de fosforilación sea fundamental para la propagación intracelular de la señal. Las hormonas, al activar al receptor, aumentan su actividad enzimática de proteína cinasa causando, en muchos casos, la fosforilación del mismo receptor (autofosforilación). Como discutimos en el capítulo anterior, la función básica de los segundos mensajeros es activar a proteínas cinasas, las cuales, a su vez, fosforilan a otras proteínas para modificar su actividad, realizándose así la propagación intracelular de la señal. Así, en el caso de estos receptores, con actividad de proteína cinasa, parecería que la naturaleza se saltó el paso de la generación del segundo mensajero. Aquí el agonista activa directamente a una enzima fosforilante: el mismo receptor.
Pero veamos con mayor detalle a estos receptores con algunos ejemplos de los mejor estudiados. Debo mencionar aquí que existen receptores con actividad de tirosina cinasa, es decir, que fosforilan a proteínas en residuos de tirosina, otros con actividad de serinaltreonina cinasa, es decir que fosforilan a las proteínas en estos aminoácidos. Además voy a incluir aquí a unos receptores que no tienen propiamente actividad enzimática pero que parecen unirse a proteínas cinasas itinerantes que están libres en el citoplasma.
Dentro de los receptores con actividad de tirosina cinasa podemos mencionar a los receptores de la insulina, del factor de crecimiento epidérmico y del factor de crecimiento derivado de las plaquetas (PDGF). Estos receptores tienen una porción extracelular con la que fijan al ligando, una zona transmembranal y la porción citoplásmica. En el caso de los receptores para el factor de crecimiento epidérmico y del derivado de plaquetas, se trata de una sola cadena polipeptídica. En el caso del receptor de la insulina, éste está formado por dos cadenas denominadas beta (parecidas a los receptores mencionados anteriormente) y dos subunidades alfa localizadas en el exterior celular; estas cuatro cadenas están unidas por puentes disulfuro (unión a través de dos átomos de azufre).
Todos estos receptores, al ser activados, se autofosforilan; es decir que un receptor fosforila a otro igual, y esto ocurre en varios lugares. Al fosforilarse ese dominio es como si le cambiase la cara a la zona; después de fosforilarse adquiere una enorme afinidad por una serie de proteínas que se fijan al receptor formando un enorme complejo (véase la figura 10). Estos lugares han sido identificados y corresponden a dominios llamados SH-2. Entre las proteínas que se han identificado están una proteína cinasa citoplásmica llamada Src, la fosfolipasa C gamma y otras proteínas sin actividad propiamente dicha pero que permiten que otras nuevas proteínas se acoplen al complejo (como por ejemplo la proteína p85 que permite que se acople a la subunidad catalítica de la fosfatidilinositol-3-cinasa). El grado de complejidad que se presenta parece ser muy importante y la descripción detallada de cada paso rebasa los objetivos de este libro. Baste, pues, quedarnos con la idea de que al activarse este tipo de receptores se autofosforilan en algunas de sus tirosinas, que estas tirosinas fosforiladas son críticas para que se una, directamente o por medio de otras proteínas intermedias, una serie de enzimas que aumentan su actividad y que así conducen a los efectos finales.
Es importante mencionar que en ciertos casos vamos entendiendo cómo se producen los efectos de estas hormonas. Así, ahora sabemos que una de las proteínas que participa en este complejo de activación es la fosfolipasa C gamma, que es fosforilada al estimular su actividad. Ello conduce a un aumento en el sistema de transducción de los fosfoinosítidos, que revisamos anteriormente, por un proceso diferente. Otra de las proteínas que se activa por la formación de estos complejos es la MAP cinasa (Mitogen Activated Protein Kinase) que viaja al núcleo para favorecer la expresión de algunos genes de respuesta rápida. Recuérdese que los receptores de los que hemos estado hablando, incluyendo el de la insulina, corresponden a receptores para mensajeros que son factores de crecimiento.
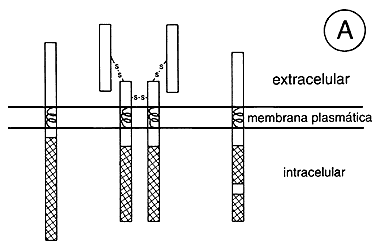
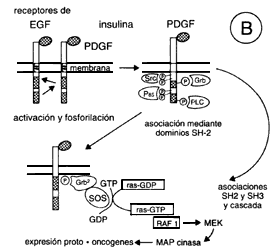
Figura 10. Representación de algunos receptores con actividad de tirosina
cinasa (A) y del mecanismo de acción más aceptado (parte inferior, B). EGF,
factor de crecimiento epidérmico; PDGF, factor de crecimiento
derivado de las plaquetas.
Parece increíble, pero aunque se descubrió la insulina a principios del siglo, tomó muchos años conocer a su receptor. Ahora que ya conocemos muchos de los detalles estructurales del receptor y que el gen que lo codifica ha sido donado, expresado y mutado, prácticamente al gusto, apenas nos empezamos a asomar al funcionamiento detallado del mismo y sus implicaciones en la salud y en la enfermedad. Sin duda, éste es otro campo que aún necesita mucho trabajo y en el que los descubrimientos tendrán importancia para conocer las alteraciones que se producen en padecimientos tan distintos como la diabetes o el cáncer.
Los receptores para los factores de crecimiento y transformación beta (TGF
B) son quizá de los mejor conocidos entre los receptores con actividad de serinaltreonina
cinasa. Estos factores, como su nombre lo indica, participan en la regulación
del ciclo celular de muchas de nuestras células, controlando su proliferación
y su diferenciación. Son proteínas enormemente especializadas y de las cuales
no se sabía prácticamente nada hace unos años. De hecho el mecanismo propuesto
para su acción, que mencionaré a continuación, fue publicado en 1995 (véase
la figura 11)
Existen tres tipos de receptores para los factores de crecimiento y transformación B, cada uno de ellos con acciones diferentes. El receptor tipo III o beta-glicano no tiene actividad, se ha propuesto que sirve como "antena" que captura a los factores y los pasa a los otros receptores. Tanto los receptores tipo I como los tipo II son proteínas que atraviesan la membrana en una ocasión; tienen por lo tanto un dominio extracelular, uno transmembranal y un dominio citoplásmico. El receptor II que tiene actividad de serina/treonina cinasa, fija al mensajero (TGF B). Esta fijación aparentemente no activa al receptor, pero permite que se forme un puente receptor tipo II-TGF B-receptor tipo I, en la superficie de la célula, lo cual hace que exista la distancia adecuada para que el receptor II fosforile al I y así se inicie el procesamiento de la señal en el interior. No sabemos aún qué pasos siguen para conducir a los efectos finales, lo cual convierte a este aspecto en un terreno de estudio enormemente atractivo. Seguramente en los próximos años se aclarará mucho más. Al ver el mecanismo de acción de estos receptores no deja uno de pensar que se parecen a nuestros políticos. Pensemos en dos de ellos que reciben un documento, lo toman y se abrazan, felicitándose (en la superficie), para enviarse patadas (fosforilaciones) por debajo de la mesa.
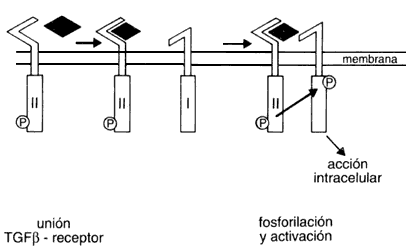
Figura 11. Representación de los receptores tipo I y II para el factor
de crecimiento y transformación B (TGF B) y su mecanismo de acción
propuesto.
Existen algunos receptores como los de la prolactina o los de la hormona de crecimiento que están formados, como en los casos anteriores, por una porción extracelular que fija a la hormona, una transmembranal y una intracelular. Sorprendentemente, la porción intracelular es bastante pequeña y no se le ha podido detectar actividad enzimática alguna. Sin embargo, cuando purificamos el receptor se encuentra asociado con una actividad de proteína cinasa. La interpretación que se ha hecho de estos hallazgos es la suposición de que estos receptores se asocian con proteínas cinasas itinerantes, que se encuentran libres en el citoplasma, como esperando ser llamadas por los receptores activos. Como podrá suponer el lector es mucho lo que falta aún por aclararse sobre la acción de estos receptores.
B) RECEPTORES CON ACTIVIDAD DE PROTEÍNA FOSFATASA
Las fosfatasas de proteína son las enzimas encargadas de quitar el fosfato que colocaron las proteínas cinasas en las proteínas. Las fosfatasas también se han especializado, y existen fosfatasas que quitan el fosfato en residuos de serina y treonina y otras que lo hacen en residuos de tirosina. Nos interesan particularmente estas últimas.
Existen fosfatasas de tirosina solubles y otras que se encuentran ancladas a la membrana. Sin embargo lo que ha resultado particularmente interesante es que algunas de las fosfatasas de tirosina membranales tienen una estructura que parece corresponder a un receptor. Así, el antígeno común de los leucocitos, llamado CD45 parece tener la estructura propia de un receptor. Este antígeno CD45 es una glucoproteína abundante en células hemotopoyéticas, consiste en un largo segmento extracelular, una porción corta trasmembranal y un segmento largo intracelular con la actividad de proteína fosfatasa de tirosina. En este momento aún no sabemos con precisión qué papel juega este receptor ni cuál es su activador natural. Por estudios con mutantes, carentes de esta fosfatasa, sabemos que en estas células se altera la respuesta a antígenos, proceso importantísimo en el sistema inmune. Se ha propuesto la posibilidad de que no sea un ligando soluble el que interactúe con el CD45, sino una molécula de la superficie de otras células, es decir, que pudiera participar en un tipo de comunicación yuxtacrina. La asociación física entre células del sistema inmune parece jugar un papel muy importante en los procesos de diferenciación celular y procesamiento de los antígenos, por lo que esta posibilidad, aunque todavía especulativa, resulta de gran interés.
C) RECEPTORES CON ACTIVIDAD DE GUANILIL CICLASA Y EL SISTEMA DEL ÓXIDO NÍTRICO (NO)
A raíz del descubrimiento del AMP cíclico se investigó si otras moléculas similares podían funcionar como segundos mensajeros. Así, fue descubierto el GMP cíclico y la capacidad de este nucleótido de activar a una proteína cinasa, la proteína cinasa G. Esto causó una gran emotividad en el campo, y pronto aparecieron reportes que asociaban cambios en la concentración del GMP cíclico bajo la acción de muy diversas hormonas.
Sin embargo, a este periodo de motivación siguió una larga etapa en la que
resultaba muy difícil establecer la correlación entre los niveles de GMP
cíclico y la acción de determinados agentes. Muchos investigadores abandonaron
esta línea de trabajo. Una de las mayores complicaciones resultaba la existencia
de diversas formas de guanilil ciclasa, unas solubles y otras asociadas a la
membrana plasmática.
Nos ocuparemos primero de las formas membranales que son receptores. Antes
debemos decir que el corazón no es sólo la bomba que, los cardiólogos nos dicen,
sostiene la circulación de nuestra sangre; es también una glándula. Sí, una
glándula. En la aurícula se producen y secretan una serie de péptidos conocidos
como factores natriuréticos auriculares. Estos péptidos reciben el nombre de
natriuréticos porque favorecen la eliminación urinaria de sodio. Además de esta
función, son poderosos vasodilatadores ya que inducen relajación de la capa
muscular de los vasos. Pronto se logró obtener evidencia de que al activar a
las células musculares con estos factores natriuréticos auriculares se inducía
un claro aumento en los niveles intracelulares de GMP cíclico y
que si se metía GMP cíclico exógeno a las células, se producían
los mismos efectos que los que causaba el factor natriurético auricular. Agua
pasa por mi casa... Todo señalaba pues, que el factor natriurético activaba
a su receptor y esto conducía de alguna manera a la activación de la guanilil
ciclasa y que era el GMP cíclico el segundo mensajero mediador
de las acciones del péptido. Pero ¿cómo se comunica el referido receptor con
la mencionada guanilil ciclasa? Lo más interesante es que por estudios de purificación
se observó que los receptores para estos factores copurificaban con la ciclasa
y resultaba imposible el separar a uno de la otra. Estos datos sugerían la posibilidad
de que ambos fueran la misma cosa, es decir, que el receptor tuviese la actividad
de guanilil ciclasa. La obtención del gen para el receptor y su expresión fueron
fundamentales para confirmar esta hipótesis. Así, hoy sabemos que los receptores
de este tipo poseen una larga porción extracelular con la que interactúan con
estos factores, una breve zona transmembranal y el segmento intracelular donde
se encuentra la guanilil ciclasa (véase la figura 12).
Vale la pena mencionar, que la fecundación en los erizos de mar requiere la interacción de un péptido con su receptor en el espermatozoide; dicho receptor es también una guanilil ciclasa y fue importantísimo donar el gen que codifica para este receptor del espermatozoide del erizo de mar, para posteriormente poder hacer lo mismo con el receptor del péptido natriurético de los mamíferos.
Existe una guanilil ciclasa membranal en el cerebro que responde a un péptido llamado "factor natriurético cerebral" y cuyas funciones se están estudiando ampliamente en estos momentos. Olvidaba mencionar que existe otra guanilil ciclasa membranal que se asocia a algunos componentes del citoesqueleto, y que se encuentra presente en las células intestinales. Allí es activada por la toxina estable (SE) de la Escherichia coli; esta toxina, a través de su acción sobre esta guanilil ciclasa, participa como una de las causas de la diarrea de los turistas, que ya mencionamos en capítulos anteriores. No sabemos mucho más, pero queda claro que esa guanilil ciclasa no está allí por si llega la toxina; lo más probable es que exista un mediador natural, aún no claramente identificado, indicando que lo que hace la toxina para causar el mal es abusar de un sistema de comunicación fisiológico intestinal. Hay mucho por investigar, ¿no es cierto?
Pero ¿qué función tiene entonces la guanilil ciclasa soluble? Aquí han coincidido dos líneas de investigación que al integrarse han resultado un interesantísimo sistema de comunicación paracrina. Por un lado, desde hace mucho se sabe que algunos compuestos con grupos nitro (como la nitroglicerina) son potentes vasodilatadores ya que inducen relajación muscular. Los médicos, desde hace muchos años, recetan a algunos de sus pacientes este tipo de compuestos para relajar las arterias coronarias y mejorar la circulación cardiaca. Este tipo de compuestos activan la guanilil ciclasa citoplásmica. Por supuesto, la madre naturaleza no se ha preocupado en poner allí a esa enzima para que sea activada por los medicamentos que los médicos receten. Debe tener una función natural, algo que la active. Pero... ¿qué?
Aquí es donde aparece la segunda línea de investigación. Se había observado que algunos agentes son capaces de inducir la relajación de vasos sanguíneos, pero que esto sólo ocurre si el endotelio (la capa de células que recubre por dentro a los vasos) está intacto. De tal suerte, que se pensó que un factor del endotelio salía de estas células para actuar sobre las células musculares de los vasos e inducir su relajación. Pasó un muy buen número de años antes de que se descubriera que el óxido nítrico (NO) es el mediador. Este compuesto es sumamente inestable y rápidamente desaparece de la circulación.
Pongamos ahora las dos historias juntas. Bajo la acción de algunas hormonas, el endotelio fabrica el óxido nítrico que viaja a las células musculares para activar a la guanilil ciclasa, produciéndose GMP cíclico que, al activar la proteína cinasa G, conduce a los efectos observados (véase la figura 12). Debo mencionar que este sistema de comunicación paracrino (NO-guanilil ciclasa) no sólo participa en el control de la circulación, sino que tiene importantes funciones en muy diversos territorios de nuestro organismo.
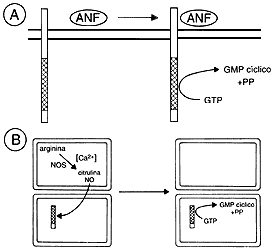
Figura 12. En la parte superior (A) se encuentra una representación de
la activación de la guanilil ciclasa membranal (receptor para el factor natriurético
auricular, ANF) y en la parte inferior (B) la activación paracrina de la guanilil
ciclasa citoplásmica por el óxido nítrico (NO), NOS representa a la enzima que
sintetiza al NO.