II. LA TEORÍA CINÉTICA DE LOS GASES
SI NOSOTROS entendemos por teoría cinética de la materia el intento
mediante el cual se desean explicar las propiedades observables en escala gruesa
o macroscópica de sistemas que en el mundo que nos rodea se encuentran en alguna,
o más, de las tres fases: gaseosa, líquida o sólida, a partir de las leyes que
gobiernan las partículas microscópicas que los forman, es evidente que, en alguna
forma u otra, es necesario que recurramos a la imaginación, a la intuición y,
en cierta medida, a la observación para conceptualizar a dicho sistema. En otras
palabras, la información que podemos obtener de este sistema está limitada a
la observación y medición de algunos de sus atributos accesibles a nuestros
sentidos. Estos atributos reflejan su naturaleza gruesa o macroscópica, como
lo son su volumen, masa, presión, temperatura, color, etc. Pero a partir de
esta información poco o nada podemos aprender del comportamiento individual
de cada uno de los millones y millones de átomos o moléculas que los forman.
De aquí que tengamos que recurrir a la imaginación para crear mentalmente un
modelo en el cual, a través de ciertas hipótesis, podamos describir algunas
de las características de esta enorme población de moléculas. Este modelo contendrá
un mínimo de hipótesis y con base en ellas, habrá que deducir si las propiedades
gruesas del sistema descrito por dicho modelo, concuerdan con las observaciones
realizadas en el laboratorio y con las propiedades de un sistema real. Si la
concordancia es satisfactoria, diremos que el modelo es apropiado para describir
a ese sistema, si no, habrá que modificarlo hasta obtener uno que sí lo sea.
Antes de pretender discutir algún modo específico para la materia, y en particular para los gases, que serán los primeros que abordaremos en nuestro estudio, es conveniente sensibilizarnos con las órdenes de magnitud de las poblaciones moleculares que estaremos contemplando.
Uno de los primeros hechos que aprendemos en la escuela es que si tomamos dos
o más gases, cualquiera que éstos sean, y los confinamos en otros tantos recipientes,
todos ellos de igual volumen, y los mantenemos en iguales condiciones
de temperatura y presión, el número de moléculas en todos esos gases es el mismo.
Ésta es la famosa hipótesis de Avogadro, introducida por el físico italiano
Amedeo Avogadro en 1811 con el objeto de intentar explicar un hecho experimental
obtenido por otro físico, el francés Joseph Gay-Lussac, tres años antes.

Amedeo Avogrado
Sobre la base de experimentos muy cuidadosos, Gay-Lussac concluyó que si dos
o más gases reaccionan químicamente entre sí, los volúmenes de los gases
reactivos y los gases productos están relacionados entre sí por números enteros
simples. Por ejemplo, si descomponemos vapor de agua en sus constituyentes,
hidrógeno y oxígeno, el volumen ocupado por el hidrógeno es precisamente el
doble que el ocupado por el oxígeno. Si hacemos reaccionar nitrógeno y oxígeno
para formar el óxido nítrico, un gas incoloro, un volumen de oxígeno y un volumen
de nitrógeno producen dos volúmenes de óxido nítrico. Estos resultados fueron
desechados por Dalton como incorrectos al no concordar con su teoría atómica
de la materia, pero no nos detendremos aquí para ver por qué. En este momento
nos interesa explicar cómo las ideas de Avogadro pudieron ubicar los experimentos
de Gay-Lussac dentro del marco de ideas de una teoría atómica.

John Dalton
Además de la hipótesis arriba citada, Avogadro sugirió también que algunos
de los elementos químicos que se encuentran en la naturaleza en fase gaseosa
pueden no estar constituidos por un solo átomo del elemento constituyente, sino
por dos o más unidos estrechamente entre sí para formar una molécula. En la
formación del óxido nítrico se obtienen dos volúmenes del producto a partir
de un volumen de cada uno de los reactivos, nitrógeno y oxígeno, respectivamente.
Si en la figura 2 cada volumen representado contiene el mismo número de moléculas,
un número dado de moléculas de oxígeno debe combinarse con el mismo número
de moléculas de nitrógeno para dar el doble de moléculas de óxido nítrico.
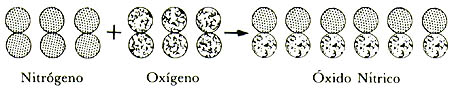
Figura 2. Formación del óxido nítrico a partir de nitrógeno y oxigeno.
En otras palabras, 100 moléculas de oxígeno darán lugar a 200 de óxido nítrico, 10 de oxígeno a 20 de óxido nítrico, 1 de oxígeno a 2 de óxido nítrico. Pero cada molécula de óxido nítrico contiene algo de oxígeno, por lo que la molécula original de oxígeno tendrá que haberse partido en dos mitades, cada una de ellas dando Iugar a una molécula del producto. Avogadro concluyó así, que tanto el oxígeno como el nitrógeno consisten de moléculas conteniendo al menos dos átomos.
Llevando a cabo razonamientos similares para otras reacciones encontró que el oxígeno se desdobla frecuentemente en dos mitades y nunca en más. De aquí infirió que cada molécula de oxígeno no tiene más que dos átomos del elemento. Las mismas consideraciones extraídas de las experiencias de Gay-Lussac mostraron que otros elementos gaseosos como el hidrógeno, el nitrógeno, los halógenos (cloro, yodo, bromo y flúor), están formados por moléculas constituidas por la unión de dos átomos. Éstas se conocen con el nombre de moléculas diatómicas.
La explicación de la formación del agua a partir de sus elementos constituyentes encontrada por Gay-Lussac es inmediata. A temperaturas superiores a 100°C, dos volúmenes de hidrógeno reaccionando con un volumen de oxígeno producen dos volúmenes de vapor de agua. En la figura 3 vemos que un número dado de moléculas de hidrógeno se combina con la mitad de ese número de moléculas de oxígeno para dar un número igual de moléculas de agua. Dos moléculas de hidrógeno y una de oxígeno dan dos moléculas de agua. Pero cada una de las moléculas originales tiene dos átomos, esto es, cuatro átomos de hidrógeno y dos de oxígeno dan dos moléculas de agua. Cada una de ellas estará constituida por dos átomos de hidrógeno y uno de oxígeno.
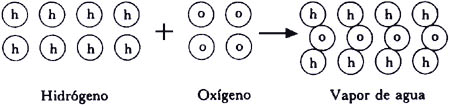
Figura 3. La formación del vapor de agua a partir de sus elementos constitutivos. Dos volúmenes de hidrógeno reaccionan con un volumen de oxígeno para dar dos volúmenes de agua.
Medite el lector cuidadosamente sobre los argumentos vertidos en los párrafos anteriores. Los hechos experimentales observados por Gay-Lussac son de naturaleza macroscópica, es decir, se refieren a volúmenes de gases fáciles de medir en el laboratorio. Las ingeniosas hipótesis de Avogadro, producto de su imaginación, fueron suficientes para concluir que el volumen ocupado por un gas a presión y temperatura dadas sólo depende del número de moléculas presentes en el gas. Esta conclusión ha sido tan exhaustivamente confirmada que ahora la consideramos como un hecho indiscutible. ¡El modelo molecular ideado por Avogadro concuerda completamente con la realidad! Veamos ahora cómo podemos explotarlo para obtener la información que buscamos, esto es, las órdenes de magnitud de las poblaciones moleculares que debemos manejar.
Para ello recordemos que la definición de un átomo gramo para un elemento dado es la cantidad de dicho elemento cuya masa atómica es igual a su masa expresada en gramos. Así, un átomo gramo de oxígeno es igual a 16 g; uno de hidrógeno 1.008 g, etc. Un átomo gramo de cualquier elemento contiene el mismo número de átomos que un átomo gramo de cualquier otro elemento. Este número es una constante de la naturaleza conocido como el número de Avogadro (No) cuyo valor se estima en:*
No = 6.02 x 10 23
átomos/átomo gramo
Por último, recordemos también la definición de un gramo-mol, o simplemente mole, que es la extensión del tan útil concepto de átomo gramo al caso de compuestos. Una mole de un compuesto es la cantidad de dicho compuesto cuya masa es igual a la masa determinada de la fórmula del compuesto expresada en gramos. De esta manera una mole de cloruro de sodio (NaCl), (Na =22.99, Cl = 35.45), tiene una masa de 22.99 g de sodio (Na), más 35.45 g de cloro (Cl), lo que da igual a 58.44 g de NaCl. Véase que por definición una mole de una sustancia contiene el mismo número de átomos de cada uno de los elementos constituyentes que una mole de cualquier otra sustancia. Como este número es el mismo que el número de átomos en un átomo gramo, dado por el número de Avogadro, este número determina también que en una mole de cualquier sustancia haya 6.02 x 1023 átomos de cada elemento constituyente. Así pues, una mole de un gas como el oxígeno contiene 6.02 x 1023 moléculas de oxígeno, etcétera.
Con esta información volvamos a las ideas de Avogadro. Si bajo las mismas condiciones de temperatura y presión, volúmenes iguales de todos los gases contienen el mismo número de moléculas, entonces se puede determinar que el volumen ocupado por una mole de cualquier gas a presión de una atmósfera y 0°C es de 22.4 lts.
Esto es, en 22 400 cm3
hay ![]() moléculas, lo que es aproximadamente igual a 2.69 x 1019
moléculas. En un milímetro cúbico, que son 10 -6
cm3,
habría entonces
moléculas, lo que es aproximadamente igual a 2.69 x 1019
moléculas. En un milímetro cúbico, que son 10 -6
cm3,
habría entonces
2.69 x 1013 moléculas y así sucesivamente. Manejar milímetros cúbicos en el laboratorio es llegar casi al límite de los volúmenes accesibles a la experimentación y sin embargo estamos hablando de poblaciones moleculares de más de un millón de millones (más exactamente, 27 billones de moléculas). ¿Cómo proceder entonces a imaginar la forma en que se comportan estas partículas en estas condiciones? Pues de la misma forma como Avogadro y los precursores de la teoría cinética de los gases lo hicieron: construyendo, o mejor dicho, ideando modelos.
NOTAS
* La notación l0n donde n es un número entero positivo arbitrario, implica que la cantidad a la izquierda de 10n va acompañada de n ceros, a la derecha. Ejemplo: 1 x 106 |= 1 000 000 = un millón.