I.¿QUÉ ES UNA ZEOLITA?
UN POLVO BLANCO |
SUPONGA el lector que ha caído en su poder, por azares del destino,
una botella sobre cuya etiqueta está escrito zeolita. Hay dentro un polvo blanco
y fino. Curioso, intenta enterarse del significado de "zeolita" para saber si
el contenido de la botella corresponde a tal nombre. Ingenuo, cree que basta
consultar un libro técnico y verificar que el polvo cumpla con la definición
de zeolita que, por cierto, también se puede, es más, se debe escribir "ceolita".
(Aquí adoptaremos la ortografía "zeolita" que es la de uso corriente en México.)
Recurre a uno de tantos diccionarios técnicos y encuentra que:
| Las zeolitas [sí, "las zeolitas" pues se trata de una familia de minerales] son aluminosilicatos hidratados altamente cristalinos que al deshidratarse desarrollan, en el cristal ideal, una estructura porosa con diámetros de poro mínimos o sea de 3 a 10 angstroms. |
| [También se dice que] una zeolita es un aluminosilicato cuya estructura forma cavidades ocupadas por iones grandes y moléculas de agua con gran libertad de movimiento [ambos] que permiten el intercambio iónico y la deshidratación reversible. |
Pero, ¿que es un "aluminosilicato"? ¿Qué significa "cristalino" y "cristal ideal"? ¿De qué estructura se trata? El problema resulta bastante más complejo de lo esperado y será necesario proceder ordenadamente y con la ayuda de varios especialistas.
En este capítulo, juntos, determinaremos lo que es una zeolita. En efecto, por ahora, sólo nos consta que el polvo de la botella es un material sólido*. Suponemos que debe presentar propiedades fisicoquímicas peculiares que justifiquen el apelativo de zeolita, así que un análisis fisicoquímico debe resolver el problema.
EN EL |
LABORATORIO |
DE ANÁLISIS |
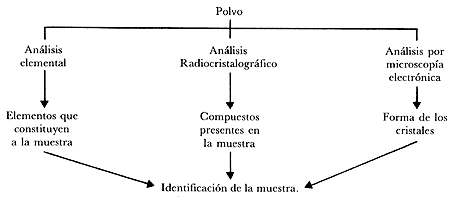
El jefe del laboratorio nos propone determinar la composición de la muestra y su estructura cristalográfica. En efecto, nos explica, que no sólo es importante determinar si la muestra está constituida por átomos de aluminio, silicio, sodio, hidrógeno y oxígeno que, dicho entre paréntesis, son los elementos* presentes en algunas zeolitas, sino que hay que saber cómo se relacionan, cómo están distribuidos en el espacio, pues dependiendo de la forma en que los átomos se ordenen, o sea de la estructura, se obtienen compuestos* diferentes.
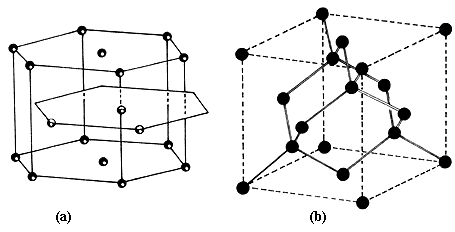
Figura 1. Átomos de carbono en el grafito (a) y en el diamante (b).
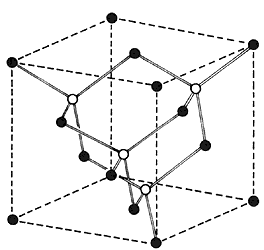
Figura 2. Átomos de cinc (•) y de azufre (o) en la esferalita.
Por ejemplo, el grafito y el diamante tienen una composición elemental idéntica. Ambos están constituidos solamente por átomos de carbono. La diferencia entre uno y otro estriba en que los átomos de carbono están ordenados de manera distinta (Figura 1). En este diagrama se representa a los átomos de carbono mediante círculos y se destaca la geometría mediante líneas.
Estos arreglos (o celdas unitarias)* se repiten infinitamente y son característicos de cada compuesto. En el caso del diamante, los átomos se encuentran en las esquinas de un cubo, en el centro de las caras y en el centro de algunas diagonales. Esta disposición se reproduce al infinito. El arreglo de los átomos de carbono en el grafito es en forma de hexágonos, por eso se dice que el diamante cristaliza en un sistema cúbico pero que el grafito lo hace en un sistema hexagonal.
También existe en la naturaleza la situación inversa. Dos materiales pueden tener la misma estructura cristalográfica pero estar compuestos por átomos diferentes. Por ejemplo, la esferalita (o blenda) cristaliza como el diamante pero está constituida por átomos de cinc (Zn) y de azufre (S) distribuidos como se ilustra en la figura 2. Queda entonces clara la diferencia entre la estructura de un material y la identidad de los átomos que lo constituyen, aunque en los ejemplos anteriores tratamos sólo estructuras regulares y periódicas en el espacio, o sea con cristales (dicho de otro modo, en estos materiales, grupos idénticos de átomos se repiten en el espacio a intervalos iguales). Como lo que aquí nos interesa es identificar los elementos que componen a los polvos y determinar los compuestos que los forman, necesitamos, por lo tanto:
1) Un análisis elemental para determinar qué átomos componen la muestra.
2) Un estudio radiocristalográfico para saber cómo se distribuyen los átomos en el espacio, o sea de qué compuestos se trata, y
3) Un estudio por microscopía electrónica para conocer la homogeneidad del polvo.
Con estos resultados sabremos si la muestra es una zeolita y de qué tipo de zeolita se trata (Figura 3).
RESULTADO |
DEL ANÁLISIS |
ELEMENTAL |
Una semana después nos entregan la hoja de resultados correspondiente al análisis elemental en la que se informa que la muestra está constituida por aluminio (Al), silicio (Si), sodio (Na), hidrógeno (H) y oxígeno (O). Además, el experto nos hace notar que la proporción de la cantidad de átomos de aluminio (x) respecto a la cantidad de átomos de silicio (y) es:
lo cual le permite proponer la siguiente fórmula química*,
determinada experimentalmente:
en donde wH2O sólo significa un número variable de moléculas de agua (H2O). Esta fórmula quiere decir que, en promedio, a 56 átomos de sodio y 56 átomos de aluminio le corresponden 136 de silicio y 384 de oxígeno. Conocemos entonces la composición elemental de la muestra, pero nuevamente, ¿es esto una zeolita? ¿Cuál es la fórmula de una zeolita?
Cuando J.V. Smith, en su artículo "Definición de una zeolita" publicado en la revista Zeolites (sí, existe una revista internacional dedicada exclusivamente a las zeolitas), intenta precisar lo que se debe entender por zeolita propone la fórmula:
Antes de explicar su significado recordemos que la valencia* es el número de enlaces moleculares* que un ion* o un átomo entabla con otros átomos o iones, y que los iones positivos se denominan cationes y los negativos, aniones. Como son de carga opuesta los cationes y aniones se atraen mutuamente con gran fuerza.
En la fórmula propuesta por Smith, M es un catión de valencia n (en nuestro caso se trataría del sodio cuya valencia es 1, así que Mx/n sería Na), "x" es el número de átomos de aluminio, "y" es el número de átomos de silicio (según el resultado experimental antes obtenido, en nuestro caso serían 56 y 136 respectivamente) y 2 (x+y) es el número de átomos de oxígeno que en nuestro caso tendría que ser:
y que es exactamente el número de oxígenos determinados en el análisis de los polvos.
Finalmente, como el número de moléculas* de agua es variable (wH2O) concluimos que la fórmula química de la muestra es la de una zeolita. Sin embargo, como comprobamos al comparar el grafito con el diamante y la esferalita, no basta con la fórmula química para identificar a un compuesto, hay que determinar, además, que la disposición en el espacio de los grupos de átomos sea la adecuada. Por lo tanto, necesitamos los resultados del análisis radiocristalográfico y del estudio por microscopía electrónica.
DISCUSIÓN CON |
EL CRISTALÓGRAFO |
El cristalógrafo nos recibe con la noticia de que "el polvo es cristalino", y para insistir sobre la importancia de su aseveración compara la regularidad característica de los cristales con el desorden típico de los gases. En efecto, dice, así como se habla de un gas ideal se utiliza el concepto de cristal ideal o cristal perfecto.
Un gas ideal está formado por partículas idénticas infinitamente pequeñas y no existen fuerzas entre ellas, además, no ocupan posiciones fijas en el espacio. En un cristal ideal hay grupos idénticos de átomos de tamaño finito, retenidos por fuerzas mutuas en posiciones fijas en el espacio, y dichos átomos se encuentran en reposo. La energía del gas ideal es totalmente cinética*, la del cristal ideal totalmente potencial.
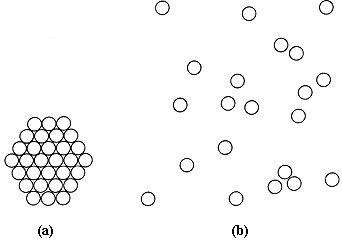
El gas ideal obedece leyes correspondientes a un arreglo al azar de partículas en movimiento y la geometría no interviene. Por el contrario, el cristal ideal está sujeto a las leyes geométricas que rigen un arreglo periódico de partículas en reposo, el azar no se toma en cuenta, las posiciones de los átomos o moléculas están perfectamente definidas. Todos los gases se parecen (excepto por la masa de sus partículas), los cristales ideales presentan una inmensa variedad de arreglos periódicos, la complejidad o distorsión del grupo atómico no importa, siempre y cuando se repita exactamente con periodicidad perfecta. En la figura 4 se compara el orden de un cristal y un gas constituidos por el mismo tipo de átomos. La representación es en un plano, así que hay que imaginársela en el espacio.
Por lo tanto, como la muestra que estudiamos es cristalina, estamos en presencia de una estructura regular periódica. "Se trata de una estructura cúbica", precisa nuestro interlocutor, los átomos o grupos de átomos ocupan posiciones tales que forman cubos de lado igual a 24.8 ┼ (1 ┼ = 10-10 metros). La estructura es la de una zeolita faujasita como la de la figura 5. En esta figura, los átomos de silicio y de aluminio ocupan los vértices. Cada uno de ellos está rodeado por oxígenos y dichos oxígenos se encuentran en medio de los segmentos. No hace falta mucha imaginación para darse cuenta de que este motivo repetido al infinito genera un sistema de cavidades comunicadas que resulta en una serie de canales, la simetría cúbica es evidente. La estructura se basa en un conjunto de cuboctaedros (constituidos cada uno por 24 tetraedros*).
La "gran cavidad" tiene un diámetro de 12.5 ┼ y se tiene acceso a la "cavidad sodalita" de 6.6 ┼ de diámetro por las caras hexagonales*, a través de aberturas de 2.2 Å. Son esas mismas caras hexagonales las que sirven para unir a los cuboctaedros, la pequeña cavidad de comunicación es el prisma hexagonal. Esta estructura microscópica origina grandes cristales cúbicos, fácilmente visibles en el microscopio electrónico de barrido (Figura 6).
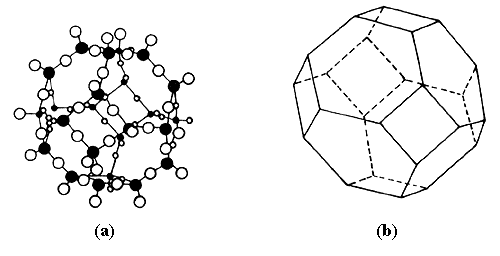
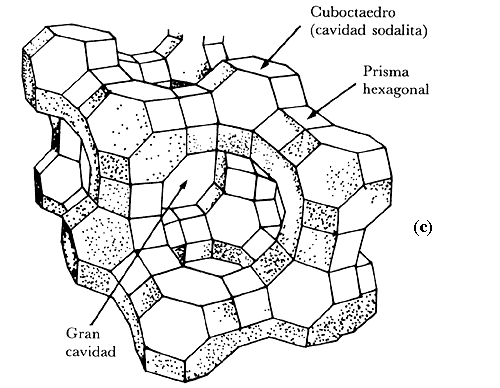
Figura 5. Estructura de una zeolita faujasita. (b) representación simplificada del cuboctaedro (a), en el que aparecen los átomos de oxígeno (o) y los de aluminio o silicio (•). Estos cuboctaedros unidos forman a la zeolita faujasita (c).
En resumen, los polvos de nuestra botella son cristalinos y son una zeolita.
De hecho, se trata de un aluminosilicato (pues están constituidos por Al, Si,
Na y O) hidratado y altamente cristalino (ya que los grupos de átomos están
dispuestos ordenadamente). La estructura es porosa y los diámetros de poro son
mínimos, o sea de 3 a 10 ┼.

Figura 6. Zeolita faujasita X observada en el microscopio electrónico de barrido. Los cristales son de 50 m aproximadamente. Las particulas esféricas son de zeolita P.
El problema inicial está resuelto: la etiqueta de la botella sí corresponde al contenido. Sin embargo, toda esta investigación sólo ha servido para picar nuestra curiosidad, y nos preguntamos ahora: ¿Existen otros tipos de zeolitas? ¿Qué uso se les da? Y tratándose de minerales lo adecuado es interrogar a un geólogo pues él debe ser capaz de describir la abundancia de las zeolitas en la Tierra, clasificarlas y compararlas con otros minerales, escuchémoslo.
"LAS ZEOLITAS SON MINERALES", |
DICE EL GEÓLOGO |
La existencia de una abrumadora cantidad de silicatos (o sea, compuestos del silicio) en la corteza terrestre coloca al silicio como segundo elemento en abundancia sobre la Tierra. Casi todas las arcillas*, rocas y suelos de la Tierra están compuestos por silicatos de aluminio, hierro o magnesio. Básicamente están formados por una unidad estructural tetraédrica integrada por un átomo de silicio en el centro y cuatro de oxígeno que constituyen el "ion ortosilicato". Es ion porque le faltan cuatro cargas eléctricas para estar en equilibrio. Tiende por lo tanto a asociarse para compensar esa carga.
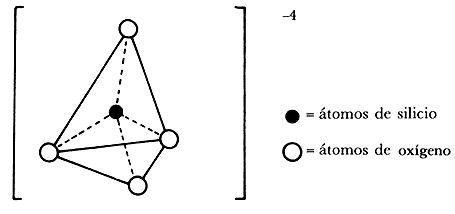
La complejidad de las estructuras de los silicatos se debe a las muy variadas formas en que se enlazan los grupos tetraedrales compartiendo iones oxígeno. De acuerdo con los resultados experimentales estos tetraedros se unen entre sí compartiendo oxígenos y forman, dependiendo de su disposición, la gran variedad de especies minerales conocidas.
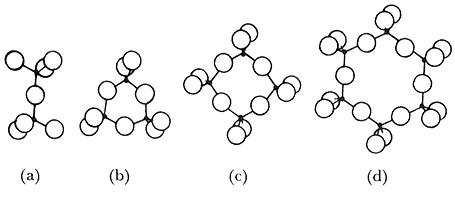
Figura 7. Nesosilicato constituido por la unión de (a) dos tetraedros, (b) tres tetraedros, (c) cuatro tetraedros o (d) seis tetraedros.
Los tetraedros pueden agruparse y disponerse en la red cristalina de modo muy diverso para quedar saturados en cada caso por los cationes apropiados (iones cargados positivamente) y mantenerse unidos unos a otros. Dependiendo de los tipos de estructura (o grupos) de silicatos, se distinguen:
1) Los ortosilicatos: tetraedros (SiO4)-4 independientes entre sí y unidos por cationes.
2) Los nesosilicatos: dos, tres o cuatro o seis tetraedros unidos entre sí (Figura 7).
3) Las redes en cadena: los tetraedros se disponen en serie, uno tras otro, o bien enlazados cada uno al siguiente formando una cadena abierta (infinita). En la red del cristal estas cadenas se unen entre sí, en forma paralela, mediante cationes. Así se forman cadenas (SiO3) presentes en minerales como la jadeíta o la tremolina (Figura 8).
4) Las redes en cinta (inosilicatos): se forman cintas por unión simétrica de dos cadenas que se disponen como un objeto y su imagen reflejada.
5) Las redes estratificadas: estas estructuras en hojas (o filosilicatos) se caracterizan por anillos séxtuples de tetraedros unidos en el plano, unos a continuación de otros (Figura 9). Un ejemplo típico es la caolinita, en la cual hay Al+3 en sitios octaedrales.
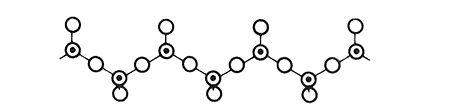
Figura 8. Red en cadenas (SiO3)n. En la red cristalina muchas de estas cadenas se unen a discreción entre sí, en forma paralela, mediante cationes.
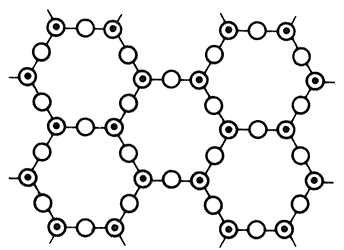
Figura 9. Red estratificada, anillos séxtuples de tetraedros unidos en el plano.
6) Las redes en andamiaje: en este tipo de estructura de silicatos (tectosilicatos), todos los átomos de oxígeno pertenecen simultáneamente a dos tetraedros; los tetraedros SiO4 forman redes unidas tridimensionalmente.
Las zeolitas son tectosilicatos y constituyen el mayor grupo de esta categoría; constan de un andamiaje de tetraedros SiO4, que es el esqueleto de la estructura cristalina. Esta estructura es menos compacta que la de los feldespatos*, por ejemplo. En los huecos abiertos de la estructura se introducen las moléculas de agua sin participar en la cohesión de la red; se trata del "agua zeolítica", y por eso las zeolitas forman espuma al calentarse. A esta propiedad se debe su nombre: "piedra que hierve"; del griego, zeo: hiervo, y lithos: piedra.
En 1896 M.G. Friedel en un artículo del boletín de la sociedad francesa de
mineralogía y cristalografía titulado "Sobre algunas propiedades nuevas de las
zeolitas", comentaba:
| Además, y ése es el hecho importante, esta agua no tiene ningún papel en la estabilidad de la red [cristalina] y se puede eliminar sin que [la red] se destruya. Su papel químico en la molécula es nulo. Parece impregnar a la red como a una "esponja". Esto es lo que los experimentos siguientes me parecen establecer claramente [...] |
| [Si se deshidrata un cristal grande de chabasita y] se rocía con unas cuantas gotas de agua, dicho cristal frío rechina y cruje violentamente, se vuelve polvo por el efecto de la súbita dilatación y la reacción se acompaña de una emisión de calor considerable, muy notable aun al tacto, y que se puede poner en evidencia con el termómetro más rudimentario. No creo que este hecho, muy curioso y fácil de comprobar, se haya señalado anteriormente. Por otro lado, si el cristal se expone al aire húmedo, recupera su estado inicial. |
Sabemos que las zeolitas son porosas, verdaderas esponjas, como dice Friedel,
y por lo tanto se impregnan de agua. Es esta porosidad, usualmente ocupada por
moléculas de agua, la que les confiere a las zeolitas las propiedades notables
que iremos descubriendo. Por ahora digamos que las zeolitas son cristales tectosilicatos
porosos en los cuales la relación entre el número de átomos de oxígeno (z)
y los átomos de aluminio (x) y de silicio (y) es dos, o sea:
En un inicio, las zeolitas se clasificaron en función de su apariencia externa, hoy se hace en función de las características estructurales y de las propiedades fisicoquímicas, aunque la clasificación y nomenclatura todavía están en proceso de cambio y refinamiento. En algunos casos es confusa debido a una caracterización inadecuada de zeolitas previamente bautizadas. Por lo general, los materiales sintéticos equivalentes se describen con su nombre mineral, por ejemplo, mordenita. Los tipos sintéticos nuevos se suelen designar con una letra o un grupo de letras que les asigna el investigador original, por ejemplo: A, X, Y, L, ZSM. Así, los tipos X y Y están estructural y topológicamente relacionados con una zeolita mineral y se les menciona a menudo como zeolitas del tipo faujasita (Cuadro 1).
LAS FAUJASITAS |
Pero volvamos a nuestra investigación. Los polvos que estamos estudiando aquí son del grupo de las faujasitas según la figura anterior, ya que su fórmula es la de una zeolita X o Y. Centrémonos entonces en este grupo. La estructura de la X y la de la Y son similares: estructura cúbica constituida por celdas elementales de cerca de 192 tetraedros (Si, Al)O4. Al escribir (Si, Al)O4 queremos decir que son tetraedros de un silicio o de un aluminio combinados con cuatro oxígenos. La estructura es sorprendentemente estable y rígida. De hecho, son las zeolitas más "huecas" de todas pues cerca del 50% del volumen de los cristales deshidratados de las zeolitas faujasitas es espacio vacío (Cuadro 1). Ese espacio es el que se llena de agua cuando la zeolita se encuentra al aire.
La composición química de las faujasitas está dada por:
en donde M es un catión de valencia n, o lo que es lo mismo:
En esta última fórmula se ponen de relieve los tetraedros AlO2 y SiO2. Aquí hay 59 átomos de Al para 133 de Si. El número x de tetraedros con un aluminio en su centro, en las zeolitas X, varía de 96 a 77. En la zeolita Y, x es de alrededor de 76 a 48. Por lo tanto, la muestra que estamos estudiando es una zeolita Y. Más convencionalmente se utiliza el parámetro R que es la razón entre el número de átomos de Si (y) y el número de átomos de Al (x)
El valor de R varía de 1 a 1.5 si se trata de una zeolita X, pero oscila entre 1.5 y 3 en la zeolita Y. Recordemos además que los resultados del análisis elemental indicaron que esta zeolita sólo contiene sodio además del aluminio, el silicio y el oxígeno. Por ahora, entendemos cómo a partir de tetraedros de silicio o de aluminio se forma la red de zeolita. La presencia de los aluminios origina una deficiencia de carga eléctrica local que se traduce en centros ácidos.* Luego, la capacidad de intercambio iónica será alta. En las faujasitas, como ya se mencionó, dichos iones pueden ser Na, K, Ca, etc., y se sitúan en la red de la zeolita, pero ¿dónde exactamente?
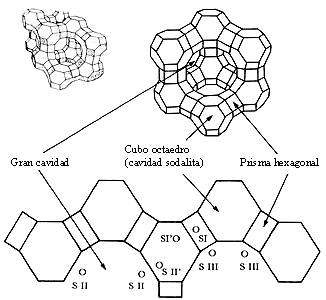
Figura 10. Localización de los sitios I, II y III en la red de una zeolita faujasita.
Si se analiza cuidadosamente la figura 10 se comprobará que hay varios tipos de cavidades (gran cavidad, cavidad sodalita y prisma hexagonal) en las cuales se pueden encontrar los sodios. En esta figura, además de la representación convencional de la zeolita, hemos incluido una esquematización de la red, en dos dimensiones, para señalar las posiciones conocidas como sitios.
Fueron los cristalógrafos los que demostraron que los sodios se suelen colocar en los sitios I, II y III. Es más, los cationes, con la deshidratación, se ven obligados a abandonar posiciones en las que estaban vinculados (coordinados) con moléculas de agua cercanas a los oxígenos de la red. En promedio, por celda unitaria, 7.5 iones de Na+ se suelen encontrar en el sitio I, 30 Na+ en el II y alrededor de 20 Na+ en sitios I'. Además, hay que imaginarse una cierta cantidad de cationes que, con el agua, se comportan como una solución fuerte y flotan libremente en la red.
En monocristales de faujasitas tratadas con sales acuosas de calcio Ca+2 (nótese que las cargas positivas de los iones metálicos corresponden a las valencias metálicas) y luego deshidratados, se ha demostrado que los iones calcio prefieren los sitios I a los sitios II. En esos sitios las cargas positivas de los iones metálicos quedan balanceados por un número igual de cargas negativas.
En zeolitas Y intercambiadas con lantano, iones La3+ se encuentran en el sitio I a temperatura ambiente pero se mueven al sitio II a 700°C. Este efecto además es reversible. Sin embargo, al contrario de lo que acontece con el agua, los cationes no tienen la libertad de abandonar los cristales a menos que se les sustituya por su equivalente electroquímico o por otros cationes, ya que hay que neutralizar la carga aniónica de la red del aluminosilicato. Vislumbramos que, debido a la movilidad de los iones y la posibilidad de intercambiarlos, las zeolitas presentan propiedades fisicoquímicas prácticas. Por ejemplo, ¿por qué no usarlas como intercambiadores de iones en el tratamiento de aguas duras, como veremos más adelante?
CUADRO 1. Clasificación de algunas zeolitas (de particular interés en nuestro
caso serán las faujasitas y las pentasil).
 |
 |
INTERCAMBIO |
DE IONES |
Por procedimientos clásicos de intercambio que describiremos en el siguiente párrafo se pueden sustituir parte de los iones sodio de las zeolitas faujasitas por cationes de otro tamaño y otra carga. Ésta es una de las características esenciales de todas las zeolitas. En efecto, así se consigue modificar considerablemente sus propiedades y ajustar la zeolita a los usos más diversos.
El intercambio catiónico se puede efectuar de varios modos:
1) Intercambio en contacto con una solución salina acuosa (intercambio hidrotérmico) o con un solvente no acuoso;
2) Intercambio en contacto con una sal fundida. Por ejemplo, una zeolita A, originalmente con calcio, se pone en contacto con nitratos de litio, potasio o rubidio fundidos hacia 350°C;
3) Intercambio en contacto con un compuesto gaseoso. Por ejemplo, una zeolita faujasita Y, originalmente en su forma Na, se pone en contacto con HCl anhidro o NH3, hacia 250°C.
En general, es el intercambio hidrotérmico el procedimiento más utilizado en el caso de las zeolitas. Intercambiemos entonces, según dicho procedimiento, el Na+ de nuestra faujasita por iones (Ca+2). Hay que poner en contacto una cierta cantidad de zeolita faujasita (sodio) con una solución acuosa de una sal de calcio (como el nitrato de calcio).
A continuación representamos de modo esquemático la superficie de una zeolita en forma sódica que se intercambia con iones de calcio. Explícitamente se muestran los átomos de silicio (Si), aluminio (Al), oxígeno (O), sodio (Na) y calcio (Ca). Las paredes de los canales que forman la superficie interna están tapizadas de iones de oxígeno. Estos canales contienen un arreglo regular de cationes cuya carga depende de qué tan mala sea la coordinación local o del efecto de pantalla debido a los iones oxígeno de la red. Estos canales contienen un arreglo regular de cationes:
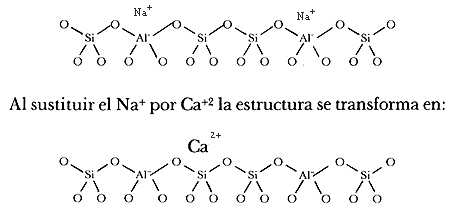
Un solo calcio es suficiente para equilibrar las cargas de los dos grupos A1O4. En la estructura real la carga negativa no se localiza en un solo tetraedro sino que queda distribuida sobre varios oxígenos, de tal modo que entre seis y doce de ellos están vinculados con el catión.
Un caso interesante por sus propiedades ácidas es la obtención de la zeolita
Y en su forma hidrógeno. Este material se obtiene remplazando los sodios por
moléculas de NH4+
que por calentamiento se descomponen en NH3
y H+:
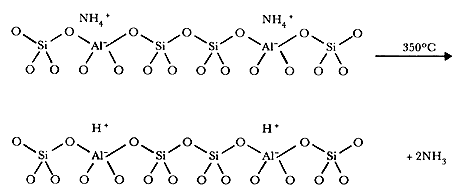
Se ha obtenido una zeolita sin cationes metálicos; se le conoce como decationizada. La localización exacta de los iones H+ en la estructura no está clara.
El intercambio de iones en las zeolitas depende de:
1) La naturaleza de las especies catiónicas, o sea, del catión, de su carga etc.
3) La concentración de las especies catiónicas en solución.
4) Las especies aniónicas asociadas al catión en solución.
5) El solvente (la mayor parte de los intercambios se efectúan en solución acuosa, aunque también algo se hace con solventes orgánicos) y,
6) Las características estructurales de la zeolita en particular.
Es bien sabido que los sitios I son los más difíciles de intercambiar en los prismas hexagonales. El rubidio y el cesio quedan excluidos debido a su tamaño: son demasiado grandes para pasar a través de aberturas cuyo diámetro es de 2.2 ┼.
Además, el intercambio de cationes en las zeolitas implica alteraciones drásticas de la estabilidad y el comportamiento fisicoquímico de la zeolita. Por si fuera poco, el tipo de sitio varía según se trate de faujasita, mordenita o zeolita L, por ejemplo. El número total de estos sitios puede exceder, y a menudo excede por mucho, el número de cationes necesarios para neutralizar la carga aniónica. Como consecuencia, los cationes y las vacancias de cationes se distribuyen en la red.
Una aplicación particularmente interesante de intercambio de iones se da en la zeolita A, que se parece mucho a la faujasita, en la que, en vez de unirse las cavidades por canales hexagonales lo hacen por canales cuadrados (Figura 11). La sustitución de cuatro iones de sodio en los sitios tipo II de la estructura de la zeolita A, por dos iones de calcio altera la estructura cristalina de tal forma que permite la difusión rápida de ciertas moléculas de hidrocarburos* e impide el paso de otros.
Claramente, las características de los poros de la zeolita van a ser de primordial importancia. Es más, dada la regularidad de su estructura, es posible aprovecharlas para tamizar moléculas, atrapar compuestos o absorber gases. Con el intercambio iónico es posible alterar el tamaño de los canales por los que circulan las moléculas; también gracias al intercambio iónico se pueden anclar metales con propiedades químicas peculiares en algunas de esas posiciones. Pero nos estamos adelantando ya que estos temas se tratarán in extenso en el capítulo III.
sólido. Estado de la materia en el que una sustancia tiene tamaño y forma bien definidos y sus superficies la separan de toda la materia que la rodea.
elemento. Sustancia constituida por una sola clase de átomos.
compuestos. Los químicos manejan muchas sustancias que no son elementos. Por el contrario, cada una de ellas está compuesta de dos o más elementos combinados en tal forma que 1) sólo la acción química puede separarlos y 2) los elementos que componen cada sustancia no pueden ser ya identificados por sus propiedades individuales originales. Tales sustancias reciben el nombre de compuestos.
celda unitaria. Las moléculas de un cristal forman un patrón estructural que al repetirse traslacionalmente en tres dimensiones forma el cristal. Este patrón estructural, llamado celda unitaria, está formado por un átomo o una molécula y es el "ladrillo" básico con el que se construye el cristal.
fórmula química. Así como un elemento puede ser representado por su símbolo, también un compuesto puede representarse por su fórmula, que consiste en los símbolos de los elementos que constituyen los compuestos, colocados uno a continuación del otro. Una fórmula no dice tan sólo qué elementos están combinados en el compuesto sino también cuánto hay de cada uno.
valencia. La capacidad de combinación de un elemento en un compuesto se conoce como valencia del elemento.
enlace molecular. Ligadura química que se produce cuando se comparten los electrones y se forma una molécula de alguna sustancia; su naturaleza es esencialmente eléctrica.
ion. Átomo, o grupo de átomos cargados eléctricamente y cuyas cargas son el resultado de la ganancia o pérdida de uno o más electrones molécula.
molécula. La partícula más pequeña de un elemento o compuesto que tiene todas las propiedades de ese elemento o compuesto.
energía cinética. Energía asociada con un cuerpo o masa en movimiento.
tetraedro. Poliedro con cuatro caras triangulares.
poliedro. Sólido limitado por todas partes por polígonos planos.
hexágono. Polígono de 6 lados.
arcilla. Tierra compuesta de silicato de aluminio hidratado proveniente sobre todo de feldespatos, ávida de agua, impermeable y plástica.
feldespato. Silicato doble de aluminio y de un metal alcalino o alcalino-férreo, de estructura laminar y de coloración débil.
ácidos. Los ácidos se pueden definir como soluciones que: 1) liberan H2 gaseoso cuando reaccionan con algunos metales, 2) neutralizan los efectos de las soluciones básicas, 3) hacen que el tornasol vire a su forma roja, 4) tienen sabor agrio.
bases. En cuanto a sus propiedades, las bases se pueden definir como soluciones que: 1) reaccionan con soluciones de sales de metales pesados para formar hidróxidos insolubles (en algunos casos forman óxidos insolubles), 2) neutralizan los efectos de las soluciones ácidas, 3) hacen que el tornasol de color rojo vire a color azul, 4) tienen sabor amargo, 5) se sienten resbalosas al tacto.
hidrocarburo. Compuesto que contiene solamente carbono e hidrógeno.