III.USOS DE LAS ZEOLITAS
TAMICES |
MOLECULARES |
LA PRIMERA aplicación de las zeolitas salta a los ojos si uno
visualiza la figura 11 como un colador de cocina. Es obvio que si un gas o un
líquido está compuesto por dos tipos de moléculas, unas más grandes que las
otras, y si disponemos de una zeolita cuyos poros o ventanas tengan un tamaño
intermedio entre las moléculas pequeñas y las grandes, sólo las primeras entrarán
en la zeolita, mientras que las segundas seguirán su camino. Así se habrá separado
un componente de otro: la zeolita actúa como un tamiz de moléculas. Fue J. McBain
quien informó esta propiedad y acuñó de paso el término tamiz (o malla)
molecular, pero fue R.M. Barrer quien en los años 40, en Inglaterra,
demostró por primera vez que las zeolitas se comportaban como mallas moleculares.
Con la síntesis de zeolitas en los 50, las separaciones previamente demostradas
en el laboratorio se trasladaron a las fábricas. Así la compañía Union Carbide
lanzó al mercado, a principios del 54, adsorbentes a base de zeolitas y, la
División Linde, implantó su uso industrial para obtener argón de alta pureza.
En efecto, la molécula de argón es ligeramente mayor que el oxígeno y no consigue
entrar en la zeolita tipo 4 A a baja temperatura. Otra de las primeras separaciones
a nivel industrial fue la utilización de zeolita 4 A para separar trazas de
agua en la sustancia congelante de los refrigeradores caseros, aplicación que
aún se mantiene.
Hoy se insiste con razón en que los términos zeolita y tamiz molecular no son realmente sinónimos. En realidad, para ser tamiz molecular no es necesario que el material sea un aluminosilicato cristalino con una red abierta que permita el intercambio de iones y una deshidratación reversible, como es el caso de la zeolita.
 |
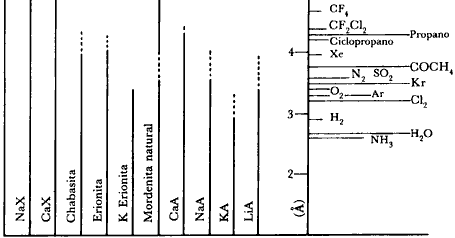 |
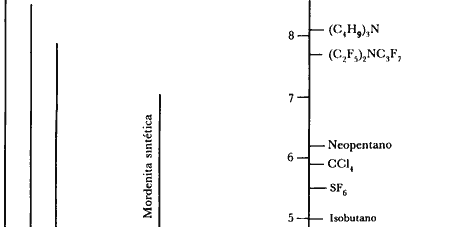
Figura 19. Tamaños de poro de zeolitas naturales y sintéticas a (-) 77 °K y (--) 420 °K comparados con los diámetros cinéticos de algunas moléculas.
En la figura 19 se dan los diámetros cinéticos en angstroms de algunas moléculas y el tamaño de las ventanas de algunas zeolitas. Estos valores no deben tomarse al pie de la letra, ya que el "tamaño" de las moléculas varía dependiendo del método usado para calcularlo. En la figura 19 mencionada, la zeolita A en su forma sódica lleva el símbolo Na-A, si se intercambian los sodios por potasio, el símbolo se transforma en K-A, etc. En la figura 20 se ilustra la forma de algunas moléculas sencillas y el diámetro cinético correspondiente.
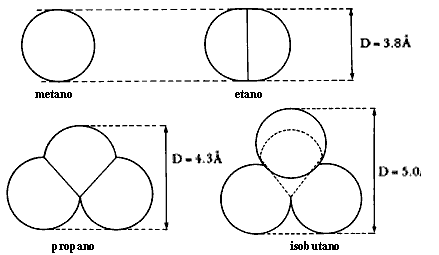
Figura 20. Forma de algunas moléculas sencillas, D es el diámetro cinético correspondiente.
La temperatura debe tomarse en cuenta. En la figura 19 se comprueba que el tamaño del poro aumenta notablemente entre 77 y 420°K (indicado por la línea punteada). A temperatura normal, las pequeñas moléculas polares* como las del amoniaco (NH3) no entran en las cavidades sodalitas (o b) de las zeolitas A, X, Y. Sin embargo, el agua ocupa esos huecos a temperatura ambiente. Se ha comprobado que al elevarse la temperatura, el NH3 se difunde muy lentamente en las cavidades de las zeolitas X y Y. Una observación adicional de la figura 20 es la variación del tamaño de poro dependiendo de los cationes presentes en la zeolita.
Así, una zeolita en la que los sodios son intercambiados por potasios disminuye su ventana a un valor de 3 ┼: en efecto, el ion K es mayor que el ion Na y por lo tanto estorba la entrada del poro. Análogamente es posible sustituir los sodios por calcios. El radio iónico del Ca++ y del Na+ es aproximadamente el mismo, pero como sólo se necesita un Ca por cada dos Na para balancear las cargas de la estructura zeolítica, entonces la abertura del poro está más libre y aumenta de 4.2 ┼ para la forma Na-A, a 5 ┼ para la forma Ca-A. Así puede uno calibrar mediante un intercambio controlado el tamaño de la ventana del poro de las zeolitas.
SECADO |
DE GASES |
A estas alturas el lector podrá dedicarse a consultor técnico en procesos de refinación del petróleo y a la pregunta del operador de una planta de etileno sobre el tipo de zeolita que usted recomienda para eliminar agua del hidrocarburo, hará uso de los conocimientos adquiridos. ¿Cuál zeolita elegir?
Lo primero que se necesita es información sobre el diámetro cinético del agua y el etileno:2.65 ┼ y 3.9 ┼, respectivamente. Por lo tanto, la zeolita que sacará del apuro a nuestro operador debe tener una abertura de poro alrededor de 2.65 ┼. Del análisis de la figura 19 vemos que la zeolita A intercambiada con K cumple con este requisito pues permite la entrada del agua pero no acepta al etileno por tener un tamaño mucho mayor. El problema ha sido resuelto pero nos ha quedado la duda de por qué la mayoría de los gases industriales se deshidratan y cómo se regeneran las zeolitas llenas de agua en sus cavidades.
La respuesta es simple: el agua a baja temperatura forma hidratos que ocasionan taponamientos en las tuberías, es corrosiva y en procesos petroquímicos catalíticos suele ser veneno para los mismos o promueve reacciones laterales indeseables. Por otra parte, un método usual de regeneración* consiste en calentar directamente el reactor* que contiene la zeolita impregnada de agua, entre 200 y 300 °C.
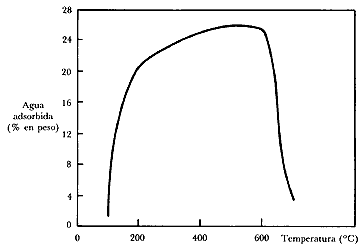
Figura 21. Capacidad de adsorción de agua de la zeolita A en función de la temperatura de calentamiento.
Una de las propiedades más importantes de las zeolitas, que las hace de uso obligado en muchos procesos de deshidratación, es su gran estabilidad térmica y el aumento de su capacidad de adsorción* con la temperatura, como se muestra en la figura 21, para él caso de la zeolita A. Se observa que su capacidad de adsorción* de agua aumenta sustancialmente al calentarse a 300 °C, permanece casi constante hasta los 600 °C y decae bruscamente a temperatura más elevada.
SEPARACIÓN DE |
HIDROCARBUROS |
Si es posible separar moléculas en función de su tamaño usando una zeolita de diámetro apropiado, ¿por qué no intentar separaciones más sutiles? Al observar la figura 20 que presenta datos del diámetro cinético de moléculas sencillas, intuimos que además del tamaño, la forma es característica de las moléculas. Existen moléculas que difieren una de otra sólo por su estructura, aunque la composición sea la misma.
Por ejemplo, el butano tiene como fórmula C4H10, o sea que está compuesto por cuatro carbonos y diez hidrógenos que pueden no obstante disponerse en el espacio de dos formas diferentes (Figura 22). El compuesto lineal es llamado butano normal o n-C4H10 y el ramificado es el isobutano, i-C4H10. Se dice que el isobutano y el n-butano son isómeros. Si el diámetro de poro de la zeolita es exactamente del "ancho" del n-butano, sólo este compuesto podrá entrar, como si fuera una enorme oruga, mientras que el isobutano, que parece un auto con su antena, no podrá hacerlo. El n-butano tiene un diámetro cinético de 4.3 ┼, mientras que el i-C4H10 lo tiene de 5 ┼. La zeolita indicada entonces en este caso es la Ca-A.
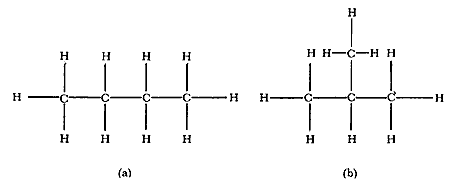
Figura 22. El butano (C4H10) puede ser: (a) butano normal (n- C4H10) o (b) isobutano (i- C4H10).
Existen en la actualidad una miriada de procesos que emplean zeolitas para
separación y secado de hidrocarburos, estimándose que sólo en EUA este
rubro representa un consumo anual de 18 000 toneladas. En nuestro país,
hasta la fecha estos materiales son importados, estimándose un consumo anual
de unas 300 toneladas.
LAS ZEOLITAS |
Y LOS DETERGENTES |
En el capítulo I dijimos que las zeolitas tienen la propiedad de intercambiar
los cationes que mantienen la neutralidad del sistema. Pues bien, esta capacidad
del sólido ha permitido cambiar la fórmula de los detergentes de uso común.
En EUA, del total de la producción de zeolitas, las que se destinan
a este uso representan el 81% del total fabricado ¿Qué hacen las zeolitas en
las lavadoras?
Como sabemos, los detergentes contienen ingredientes que neutralizan los iones calcio y magnesio presentes en el agua. Tradicionalmente existían en el mercado dos tipos de sustancias que eliminaban los compuestos solubles de esos elementos: los tripolifosfatos (TPF) y el carbonato de sodio. Sin embargo, los fosfatos en particular fueron atacados por los ecologistas quienes atribuyen a estos compuestos efectos nocivos irreversibles en lagos y ríos. El carbonato de sodio presenta la desventaja de que es poco eficiente para eliminar al magnesio presente en el agua debido a que el carbonato de magnesio formado es bastante soluble en solución acuosa. Por lo anterior, las compañías fabricantes de detergentes enfocaron sus estudios hacia los usos potenciales de las zeolitas, en particular la zeolita A.
La eficiencia de un detergente, nos dicen los especialistas de la materia,
está determinada en buena medida por la velocidad con la cual se eliminan los
iones mencionados en los primeros minutos de la etapa de lavado. En la figura
23 se muestran resultados de la eliminación del calcio en los tres compuestos
que hemos mencionado. Se puede comprobar que efectivamente el TPF elimina más
rápidamente al calcio, seguido de la zeolita A y por último del carbonato.
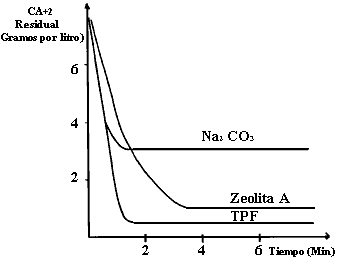
Figura 23. Velocidad de eliminación de calcio en agua de lavado.
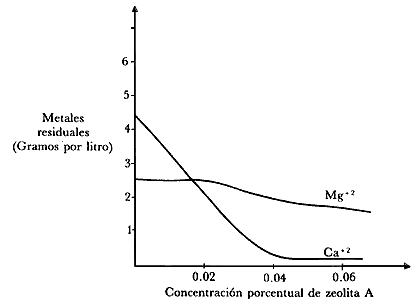
Figura 24. Cantidad de Ca y Mg residual a los 10 minutos de operación en función
de la cantidad de zeolita añadida.
En la figura 24 se presentan resultados de Ca y Mg remanentes como compuestos
solubles a los diez minutos de intercambio, esta vez en función de la concentración
de zeolita añadida en la solución. Como se observa, el magnesio no se intercambia
apreciablemente con la zeolita durante el ciclo de lavado. Lo anterior es debido
en parte a un fenómeno cinético: el intercambio es lento debido a que el ion
magnesio hidratado se difunde, por su tamaño, lentamente al interior de la zeolita.
La otra causa es que el intercambio de sodio por magnesio es termodinámicamente
menos favorable que el de sodio por calcio.
Si bien la zeolita A no pudo sustituir totalmente a los fosfatos, sí permitió lograr una reducción sustancial de la concentración de estos últimos en las fórmulas, con la ventaja adicional de que la zeolita se elimina fácilmente por los procesos convencionales de tratamiento de aguas, además de que no se ha comprobado que su presencia ocasione trastornos a los animales de lagos y ríos.
CATÁLISIS Y |
SELECTIVIDAD* |
DE FORMA |
Hasta ahora nos hemos referido a las aplicaciones de las zeolitas, como la zeolita A, cuyas aberturas son circulares, pero en otros casos pueden ser elípticas, como el caso de la chabasita o erionita, lo que produce sutiles diferencias en la selección de moléculas, diferencias debidas a un factor de forma. La distorsión de la red aluminosilicato es también un factor importante. Al deshidratarse la chabasita intercambiada con calcio, se distorsiona, y aberturas que eran esencialmente circulares de 3.9 ┼ de diámetro se transforman en elipsoidales de 3.7 X 4.2 ┼.
Trataremos de demostrar que la selectividad debido a la forma de las moléculas desempeña un papel de suprema importancia en varias reacciones de hidrocarburos con zeolitas. La ZSM-5 es una zeolita que por su estructura particular tiene una selectividad de forma capaz de discernir diferencias muy pequeñas entre un grupo de moléculas, distinción que para otras zeolitas sería imposible. Presenta canales interconectados más o menos elípticos y con aberturas de 5.3 a 6 ┼, o sea que difiere de las zeolitas de poros grandes como las faujasitas o la mordenita así como de las de poro pequeño como la erionita o la zeolita A. Podemos decir, a manera de resumen, que la selectividad de forma de la ZSM-5 combina dos tipos de efectos: a) el primero relacionado con restricciones estéricas en los sitios activos y b) el segundo debido a la presencia de caminos difusionales* preferenciales (que son los canales elípticos y lineales para hidrocarburos aromáticos e isoparafinas) o los canales en zigzag, casi circulares (para las moléculas de reactivos más ligeros).
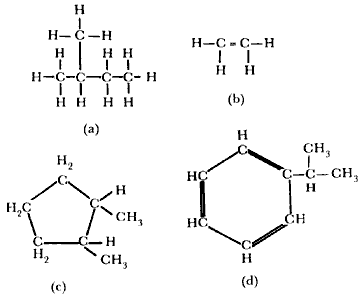
Figura 25. Estructuras típicas de diversos hidrocarburos del petróleo: (a) parafina; (b) olefina; (c) nafteno; (d) aromático.
Aquí es necesario abrir un paréntesis para explicar brevemente algunos conceptos de nomenclatura de sustancias químicas, ya que de ellas hablaremos a menudo en la continuación de este libro. Existen esencialmente cuatro tipos de hidrocarburos: parafinas, olefinas, naftenos y aromáticos. En la figura 25 se muestran cuatro estructuras representativas de cada uno de ellos. Las parafinas están compuestas de átomos de carbono conectados por enlaces sencillos, como ya lo vimos cuando hablamos del butano y del isobutano; las parafinas pueden ser lineales o ramificadas. Las olefinas son hidrocarburos cuya cadena abierta contiene un enlace doble (fórmula Cn H2n) como puede verse en la figura 25 (b). Los naftenos son simplemente parafinas cíclicas mientras que los aromáticos están constituidos por una unidad básica que es el anillo de benceno que contiene tres enlaces dobles.
Bien, decíamos que las propiedades expuestas de la zeolita ZSM-5 son una manifestación de la porosidad intracristalina de las zeolitas. El área externa de los cristales es de alrededor de 1% del área superficial equivalente. Tenemos entonces un sólido cuya relación área/volumen es enorme, constituido por túneles tapizados de oxígenos en los cuales los sitios iónicos de aluminio retienen agua. Por lo tanto, en toda área de la química que se necesite la intervención de una superficie que favorezca la reacción, las zeolitas serán materiales de gran interés. Esa rama de la química se conoce como "catálisis" y las propiedades catalíticas de las zeolitas son conocidas por todo químico.
Un catalizador es una sustancia que modifica y, muy particularmente, acelera (actividad catalítica) una reacción química, "solamente con su presencia", es decir que el catalizador se encuentra al final de la reacción idéntico a sí mismo. Dado que cualquier reacción termodinámicamente posible puede ocurrir en un cierto grado a una temperatura elevada, se deduce que el propósito de usar catalizadores es el de proveer la selectividad pertinente para dirigir la transformación por un camino deseado.
En esta sección estudiaremos los efectos catalíticos de las zeolitas en algunas reacciones. Poca magia hay en hechos tan insólitos como la transformación del alcohol en gasolina, o bien la obtención de petroquímicos útiles a partir del petróleo. Estudiaremos por qué en un caso y en otro son necesarias las zeolitas y, como se trata de la acción de una superficie, empecemos con lo más sencillo: una superficie plana.
En la figura 26 se ilustra cómo los átomos de la superficie de un cristal se encuentran dispuestos de manera distinta a la de sus vecinos. En efecto, el entorno de los átomos pertenecientes al volumen del sólido es distinto del de los átomos de la superficie. Los del volumen están totalmente rodeados por átomos vecinos y alcanzan el equilibrio eléctrico, al contrario de los de la superficie que, para tender a ese equilibrio, se relajan. Hay entonces en la superficie un desequilibrio que propicia la adsorción de otras moléculas, o sea que los átomos de la superficie retienen moléculas de gas o de sustancias en solución. Como el burgués gentilhombre que hablaba prosa sin saberlo, nosotros hemos usado este concepto en los capítulos anteriores cuando veíamos el agua ligada a la superficie de los túneles: de hecho está adsorbida en la red aluminosilicato de la zeolita. Desde luego, cualquier imperfección en esa superficie altera sus propiedades adsortivas.
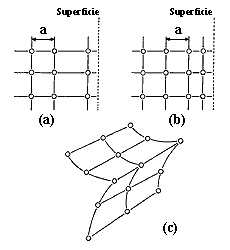
Figura 26. Diferencia entre los átomos de una superficie y los átomos del volumen de un cristal. En (a) se representa una relajación debida a la interrupción súbita del material, en (b) una contracción y en (c) una relajación tangencial.
Estas imperfecciones pueden ser estructurales (ventanas, túneles, cavidades) o químicas (presencia de otros iones, aquí Na, K, Ca, etc.). Sin embargo, el descubrimiento de una actividad catalítica asociada con el interior de los aluminosilicatos ha liberado al químico de esta preocupación. Por ejemplo, las zeolitas X o Y poseen tal estructura que sus espacios intracristalinos permiten la difusión de las moléculas voluminosas. La interfase entre esas moléculas y la zeolita Y no es el final abrupto de una estructura sólida tridimensional.
HACIENDO GASOLINA |
A PARTIR |
DE METANOL |
Si imaginamos las moléculas como complicadas cadenas, orugas habíamos dicho antes, al adsorberse sobre una superficie una de sus secciones quedará fija, y con todo, inválida, reacciona. Cuando sus enlaces se rompan será más probable que sean siempre los mismos. Es como si fijamos una regla a la mitad de una hoja de papel, lo más probable, al tirar de ella, es que se corte siguiendo el filo de la regla. Cuando necesitemos medias hojas, será éste el procedimiento a seguir y no se nos ocurrirá cortar hojas al azar, para después separar las que casualmente se hayan cortado como queríamos. ¿Y qué es la gasolina sino una serie de moléculas rotas de petróleo? Sí, la gasolina son cadenas de cuatro a diez carbonos con hidrógeno.
Digamos que necesitamos gasolina. ¿Cómo obtenerla? Se nos ocurren por ahora dos caminos. El más directo es, ya lo dijimos, seccionando moléculas mayores; el segundo, guiándonos por el sentido común, tiene que ser uniendo moléculas más pequeñas constituidas, digamos, por uno o dos carbonos e hidrógeno. En esta última categoría está la obtención de gasolina a partir de alcohol (metanol en particular).
en donde CH2 repetido"x" veces, si"x" vale entre 4 y 10, es la gasolina (constituida por parafinas, olefinas, naftenos y aromáticos). La formación de hidrocarburos a partir del metanol requiere la eliminación del oxígeno, la cual puede ocurrir de tres maneras diferentes: como H2O, CO o CO2 (la eliminación como O2 está prohibida por la termodinámica).
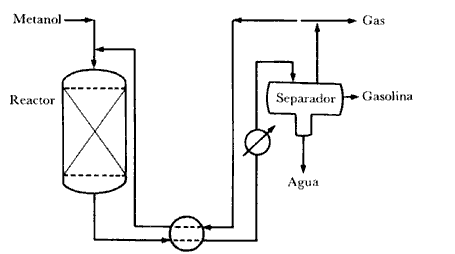
Figura 27. Esquema de una planta para la producción de gasolina a partir de metanol.
 |
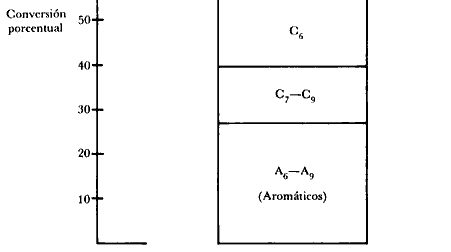 |
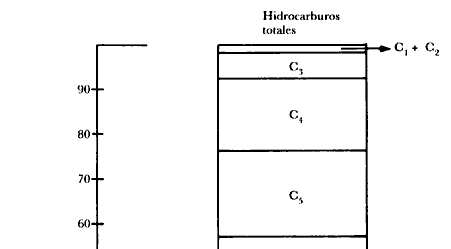
Figura 28. Distribución porcentual de productos obtenidos en la síntesis de gasolina a partir de metanol con zeolita ZSM-5.
Bien, confrontemos ahora nuestras teorías con la experimentación, con los hechos. Ya lo dijo Ortega:
| Esta faena es la ciencia, como se ve consiste en dos operaciones distintas. Una puramente imaginativa, creadora, que el hombre pone de su propia y libérrima substancia; otra confrontadora en lo que no es el hombre, en lo que le rodea, en los hechos, en los datos. La realidad no es dato, algo dado, regalado sino que es construcción que el hombre hace con el material dado [...] Este carácter, en parte al menos, imaginativo de la ciencia hace de ella una hermana de la poesía. Pero entre la imaginación de Galileo y la de un poeta hay una radical diferencia: aquélla es una imaginación exacta. |
A los hechos, pues. Operamos el aparato del esquema mostrado en la figura 27, al cual, como siempre, le añadimos válvulas, manómetros, etc. El metanol pasa por la zeolita ZSM-5 contenida en el reactor catalítico del cual sale una mezcla de gasolina (eso esperamos), agua y algunas moléculas gaseosas. Analicemos los productos de la reacción. En la figura 28 se muestran los resultados de tal análisis expresados como porcentajes de cada uno de los productos obtenidos. ¡Estamos obteniendo 90% de gasolina!
UN RECORRIDO |
POR LOS CANALES |
Hay que hacer notar que por ahora sólo hemos hablado de la zeolita como una simple superficie y nos consta que sólo la ZSM-5 produce gasolina a partir de metanol. ¿Por qué? A estas alturas el lector convertido en investigador está preparado para contestar. Es obvio que no sólo es necesaria una gran área superficial, sino que son algunas de las peculiaridades estructurales de la ZSM-5 las que propician esta transformación.
Analicemos ahora la estructura de la zeolita en función de la reacción que nos interesa. El primer requisito va a ser que los reactivos puedan invadir los cristales de zeolita (típicamente de un micrón de tamaño) y que los productos puedan salir. He aquí un punto importante: la zeolita actuará como tamiz molecular tanto de los reactivos como de los productos, es más, efectuará una selectividad de forma. El acceso al interior de los cristales de zeolita está controlado por ventanas enmarcadas de oxígenos cuyas dimensiones dependen de la estructura de la zeolita. La mayoría de los sitios activos (o sea las configuraciones de átomos susceptibles de favorecer la reacción deseada) están presentes en los poros o cavidades que, a su vez, son de tamaño molecular.
Lo anterior podemos explicarlo fácilmente si analizamos más a fondo la distribución de productos aromáticos obtenidos de la transformación del metanol con tres tipos de zeolitas diferentes: erionita, de abertura de poro pequeña, ZSM-5 y ZSM-11, de poros intermedios y por último mordenita, de grandes poros. La figura 29 muestra los resultados para las zeolitas mencionadas. En primer lugar, notamos que no hay datos para la erionita. ¿Se nos olvidó incluirlos? Afortunadamente no, la erionita sólo produce hidrocarburos de bajo peso molecular: el benceno y otros aromáticos no pueden entrar en las cavidades y por lo tanto tampoco se producen durante el curso de la reacción.
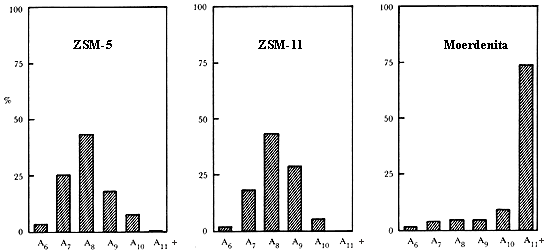
Figura 29. Distribución porcentual de productos aromáticos obtenidos en la transformación del metanol con tres tipos de zeolitas.
Imaginemos ahora a la molécula de metanol que ya ha penetrado por las ventanas de la ZSM-5: al llegar al interior se encuentra sujeta a un entorno determinado por la estructura y la composición de la zeolita. Geométricamente, este entorno consiste de túneles anchos y rectos, verdaderos ejes viales, que se intersectan con túneles más estrechos y zigzagueantes. En la ZSM-5 y la ZSM-11 no hay cavidades, sólo intersecciones y es aquí el único lugar en donde se dispone de un poco más de espacio. En la ZSM-5 sólo hay un tipo de intersección, pero hay dos en la ZSM-11, uno similar al de la ZSM-5 y otro que genera un espacio ligeramente mayor. Esta distribución espacial de los canales influye en la selectividad de forma. Los aromáticos de 8 carbonos se favorecen en la ZSM-5 respecto a los de 9 carbonos que sí se dan en la ZSM-11, lo cual quizá se debe a que el volumen libre en la intersección de la ZSM-11 es aproximadamente un 30% mayor que en la otra zeolita. Así se ha llegado a postular un control de tránsito molecular para zeolitas que tienen dos tipos de túneles que se intersectan. Se cree que algunas moléculas se pueden mover preferentemente por un sistema de canales, mientras que otros productos se mueven por el sistema restante. Los resultados en el caso de la mordenita nos muestran que la distribución de productos aromáticos de once y más carbones es mayoritaria dado que no hay restricciones geométricas para su formación.
Un último punto a considerar es la difusión. ¿Con qué facilidad se mueven las moléculas en el interior de los túneles? El movimiento de los reactivos, o sea la difusión, depende una vez más de la composición y estructura de la zeolita. La regularidad de los poros de la zeolita implica que una molécula que se difunde a través de un cristal de zeolita se encuentre permanentemente (¿paradoja?) bajo la influencia de la superficie de la zeolita. De allí que a veces sean necesarios cristales pequeños para limitar esta influencia al mínimo, o viceversa.
Una vez que la molécula de alcohol ha alcanzado el sitio activo, ¿qué sucede? Tradicionalmente, el investigador en este campo ha tratado de descubrir el sitio activo que origina la catálisis. Históricamente, esa meta, objetivo lógico, ha sido de lo más frustrante en catálisis heterogénea, en parte, como se dijo anteriormente, debido a la dificultad en aplicar conceptos químicos familiares y técnicas convencionales a lo que se conoce como "superficie".
Esos sitios activos son ante todo sitios ácidos. No describiremos aquí cómo
actúan esos sitios ácidos sobre las moléculas del alcohol y cuál es el mecanismo
detallado por el que se forman compuestos intermedios que generan los productos
finales. Es demasiado complejo. Tanto más que aún se cuestiona la forma en que
se produce el primer enlace C-C. No obstante, a continuación reproducimos
una de las versiones simplificadas propuesta, pues siempre, sorprendentemente,
hay algún erudito entre nuestros lectores:
ZEOLITAS SELECTIVAS |
HECHAS A LA MEDIDA |
De lo visto anteriormente podemos pensar que se puede alterar la estructura de la zeolita para "calibrarla"; regular sus propiedades de tal modo que se obtenga el producto o los productos deseados en tan alto porcentaje como sea posible.
Por ejemplo, en la misma conversión del metanol sobre la ZSM-5 se puede orientar la reacción a fin de obtener altos rendimientos en olefinas si la zeolita se modifica añadiéndole fósforo (las olefinas, en general, son sumamente valiosas como materia de base para la fabricación de muchos petroquímicos). Otro tipo de alteración puede ser bloquear los sitios activos superficiales de los cristales, ya que éstos pueden catalizar reacciones no selectivas de forma (el sitio activo ya no se encuentra en un túnel). Una posibilidad extra puede ser la deposición de óxidos en la superficie externa de los cristales. Trabajos recientes confirman que el fósforo y el boro sí se concentran en la superficie externa de los cristales, aunque es inevitable cierta penetración en los huecos intracristalinos. Adicionalmente, se modifican las propiedades ácidas y el espectro de adsorción. También la presencia de cationes adecuados en posiciones claves puede modificar los caminos de difusión.
ROMPIENDO |
MOLÉCULAS |
DE PETRÓLEO |
Revisemos ahora el segundo método (es decir, el rompimiento de moléculas de petróleo) para la obtención de gasolinas en el cual las zeolitas juegan un papel fundamental: la desintegración catalítica.
Mediante este proceso se obtiene ante todo gas licuado, gasolinas con alto índice de octano y diesel. Es sin duda el proceso de refinación más importante en la historia de la industria pues proporciona el combustible para prácticamente todos los medios de transporte, el gas que se emplea tanto en los hogares como el que sirve de materia prima para innumerable cantidad de procesos petroquímicos. Aunque a primera vista parezca exagerado, se dice que sin los carburantes se disminuiría la capacidad de alimentación de todo el planeta; se calcula que para hacer producir una hectárea de maíz se requieren unos 600 litros de gasolina.
 |
 |
En el mundo, aproximadamente unos 9 millones de barriles de petróleo se destinan diariamente al proceso, para lo cual se requieren unas 295 000 toneladas anuales de catalizador. En México se procesan actualmente unos 260 000 barriles diarios (un barril de petróleo equivale a 159 litros), consumiéndose aproximadamente 10 000 toneladas de catalizador al año.
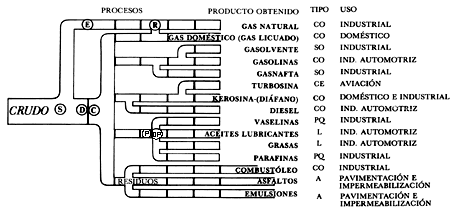
Para entender la importancia estratégica del proceso es interesante ubicarlo dentro del esquema de refinación primaria del petróleo crudo, para lo cual nos apoyamos en la figura 30, que nos muestra los productos básicos obtenidos por los diversos procedimientos físicos y químicos a que se somete el petróleo. Debemos mencionar que el crudo abarca desde el asfalto hasta el gas licuado. Lo primero que se hace en la refinería es separar, mediante destilación y condensación a diversas temperaturas, diversos componentes: de esta manera se produce gas licuado, gasolinas, kerosinas o diesel. El remanente se somete a una nueva destilación, esta vez al vacío, obteniéndose parafinas, aceites lubricantes y el gasóleo, el cual es la materia prima para el proceso de desintegración catalítica.
El inventor de la desintegración catalítica para la obtención de gasolina fue el ingeniero francés E. Houdry, apasionado de las carreras de autos, quien en 1922 funda una compañía para intentar mejorar la calidad de los carburantes. En 1936 empieza a operar en EUA la primera planta que emplea un catalizador a base de arcilla natural lavada con ácido, el cual fue sustituido unos años después por silicoaluminatos sintéticos.
El proceso de desintegración catalítica semeja una enorme fábrica en la cual cientos de moléculas diferentes son transformadas simultáneamente (se calcula que por cada gramo de catalizador, 2.4X1017 moléculas se convierten cada segundo). En el proceso se producen cientos de nuevos compuestos, sin embargo, el fenómeno no se lleva a cabo anárquicamente sino siguiendo caminos de reacción que están gobernados por la formación de los llamados iones carbonio, es decir, un ion hidrocarburo con una carga positiva en el átomo de carbono. Estas especies se generan por la interacción de la molécula con un centro ácido del catalizador.
A principios de los años 50 se buscaban febrilmente mejores catalizadores para el proceso. Los investigadores estaban concientes de que desde el punto de vista estructural, los silicoaluminatos amorfos eran sólidos que no presentaban una estructura uniforme ni ordenada, razón por la cual se pensaba que del total de la masa sólo una fracción muy pequeña era catalíticamente activa. Por otra parte, el interés también se centraba en mejorar el rendimiento en gasolina y disminuir la producción de gases. Así, debía existir un catalizador hipotético en el cual los sitios activos estuviesen dentro de los poros y que el tamaño de éstos fuese ligeramente mayor que el de las moléculas a desintegrar.
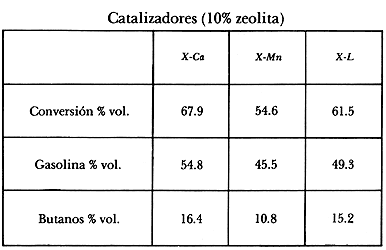
Figura 31. Desintegración catalítica de un gasóleo empleando zeolitas faujasitas X intercambiadas con diversos metales: X-Ca = calcio, X-Mn = manganeso y X-L = lantánidos.
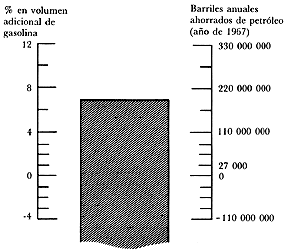
Figura 32. Estimaciones del número de barriles de crudo ahorrados en función del incremento en la producción de gasolina generado por el uso de catalizadores zeolíticos en la desintegración catalítica.
En 1956, Plank y Rosinski, dos investigadores de la Compañía Mobil, buscaban nuevos catalizadores para el proceso. En su laboratorio contaban con una serie de muestras de zeolita faujasita X intercambiadas con diversos metales, las cuales decidieron probar en la desintegración de un gasóleo.
Para realizar sus pruebas, tomaron 10% de zeolita y la mezclaron con un silicoaluminato sintético. Tres variedades de metales en la zeolita fueron evaluados: calcio, manganeso y una mezcla de lantánidos (Ce, La, Nd). En la figura 31 reproducimos los resultados obtenidos de la reacción, en ella denominamos X-L a la zeolita que contiene los lantánidos. Cuando estos investigadores confrontaron los resultados obtenidos con los de los silicoaluminatos sintéticos, observaron las siguientes ventajas: la adición de 10% de zeolita producía entre 6 y 9% más de gasolina, hasta 6% menos de gases y convertía al gasóleo unas 100 veces más rápido que el silicoaluminato. La actividad de las zeolitas era tan elevada que estuvieron a punto de ser descartadas como candidatas. En efecto, los resultados mostrados se refieren a materiales tratados previamente por 20 horas a 650 °C antes de iniciar la prueba a fin de simular la regeneración que se lleva a cabo en el reactor industrial. Durante ese proceso de tratamiento la zeolita pierde parte de su actividad inicial y se vuelve selectiva para la formación de gasolina; sin el tratamiento previo, la actividad de transformación es tan elevada que lo único que se observa es una gran formación de gases y depósito de carbono en el sólido.
Podríamos estar tentados a pensar que las mejoras introducidas por las zeolitas
en el proceso son modestas, pues ¿qué representa un 6% más de gasolina?
Para tener una idea del impacto de los nuevos catalizadores, en la figura 32
se muestran algunos cálculos realizados hace 20 años para datos de procesamiento
de gasóleo en EUA: si suponemos que las zeolitas producen en promedio
un 7% más de gasolina respecto a los silicoaluminatos amorfos, el ahorro
anual de gasóleo que no hubo que procesar es de 190 millones de barriles.
De 1961, fecha en que iniciaron su operación los nuevos catalizadores, a nuestros días, los avances para mejorar la eficiencia de los mismos ha proseguido. Debe destacarse en particular la sustitución de la zeolita X por la Y, notablemente más resistente a las altas temperaturas de operación del proceso.
NUEVAS TENDENCIAS |
EN DESINTEGRACIÓN |
Hoy en día, la industria enfrenta nuevos retos para el procesamiento del petróleo. Como sabemos, los crudos son "más pesados" (como el crudo Maya), o sea que están constituidos por moléculas más grandes y por ende más difíciles de romper en productos ligeros. Las fracciones del petróleo de estos crudos útiles para el proceso de desintegración contienen moléculas cuyo diámetro cinético va desde los 25 hasta los 150 ┼, siendo el promedio mayoritario de unos 50 ┼. Obviamente, estas moléculas no pueden penetrar los poros de las zeolitas disponibles en la actualidad. Por tanto, los científicos, como lo hicieron Plank y Rosinski, buscan el catalizador hipotético: una nueva zeolita de poros más grandes, térmicamente estable, con iones intercambiables que permitan modular la acidez del sólido para que la desintegración produzca la gasolina requerida.
Los nuevos catalizadores se desarrollan febrilmente en distintos laboratorios. La pista para resolver el problema ya fue dada. La materia prima para la fabricación de los catalizadores del futuro se dejó de usar hace más de 50 años: ¡las arcillas del proceso Houdry! En efecto, como vimos en el Capítulo I, existen arcillas con estructuras laminares (filosilicatos) cargadas negativamente y que tienen los iones positivos intercalados entre las láminas. Si esos iones se sustituyen por cationes más voluminosos, se produce una separación de láminas, creándose un poro o ventana que permite el acceso de moléculas a cavidades de gran volumen. Se informa en la bibliografía de materiales con poros hasta seis veces más grandes que los de las zeolitas convencionales. Más aún, el tamaño y forma de los poros depende del catión empleado como "proyectil" para hacer las perforaciones necesarias en la estructura laminar.
Estas investigaciones fueron iniciadas hace unos 25 años por Barrer, irónicamente las dejó inconclusas porque sus métodos de síntesis de zeolitas tipo X y Y lo hicieron dedicar todas sus energías a ese trabajo.
¡LAS ZEOLITAS |
SE COMEN! |
Hasta aquí hemos destacado algunas de las aplicaciones de las zeolitas en procesos de transformación de productos químicos, así como aquellos relacionados con la separación de componentes. Exploremos otros usos.
Desde hace ya muchos años los yacimientos naturales de clinoptilolita y mordenita se han venido empleando en diversos países como parte de la alimentación de animales así como en el tratamiento de la contaminación generada por el excremento de los mismos. En Japón, por ejemplo, que posee ricos yacimientos de estas zeolitas, es práctica común añadirlas en el alimento de aves y cerdos.
Diversas publicaciones aparecidas en años recientes nos enteran que en 1966 se realizaron pruebas en aves a las que en su alimentación se añadió 10% de zeolita por un periodo de 14 días. Los resultados mostraron que las aves aumentaron de peso calculado por unidad de alimento consumido (excluyendo la zeolita), es decir, la eficiencia alimenticia fue un 20% mayor respecto a la obtenida para aves de control alimentadas normalmente. En una experimentación más prolongada en la que se empleó clinoptilolita de California se encontró un incremento en la eficiencia alimenticia del 5%, pero más destacado aún fue el hecho de que en las aves no tratadas hubo 4% de fallecimientos, mientras que todas las tratadas con zeolitas sobrevivieron. De igual manera se han notado incrementos en la eficiencia alimenticia entre 25-29% en pruebas realizadas con cerdos.
¿Qué hace que los animales engorden más cuando en su dieta se incluye una zeolita? La respuesta, como en el caso de los procesos catalíticos que revisamos anteriormente, no es categórica. Una explicación a este curioso mecanismo es que las zeolitas presentes en el sistema digestivo de los animales absorben una parte de los nutrientes ingeridos en sus cavidades, reteniéndolos por un cierto tiempo y, posteriormente, los van dosificando poco a poco, razón por la cual el animal aprovecha mejor lo que come.
Además, en todos los casos, incluyendo el ganado vacuno, se nota una acción profiláctica cuando se adicionan zeolitas en la alimentación. Sin pretender que las zeolitas sean la panacea que resuelva los problemas del campo, vale la pena recordar que en 1980 se registraron en nuestro país 11 millones de bovinos, 2 de ovinos y 3 de caprinos y que su alimentación provoca un agudo deterioro ecológico en muchas zonas del país: por el cambio radical de la composición florística de los pastizales, la erosión acelerada y la destrucción de enormes extensiones con ecosistemas forestales.
Aunado a su uso como suplemento alimenticio, las zeolitas permiten controlar el mal olor y contenido de humedad de los desechos animales. En particular, la eliminación del amoniaco generado por descomposición fecal aporta beneficios pues reduce la incidencia de enfermedades y mortalidad en aves y cerdos. En el caso de las aves, las concentraciones de amoniaco del orden de 20 partes por millón provoca daños en el tracto respiratorio, pérdida de peso y disminución en la producción de huevos, sobre todo en criaderos en los que, debido a la creciente demanda de alimentos, la densidad de animales es muy elevada. Para estos menesteres, las zeolitas son espolvoreadas en corrales y criaderos ayudando de esta manera a mantener un ambiente más limpio y combatir la contaminación de ríos y mantos acuíferos cercanos. Además, las proteínas no digeridas que se encuentran presentes en los excrementos, representan una fuente natural de fertilizantes para suelos agrícolas. En este último rubro, en Japón, el uso de zeolitas para neutralizar la acidez de suelos volcánicos se remonta a cientos de años y representa el uso principal de estos materiales en ese país.
| GLOSARIO DEL CAP═TULO III |
molécula polar. Molécula que posee un momento eléctrico.
regeneración. Proceso para quemar cuidadosamente el carbón depositado en el catalizador después de una reacción, evitando el sobrecalentamiento que podría dañar la estructura.
reactor. Recipiente en el cual se lleva a cabo una reacción química.
adsorción. Retención de las moléculas de un gas o de una sustancia en solución o en suspensión sobre la superficie de un sólido.
selectividad. Medida del grado al que un catalizador orienta una reacción hacia los productos deseados.
difusión. Propagación de las partículas de un fluido al penetrar un sólido (o un líquido más denso); propagación que tiende a una distribución homogénea del fluido en el sólido.