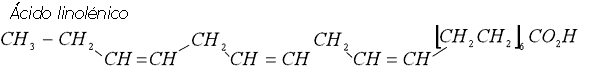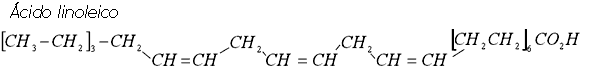VI. APLICACIONES INDUSTRIALES
LA MAYORÍA de los procesos en catálisis utilizan catalizadores sólidos. Estos sólidos, de composición altamente compleja (en ocasiones llegan a tener 10 o más elementos en su fórmula), pueden ser sin embargo descritos en forma de tres componentes elementales: la fase activa, el soporte y el promotor.
La fase activa, como su nombre lo indica, es la directamente responsable de la actividad catalítica. Esta fase activa puede ser una sola fase química o un conjunto de ellas, sin embargo, se caracteriza porque ella sola puede llevar a cabo la reacción en las condiciones establecidas. Sin embargo, esta fase activa puede tener un costo muy elevado, como en el caso de los metales nobles (platino, paladio, rodio, etc.) o puede ser muy sensible a la temperatura (caso de los sulfuros de molibdeno y cobalto), por lo cual se requiere de un soporte para dispersarla, estabilizarla y proporcionarle buenas propiedades mecánicas.
El soporte es la matriz sobre la cual se deposita la fase activa y el
que permite optimizar sus propiedades catalíticas. Este soporte puede ser poroso
y por lo tanto presentar un área superficial por gramo elevada (ver tabla 5).
TABLA 5
|
|
| Área superficial baja ( |
|
|||
|
no porosos
|
|
vidrio a - Al2O3
SiC
|
||
|
porosos
|
|
kieselguhr piedra pómez |
||
Gran área superficial ( |
|
no porosos
|
|
SiO2 - AL2O2
carbón TiO2 ZnO
|
|
porosos (
|
|
arcillas naturales Al2 O3 MgO SiO2
|
||
|
|
Esto es importante si la reacción química es suficientemente lenta; el soporte también debe tener resistencia mecánica elevada si se usan flujos muy rápidos, o tener resistencia térmica si la reacción es llevada a cabo en altas temperaturas. En algunos casos como en la reformación de gasolinas el soporte actúa también como una fase activa la cual sumada a la del platino permite el proceso completo de deshidroci-clización (transformación de moléculas lineales de bajo octanaje como el hexano o el heptano en moléculas cíclicas aromáticas como el benceno o el tolueno).
La forma física de este soporte también está definida por las condiciones de reacción (diseño del reactor) y puede ser en forma de esferas, palitos, anillos, mallas, hojuelas e inclusive monolitos en forma de panal (Figura 15).
Los soportes pueden ser amorfos (SiO2, carbón), o cristalinos, como las zeolitas o la alúmina.
Algunos de los soportes más utilizados son:
|
alúminas sílicas carbón |
zeolitas sílice-alúminas
|
El promotor es aquella substancia que incorporada a la fase activa o
al soporte en pequeñas proporciones, permite mejorar las características de
un catalizador en cualquiera de sus funciones de actividad, selectividad o estabilidad.
Se conocen dos tipos de promotores: texturales los que contribuyen a
dar mayor estabilidad a la fase activa, y electrónicos, los que aumentan
la actividad. Los casos más conocidos como promotores son el potasio (electrónico)
y la alúmina (textural) en el catalizador de hierro para la síntesis del amoniaco.
a)

b)

Figura 15. Aspecto físico de soportes para catalizadores. (a) y (b).
Los sólidos catalíticos poseen en general fuertes campos interatómicos del tipo iónico o metálico. En general compuestos orgánicos covalentes son no catalíticos. Un requerimiento fundamental es que la estructura catalítica sea estable bajo las condiciones de reacción, por ejemplo el metal debe permanecer en estado metálico y no formar un compuesto (inactivo) con la molécula reaccionante.
Los metales que catalizan las reacciones de hidrogenación usualmente quimisorben el hidrógeno no muy fuerte y lo disocian homolíticamente. Son esencialmente metales del grupo VIII (Fe, Co, Ni, Pt, Pd, Rh, etc.) y el cobre en el grupo IV. También algunos metales catalizan oxidaciones porque quimisorben oxígeno, pero la mayoría de los metales en general no pueden ser usados como tal ya que se oxidan. Sin embargo en forma de óxido muchos metales sí son buenos catalizadores de oxidación (FeO, NiO, CuO, Cr2O3, etc). El oxígeno es más fuertemente adsorbido por los metales que el hidrógeno, de manera que se forman compuestos estables. Además los enlaces metal-oxígeno requieren energías más elevadas que los enlaces metal-hidrógeno para ser rearreglados y por lo tanto temperatura más elevadas.
Los catalizadores óxidos pueden ser clasificados en dos tipos: por estructura o por su enlace con el oxígeno. Aquellos que son de estructura iónica en los cuales los átomos de oxígeno son fácilmente transferidos, la substancia puede ser un buen catalizador de oxidación parcial; en general la movilidad de los átomos de oxígeno causa que se formen óxidos no estequiométricos, por ejemplo MoO3 y mezclas de algunos óxidos como Sb2O3 - SnO2 Bi2O3 - MoO3, y MoO3 - V2O5. Los óxidos en los cuales el oxígeno está más fuertemente amarrado son estables aun en presencia de hidrógeno y pueden actuar como catalizadores de deshidrogenación en condiciones en las cuales los metales, tradicionalmente usados para estas reacciones, son fácilmente desactivados por depósitos carbonáceos, por ejemplo Cr2O3, Fe2O3.
Otro tipo de sólidos catalíticos son aquellos que pueden contener en su superficie grupos ácidos debido al gradual removimiento de agua en los tratamientos térmicos. Dentro de este grupo están incluidas las zeolitas (alumino-silícatos con estructura cristalina bien definida y con cavidades periódicas dentro de su estructura, (ver figura 16).
En el caso de estos sólidos la fuerza ácida y la naturaleza de esta acidez
(Brönsted o Lewis) son determinantes.
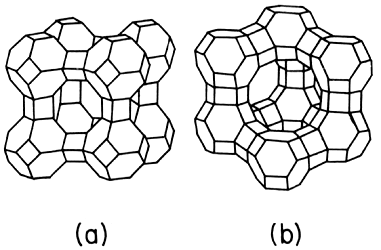
Figura 16. Estructura de una zeolita (a) tipo A y (b) tipo Xo Y.
Otro tipo muy específico de sólidos catalíticos son los sulfuros, los cuales actúan en reacciones de eliminación de azufre, nitrógeno y metales de algunas moléculas. Estos sólidos tienen la facilidad de aceptar el azufre o el nitrógeno y cederlos como H2S o NH3 regenerándose continuamente.
Para explicar el fenómeno catalítico heterogéneo se han sugerido varias teorías.
La teoría geométrica explica el acto catalítico como una correspondencia
geométrica entre los átomos activos en la superficie del catalizador y los átomos
de la molécula o la parte de ella a ser modificada en el momento de la reacción.
La principal contribución a esta teoría fue la teoría de los multipletes de
Balandín que asumía que para hidrogenar benceno se requería de un arreglo hexagonal
de 7 átomos en la cara 111 de los metales (Figura 17). Si bien se demostró que
otros arreglos también llevan a cabo esa reacción, posteriores resultados han
puesto de manifiesto la influencia definitiva de los átomos en las esquinas,
aristas o entre dos capas en formación (sitios B5) para ciertas reacciones.
Esta teoría establece entonces la importancia del arreglo geométrico de los
átomos o ensambles en la superficie del catalizador.
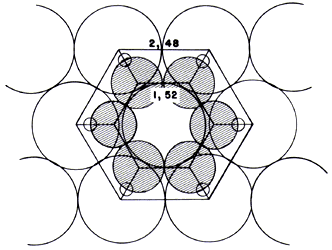
Figura 17. Modelo de adsorción de benceno en una superficie de níquel.
La teoría electrónica se basa en el hecho de que la quimisorción involucra distorsión o desplazamiento de nubes de electrones. Esto puede ser analizado en función de la teoría de bandas o de la teoría de orbitales moleculares. En el primer caso, Volkenstein postuló que la reacción está controlada por la disponibilidad de electrones u hoyos en el catalizador y que la actividad depende de la facilidad o dificultad de remover o ceder un electrón de o hacia la red. Esta teoría relativamente antigua (1953) fue reemplazada por teorías de orbitales moleculares las cuales hacen énfasis en la influencia de los vecinos más próximos en un átomo en el momento de la quimisorción.
El punto de vista actualmente más generalizado sería una combinación lineal de ambas teorías, con algunos dominios reservados en los cuales es más fácil la aplicación de una teoría que la otra.
El punto de vista químico de la catálisis vigente desde los trabajos de Sabatier en 1918, también merece ser reconocido. En esta óptica el catalizador es un reactivo que junto con los otros forma una especie inestable, transitoria en su superficie. Si la energía de formación de este intermediario inestable es baja, es decir existe poca afinidad entre catalizador y reactantes, entonces la velocidad de la reacción dependerá de la velocidad de formación de ese intermediario. Si por el otro lado esa afinidad es fuerte y el complejo es estable, la velocidad de la reacción dependerá de la velocidad de rompimiento de este intermediario. De aquí se deduce el principal postulado de la teoría química: la velocidad de la reacción es máxima cuando los enlaces entre el complejo adsorbido y el catalizador no son ni demasiado fuertes para que se quede permanentemente en la superficie ni demasiado débiles para que no se absorban.
Todas estas teorías están interrelacionadas para responder a la pregunta fundamental: ¿Qué causa que la superficie de un sólido adsorba a la molécula reaccionante, rearregle sus enlaces y desorba los productos de su superficie?
Todos los sólidos son no uniformes en el sentido que las propiedades físicas y químicas varían con la localización en la superficie. Aun en un metal puro los átomos en dislocaciones, esquinas y aristas son diferentes a los átomos de las caras. La heterogeneidad de las superficies catalíticas puede ser fácilmente mostrada por varios métodos como adsorción, envenenamiento, etc. Esta heterogeneidad condujo a H.S. Taylor en 1948 a proponer que la reacción catalítica sólo se lleva a cabo en algunos lugares específicos los cuales llamó sitios activos. Estos sitios pueden ser activos para una reacción pero no para otra y es difícil de identificarlos claramente en una reacción. Sin embargo, sí es posible estimar su número y se calcula que en los metales es del orden 1015 átomos por centímetro cuadrado y en los catalizadores ácidos de 1011 átomos por centímetro cuadrado.
La aplicación industrial de un catalizador heterogéneo requiere de la optimización de las tres principales características de un catalizador: actividad, selectividad y estabilidad.
La actividad es la consecuencia directa del efecto acelerador, y se define como una velocidad de reacción en moles transformados por segundo y por gramo de catalizador. En el caso de algunos catalizadores se prefiere dar esta velocidad corregida por el área del catalizador o mejor aún normalizada por el número de átomos de catalizador que están en contacto con la reacción (turnover number). Esta última expresión de la velocidad ha sido muy útil para establecer una clasificación de las reacciones catalíticas. Reacciones "fáciles" o insensibles a la estructura y reacciones "exigentes" o sensibles a la estructura. En el primer tipo de reacciones la velocidad depende tan sólo del número total de átomos de catalizador en contacto con el fluido, mientras que en el segundo caso depende de sólo algún tipo de átomo en particular, como por ejemplo átomos en las esquinas de los cristales de catalizador, un arreglo geométrico de átomos (dos o tres), etcétera.
En este tipo de expresión de la velocidad, la determinación del número de átomos superficiales de catalizador es la etapa crítica. Si bien en el caso de los metales es relativamente fácil evaluar ese número a partir de la quimisorción de hidrógeno, en otros compuestos catalíticos como los óxidos y los sulfuros esta determinación no está aún bien clarificada.
La selectividad de un catalizador está relacionada con el efecto orientador de la reacción en una dirección preferente. Esta cualidad es debida a que el catalizador abre nuevos caminos de reacción con menor energía de activación, los cuales desembocan en una mayor cantidad del producto o en nuevos productos. Un catalizador es más selectivo mientras da mayor cantidad del producto deseado. La selectividad se puede definir como la cantidad de producto constituido en función de la velocidad total de formación de productos.
La estabilidad de un catalizador es la variable final a optimizar en su aplicación industrial y la que se relaciona directamente con la vida útil del catalizador. La vida de operación de un catalizador debe ser evaluada en función de la cantidad de productos formados, de manera que en el mínimo de tiempo debe permitir amortizar el costo del catalizador y la operación del proceso. Si bien en las condiciones de uso de los catalizadores en la actualidad casi todos éstos sobrepasan largamente este mínimo de vida útil, se requiere de una serie de prevenciones para evitar que el catalizador se desactive prematuramente.
El fenómeno de la desactivación está íntimamente ligada a la estabilidad del catalizador. Las principales causas de desactivación son:
1) Envenenamiento de la superficie catalítica por una molécula que se adsorbe fuertemente.
2) Coquificación (formación de carbón) de la superficie por deshidrogenación de algunos hidrocarburos cíclicos.
3) Reconstrucción térmica de la superficie con disminución del área activa (sinterización).
4) Pérdida de la fase activa por desgaste del catalizador. Cuando algunos catalizadores
se desactivan pueden ser regenerados para recuperar sus propiedades (totalmente
o en parte). El proceso de regeneración está ligado al proceso de desactivación.
Algunos catalizadores de procesos como el de desintegración catalítica se desactivan
muy rápido por la formación de carbón en su superficie y deben ser continuamente
regenerados. El proceso de fluidización de la desintegración catalítica obedece
a la necesidad de trasladar continuamente el catalizador del reactor al regenerador
y viceversa (Figura 18).
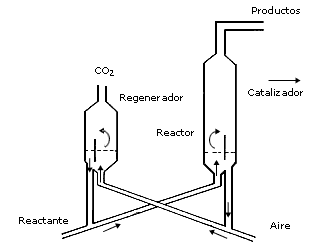
Figura 18. Esquema de un reactor de lecho fluidizado
Sobre el origen del petróleo existen las más variadas teorías que intentan explicar el problema, sin embargo, hasta la fecha no se ha llegado a aclarar esta cuestión de manera definitiva y satisfactoria. Cierta corriente de pensamiento supone para el petróleo una procedencia de tipo mineral (inorgánico) explicando su formación a través de un proceso de descomposición de carburos metálicos existentes en el interior de la Tierra. Hoy en día la opinión general se inclina a aceptar una teoría de formación del petróleo de tipo orgánico. Según esta teoría, el petróleo se ha originado a partir de restos de plantas y animales inferiores, los cuales en el transcurso de millones de años, en ausencia de aire y sometidos al calor de la Tierra y a presiones elevadas, así como quizá también a determinados tipos de bacterias, catalizadores e incluso a la acción de sustancias radiactivas, se han transformado en hidrocarburos.
Los petróleos crudos que se extraen de los diferentes campos petrolíferos de la Tierra, incluso los que son extraídos de distintas profundidades de un mismo campo petrolífero, son de naturaleza muy variada incluso en su apariencia externa. Aparte de las diferencias externas, los petróleos químicamente se asemejan unos a otros ya que son fundamentalmente mezclas de hidrocarburos, es decir, combinaciones de carbono (C) e hidrógeno (H), de naturaleza muy variada. El petróleo bruto es entonces una mezcla de diferentes hidrocarburos (la mayor parte saturados) que pueden ser agrupados por un lado en una de las tres familias siguientes: parafinas (e isoparafinas), naftenos y aromáticos, y por otra parte también pueden agruparse según el número de átomos de carbono que existen en la molécula o según el punto de ebullición o volátilidad que depende fundamentalmente del tamaño de la molécula y de su conformación.
El gas natural por ejemplo, consiste en moléculas ligeras como el metano (CH4) de un átomo de carbono (C1), el etano (C2H6) de dos átomos de carbono (C2), el propano (C3H8) que es un (C3) y butano (C4H10) que contiene cuatro átomos de carbono (C4). La composición típica del gas natural es la siguiente: C1 79%, C2 6.5%, C3 6.2%, C4 2.3%, iC4 1.4% e iC+5 3%.
El gas natural viene acompañado de ácido sulfhídrico (H2S)
que es corrosivo, por lo que es necesario una purificación para eliminarlo.
Tradicionalmente el gas natural es utilizado como combustible para uso doméstico
(estufas) e industrial (generadores de vapor para turbinas). En la última década
sin embargo, su consumo para la producción de hidrógeno se ha elevado. El hidrógeno
tiene mucha demanda en diferentes procesos de una refinería. La reacción típica
del metano con vapor de agua es:
El hidrógeno se separa del CO y puede ser utilizado para la síntesis del amoniaco a través de la reacción:
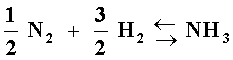
Estas dos reacciones requieren de catalizadores para su aplicación industrial.
El tamaño de las moléculas de hidrocarburo que componen el petróleo varía desde C1 hasta C40 - C50 o aun mayores, de ahí que también se le pueda clasificar en crudos ligeros o pesados. El contenido de impurezas como azufre (S), nitrógeno (N) y vanadio (V) de un petróleo también es muy importante ya que determina la calidad y el precio del mismo.
El petróleo, una vez extraído, es enviado por oleoductos hacia las refinerías. Allí se almacenan y mezclan los diferentes tipos de crudos con el objeto de cumplir con las especificaciones para las cuales fue construida la refinería. El crudo mexicano pesado (tipo maya) requiere de instalaciones más complejas. Las cargas (crudos) son separadas inicialmente por destilación (previo lavado para eliminar las sales incrustantes). En este proceso aproximadamente 75% de los compuestos son volátiles quedando un residuo llamado asfáltico en el fondo.
La fracción volátil se separa como sigue, en orden decreciente de punto de ebullición:
1) hidrocarburos gaseosos (metano o butano),
Generalmente los productos obtenidos en este proceso no son suficientes en calidad ni cantidad para los requerimientos actuales. Por lo tanto se requiere transformar estos productos en otros de uso más conveniente. La mayor parte de estos procesos son catalíticos (90%).
En relación a la aplicación de sus productos, el petróleo puede ser separado en:
1) combustible para automóviles, aviones y máquinas diesel,
2) combustibles para calefacción e industrias (calderas),
3) materia prima para la obtención de hidrógeno y gas para cocina,
4) materia prima para productos químicos y petroquímicos,
5) aceites lubricantes y grasas, sin olvidar un objetivo contemplado una década anterior y que fue
6) obtener alimentos (proteínas).
PROCESOS CATALÍCOS DEL PETRÓLEO
El objetivo de estos procesos es el de modificar las fracciones del petróleo para la obtención de productos en cantidad y calidad acorde con los requisitos del mercado. Podemos clasificarlos en la siguiente forma:
a) Desintegración. Este proceso permite transformar moléculas pesadas
en combustibles livianos y materias primas para la industria petroquímica. Industrialmente
se conoce como proceso FCC (Fluid Catalytic Cracking) y varias reacciones tienen
lugar en el proceso, cada una con diferente grado de importancia. Algunas de
ellas son: rompimientos de enlaces carbono-carbono, formación de olefinas y
ciclización. Dichas reacciones transcurren vía mecanismos por ion carbonio.
Un ion carbonio (o carbocatión) es un grupo de átomos que incluyen a un átomo
de carbono compartiendo seis electrones y una carga positiva.
|
|
|
R
|
|
|
|
|
|
|
|
|
R
|
-
|
C
|
+
|
|
|
|
|
|
|
|
R
|
|||
|
Ion carbonio
|
|||
Inicialmente, los catalizadores utilizados en estos procesos eran arcillas acidificadas, pero en la actualidad han sido reemplazadas por aluminosilicatos microcristalinos sintéticos, denominados zeolitas o mallas moleculares. Estos sólidos se caracterizan por tener una acidez elevada y una estructura porosa bien definida (Figura 16).
b) Reformación de gasolinas. Este proceso permite aumentar el
rendimiento de gasolinas así como el número de octano5 ![]() en
ellas. El contenido original de gasolinas que proviene del petróleo es insuficiente
para cubrir la alta demanda del mercado, por lo que se hace necesario transformar
en gasolinas algunas fracciones del petróleo de menor valor. Las moléculas a
las que se les asigna en mayor índice de octano son las siguientes: alcanos
ramificados y aromáticos. Los alcanos lineales y naftenos tienen menor índice
de octano, y es deseable transformarlos en isómeros (ramificados) y en aromáticos
respectivamente. Durante el proceso de reformación se libera como producto hidrógeno.
en
ellas. El contenido original de gasolinas que proviene del petróleo es insuficiente
para cubrir la alta demanda del mercado, por lo que se hace necesario transformar
en gasolinas algunas fracciones del petróleo de menor valor. Las moléculas a
las que se les asigna en mayor índice de octano son las siguientes: alcanos
ramificados y aromáticos. Los alcanos lineales y naftenos tienen menor índice
de octano, y es deseable transformarlos en isómeros (ramificados) y en aromáticos
respectivamente. Durante el proceso de reformación se libera como producto hidrógeno.
Los catalizadores utilizados en este proceso son a base de platino (Pt) cuya concentración es del orden de 0.3% más un segundo metal (renio, iridio, estaño) ambos soportados en una alúmina (Al2O3) de transición (g o n).
Este proceso, con ciertas modificaciones y un catalizador diferente, conduce a una planta productora de aromáticos, comúnmente conocida como BTX (Benceno, Tolueno, Xilenos) para la obtención de productos petroquímicos.
c) Hidrotratamientos. Los procesos denominados de hidrotratamiento tienen como finalidad la eliminación de impurezas como azufre, nitrógeno, oxígeno, níquel o vanadio que acompañan a las moléculas de hidrocarburo que componen el petróleo. Estos tratamientos permiten eliminar problemas de "envenenamiento del catalizador" utilizado en otros procesos de refinación, se aumenta la calidad de los productos y se evita la contaminación atmosférica. Los catalizadores utilizados son sulfuros de molibdeno y cobalto o níquel, los cuales se soportan en una alúmina de transición (g o n). Este proceso ha venido aplicándose cada vez con más frecuencia ya que el uso de petróleo pesado que contiene muchas impurezas se ha incrementado.
d) Hidrogenación-deshidrogenación. Estos procesos se utilizan generalmente para obtener olefinas para petroquímicos o como procesos de purificación. Los catalizadores que se usan son a base de níquel, platino u óxidos de cromo y hierro.
e) Oxidación. Mediante este proceso, las olefinas y aromáticos se transforman en aldehídos, alcoholes, cetonas, peróxidos y óxidos que tienen gran demanda en petroquímica. Los catalizadores son óxidos de algún metal que tiene la propiedad de ceder o incorporar oxígeno en su superficie fácilmente.
f) Alquilación. El término alquilación se aplica generalmente a reacciones catalizadas entre el isobutano y varias olefinas ligeras. El producto es un hidrocarburo saturado altamente ramificado que se utiliza para incrementar el índice de octano de la gasolina. La reacción de alquilación involucra la adición de un protón H+, a un doble enlace de una olefina para formar un ion carbonio. El catalizador debe ser de tipo ácido para favorecer la formación de cationes (ion carbonio) y los más utilizados son el tricloruro de aluminio con ácido clorhídrico, así como el ácido sulfúrico y el ácido fluorhídrico.
g) Isomerización. La isomerización es una parte pequeña pero importante de los procesos de una refinería. El butano se isomeriza a isobutano para luego ser utilizado para la alquilación del isobutileno y otras olefinas. La fracción de 5 y 6 átomos de carbono que viene naturalmente en la gasolina, se isomeriza para dar productos de gran octanaje que después se mezclarán con gasolinas de bajo índice de octano.
El proceso de isomerización del butano fue desarrollado durante la segunda Guerra Mundial. El catalizador utilizado fue AlCl3. En la actualidad, se prefiere utilizar un catalizador dual como por ejemplo platino en zeolitas. Las dos funciones que tienen lugar son la función ácida (zeolitas) y la función hidrogenante-deshidrogenante en el metal.
HIDROGENACIÓN DE GRASAS Y ACEITES
La naturaleza nos proporciona una gran variedad de productos grasos vegetales y animales con valor nutricional. Las aplicaciones de esos productos son muy variadas como por ejemplo en pasteles y galletas, aceites para freir, margarinas, alimentos enlatados, etcétera.
Esos aceites y grasas vegetales son mezclas complejas de triésteres
de glicerol que pueden ser representados con la fórmula:
| CH2O. CO. R1 | |
|
|
|
|
| CHO. CO. R2 | |
|
|
|
|
| CH2O. CO. R3 | |
Los grupos R1, R2, R3, contienen 15, 17 u ocasionalmente algún número más alto de átomos de carbono.
Por desgracia, algunos de los aceites tal como son extraídos no son directamente aplicables para su uso en alimentos. Algunas de las razones son: su falta de sabor, su consistencia inapropiada y un alto contenido de grupos difíciles de digerir. Adicionalmente, debido a su alta concentración de dobles enlaces, los aceites al natural fácilmente se oxidan en el aire produciendo un sabor ácido, o como comúnmente se dice, el aceite se vuelve rancio. Este proceso reduce la vida útil de los aceites, lo cual limita enormemente su aplicación industrial. Después de algunos años, la demanda de un producto sólido barato, substituto de la mantequilla ha sido notable y actualmente es una parte importante del consumo de aceites (la margarina).
La composición química de un aceite se da normalmente en términos de los ácidos
grasos que resultan de una hidrólisis. Por ejemplo:
|
|
||||||||||||||||||||||||
En la siguiente tabla se ilustran ejemplos de ácidos compuestos de una cadena
de 18 átomos de carbono R. CO2H, donde
R = 17
|
|
|
|
|
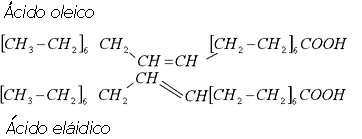
|
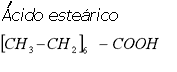 |
De estas fórmulas químicas observamos que el número de dobles enlaces va disminuyendo del ácido linolénico al linoleico, al oleico, etc., hasta llegar al esteárico que está completamente saturado. Adicionalmente hay diferencias entre el ácido oleico (el más importante) y el eláidico debido a la posición de la doble ligadura (posición cis o trans, dependiendo de que los dos carbonos que la comparten estén en el mismo lado o alternados).
Con productos de alto grado de insaturación (dobles enlaces) como los que contiene el ácido linolénico se tiene una oxidación muy rápida (rápidamente se obscurece y se arrancia) por lo que es necesario disminuir su concentración. Con productos que contengan poco grado de insaturación como el esteárico, el punto de fusión es tan alto que se solidifica a temperatura ambiente y por lo tanto será más apropiado para producir margarinas. Sin embargo en la margarina el ácido esteárico no es de fácil digestión y es deseable tener adicionalmente ácido linoleico en alguna proporción ya que se piensa que juega un papel importante en la prevención del colesterol.
Por lo tanto, dependiendo del producto buscado, se debe hacer un ajuste entre los diferentes componentes ácidos de un aceite. El aceite de soya tiene aproximadamente la siguiente composición: ácido linolénico 8%, ácido linoleico 50%, ácido oleico 27%, ácido esteárico 4%, ácido plamítico 10% (este ácido tiene 16 carbonos y está completamente saturado). Para su mejor aprovechamiento se desea disminuir al mínimo la cantidad de linolénico, disminuir un poco la de linoleico, aumentar la de oleico, sin pasar mucho eláidico a esteárico. En términos químicos se desea obtener una hidrogención parcial controlada de los dobles enlaces (para obtener ácido oleico) sin una excesiva isomerización cis-trans (de oleico a eláidico) y sin excesiva hidrogenación a esteárico). Estas características hacen necesaria la presencia de un catalizador.
La reacción se lleva a cabo utilizando un catalizador de níquel soportado o níquel Raney a temperaturas situadas entre 150 y 200°C y 0.1 a 0.7 MPa de hidrogeno puro. Casi todos los aceites aun cuando son purificados contienen compuestos de azufre que envenenan al catalizador por lo que es necesario cambiarlo frecuentemente. La mayoría de los procesos se llevan a cabo en estático, en autoclaves agitadas. Un hecho notable es que la reacción se efectúa mejor con limitaciones difusionales del hidrógeno. Esto se logra con presiones de hidrógeno bajas, agitación moderada, alta temperatura y alta concentración de catalizador. Esto trae como consecuencia una concentración baja de hidrógeno en la superficie del catalizador y por lo tanto no se produce una hidrogenación excesiva. Como las moléculas de reactivos son muy grandes se desean poros grandes que eviten un proceso limitado por difusión de reactivos o productos.
En muchos casos el níquel es introducido como formiato de níquel disperso en una grasa, el que se descompone dentro del reactor en el momento de la reacción.
La utilización de convertidores catalíticos para el control de emisión
de contaminantes en los escapes de los automóviles es una de las más nuevas
aplicaciones de los catalizadores. En la actualidad, en los Estados Unidos de
Norteamérica, la mayoría de los autos vienen equipados con un dispositivo catalítico
que ha permitido disminuir a niveles bastantes bajos la concentración de los
contaminantes más usuales producidos durante la combustión de la gasolina.
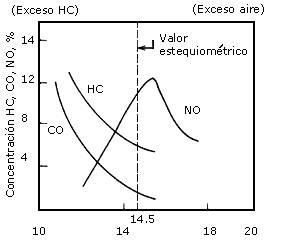
Figura 19. Concentración de contaminantes en función de la relación aire/combustible (A/F).
Los contaminantes usuales provenientes de los escapes de los automóviles son el monóxido de carbono (CO), los óxidos de nitrógeno (NOx) y los hidrocarburos (HC). La composición de los gases de escape depende de la relación aire/combustible = A/F que sea alimentada a la máquina. Cuando no se produce (NO), la relación óptima aire/combustible que conduce a la combustión (quemado) completa de los hidrocarburos que componen la gasolina convencional es A/F = 14.5. Suponiendo condiciones ricas en combustible, es decir, <14, la composición de un gas de escape de automóvil podría ser por ejemplo 3% CO, 1% H2, HC 1%, O2 1%, CO2 y H2O 10%, compuestos de plomo, azufre y halógenos. Cuando la relación aire/combustible pasa de condiciones ricas en combustible a condiciones ricas en oxigeno (aire), la composición varía como se muestra en la figura 19. A medida que aumenta la cantidad de oxígeno, los productos que no sufrieron una combustión completa disminuyen y la concentración de (NO) pasa por un máximo después del valor estequiométrico p = 14.5. La eliminación completa de productos no quemados, HC y CO, y de NO es imposible por lo que se han fijado normas en los Estados Unidos para los límites de emisiones permitidas.
En la tabla siguiente se muestran las concentraciones en gramos por milla y
la evolución de datos estándares:
|
|
|||
|
Emisores g / milla
|
|||
|
|
|||
|
HC
|
CO
|
NOx
|
|
|
|
|||
|
1968
|
17.0
|
125.0
|
6.0
|
|
1978
|
01.5
|
015.0
|
3.1
|
|
Actualmente en California
|
00.9
|
009.0
|
2.0
|
|
|
|||
Básicamente se requieren dos catalizadores diferentes para la purificación
de los gases de emisión; uno para el control de (CO) y (HC), es decir, un catalizador
de oxidación trabajando en condiciones de exceso de oxígeno; y otro para la
remoción de (NOx) que será un catalizador de
reducción trabajando en atmósfera rica en combustible. El diagrama del
convertidor catalítico duál se muestra a continuación. Este fue el diseño utilizado
en los inicios de la aplicación del convertidor catalítico (1969):
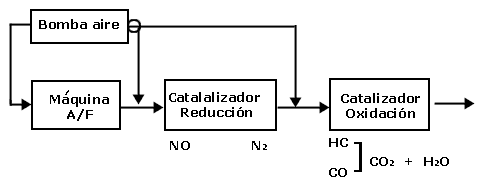
Dos catalizadores diferentes son utilizados en serie: para la oxidación los
catalizadores son metales de transición como Pt (platino) y Pd paladio),
para la reducción Rh (rodio) y Ru (Rutenio). La cantidad de estos
metales en el catalizador varía de 0.03 a 0.16 onzas/automóvil.
Este tipo de convertidor dio lugar a diferentes problemas por lo que se diseñó
un convertidor catalítico único (tres funciones catalíticas en un solo catalizador).
Las tres reacciones que se llevan a cabo son:
| NO reducción |
| CO oxidación |
| HC oxidación |
La única restricción para el uso de este catalizador es que trabaja en una región
de la relación aire/combustible muy estrecha y cercana a la relación estequiométrica
A/F = 14.5. Se trata de un catalizador compuesto, los más populares son:
Pt - Rh y Pt - Pd - Rh. El diagrama ahora es el siguiente:
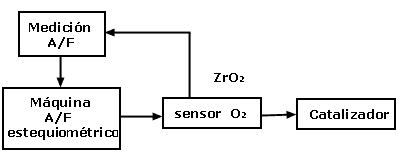
La restricción de operación hace necesaria la presencia de un sensor de O2 que permite ajustar continuamente la mezcla aire/gasolina y mantener el valor muy cercano al estequiométrico.
Existen varias formas físicas del convertidor catalítico que se encuentra localizado en el escape del automóvil. Sin embargo las más usuales incluyen pellets (pequeñas bolitas) y monolitos de cerámica que sirven como soporte de las partículas metálicas que funcionan como catalizador.
El problema del control de emisión de contaminantes producidos por los escapes de los automóviles se ha visto resuelto mediante el uso de los convertidores catalíticos, sin embargo es necesario hacer resaltar las restricciones más importantes que limitan el uso de tales dispositivos.
Como se dijo anteriormente, la máquina debe trabajar con una relación aire/combustible
muy cercana al valor estequiométrico de A/F = 14.5; en la ciudad de México,
por ejemplo, situada a una altitud de 2 400 m, la atmósfera es pobre en oxígeno
lo que hace crítico este problema. Modificaciones en la ingeniería automotriz
son por tanto necesarias. Por otra parte es absolutamente indispensable que
la gasolina utilizada esté libre de plomo,6 ![]() ya
que éste es un veneno para el catalizador y limita la vida activa del mismo.
Finalmente en las condiciones actuales el límite de uso de un convertidor catalítico
rebasa con facilidad las 50 000 millas de utilización.
ya
que éste es un veneno para el catalizador y limita la vida activa del mismo.
Finalmente en las condiciones actuales el límite de uso de un convertidor catalítico
rebasa con facilidad las 50 000 millas de utilización.
Actualmente en la ciudad de México y dadas las condiciones geográficas de la
misma no se puede pensar en un catalizador que pueda resolver por completo el
problema de la contaminación ambiental. Sin embargo, es posible desarrollar
un catalizador que permita abatir la concentración de uno de los contaminantes
más críticos, como es el NOx.