III. EL PROCESO DE INFECCIÓN VIRAL
LA INFECCIÓN se inicia cuando entran en contacto una partícula
viral y una célula susceptible. En el caso de fagos y bacterias en un cultivo
en suspensión, la interacción entre ambos ocurre por simple difusión, ya que
partículas con el tamaño de bacterias y virus se encuentran en permanente movimiento
browniano cuando están en suspensión. En el caso de los virus animales, la difusión
es también el factor más importante que afecta la unión con células animales
en cultivo, ya que esta asociación es independiente de la temperatura mientras
ésta no afecte el movimiento browniano. Probablemente en el caso de la infección
en el animal entero existen otros factores que afectan la asociación entre el
virus y las células; sin embargo, es muy difícil diseñar experimentos para estudiar
la interacción entre virus y células animales in vivo. En el caso de
las plantas, la infección viral generalmente es consecuencia de daño mecánico
previo, hecho a la planta por factores externos. En otras ocasiones, la infección
viral en plantas es el resultado de la acción de insectos portadores del virus
que actúan como vectores del mismo, introduciéndolos en plantas susceptibles.
La mayoría de los fagos se adsorben (pegan) a la pared celular de las bacterias susceptibles, pero algunos fagos también son capaces de adsorberse a los flagelos, vellosidades (pili) o cápsulas presentes en la superficie de la bacteria hospedera. El caso mejor documentado de adsorción viral está representado por los fagos T2 y T4, los cuales son virus con morfología compleja que incluye una cabeza, cola, placa basal, clavijas y fibras de la cola. La pegada inicial de estos fagos a los receptores presentes en la superficie de la bacteria ocurre por medio de los extremos distales de las fibras de la cola. Estas fibras largas que hacen la primera unión se doblan por en medio, de manera que sus extremos distales hacen contacto con la pared celular a muy corta distancia del punto medio de la partícula viral. Después de ocurrida la adhesión, la partícula viral se aproxima a la superficie de la célula. Cuando la placa basal del fago se encuentra a unos 100Å (angstrom= 10-10m) de la pared celular, se establece contacto entre las pequeñas clavijas de la placa basal y la pared celular, pero no existe evidencia de que la propia placa basal se adhiera a la pared celular (figura III.1.).
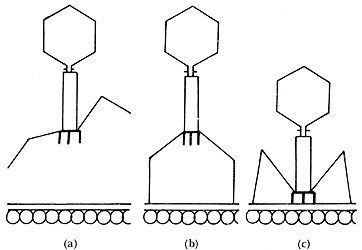
Figura III.1. Esquema de los principales eventos en la adsorción del bacteriófago
T4 a la pared celular de la bacteria E. coli.(a) el fago libre muestra
las fibras y clavijas de la cola. (b)Adhesión de las fibras de la cola. (c)
El fago se acerca a la pared celular y las clavijas entran en contacto con la
pared celular.
Algunos fagos con cola, como el fago PBSl, se adsorben a los flagelos bacterianos
en lugar de a la pared celular. La punta de la cola de este fago tiene una fibra
flexible que se adhiere alrededor del filamento del flagelo y entonces el fago
se desliza por el filamento hasta alcanzar la base del flagelo. Otros fagos
con cola se adsorben a la cápsula de la bacteria. Finalmente, algunos fagos
se adhieren a los llamados pili o vellosidades sexuales de las bacterias
que contienen el factor sexual "F" o ciertas colicinas (factores de resistencia
contra agentes antimicrobianos). Los fagos filamentosos que contienen ADNARN
En el caso de los virus animales, ha sido posible estudiar cómo se adhieren
a las células en cultivo y de esta manera determinar el efecto que tienen la
temperatura y la concentración de iones en el medio sobre la adsorción viral.
Al igual que en el caso de los fagos, la adhesión parece ser de tipo electrostático
y es afectada en forma importante por la presencia de iones en medio de cultivo.
Sin embargo, todavía se sabe poco en relación con la naturaleza de los receptores
celulares para los virus animales, con excepción de aquellos receptores involucrados
en la adsorción de los virus de la poliomielitis, la influenza y el SIDA
(síndrome de inmunodeficiencia adquirida). Cuando las células susceptibles al
virus de la polio son disociadas al someterlas a congelamiento y subsecuente
descongelamiento, liberan una substancia que constituye el receptor celular
para el virus. Aparentemente, este receptor es de naturaleza proteica y sus
moléculas pueden ser saturadas en presencia de un exceso de partículas virales.
Se ha estimado que existen aproximadamente 3 x 10 3
receptores para el poliovirus en la superficie de cada célula susceptible; esto
representa un área equivalente al 0.3% de la superficie total de la célula.
Las células que carecen de tal receptor específico son inmunes a la infección
por poliovirus. Sin embargo, tales células no susceptibles pueden permitir la
replicación normal del virus cuando éste es introducido en ellas por métodos
artificiales.
Cuando se incuban virus de la influenza en presencia de eritrocitos (glóbulos rojos), las células se aglutinan (hemaglutinación) y este fenómeno puede ser utilizado para titular la concentración del virus, simplemente determinando a qué dilución el virus se vuelve incapaz de producir hemaglutinación. Células aglutinadas a 4°C pueden ser calentadas a 37°C, lo cual produce separación de las células y el virus eluido de estas células puede ser utilizado para aglutinar un nuevo lote de células. Sin embargo, las células que previamente estuvieron en contacto con el virus son incapaces de ser reaglutinadas cuando entran en contacto con virus frescos. Esto se debe a la producción y activación de una enzima conocida como enzima destructora del receptor (EDR). Si se aplica una solución de esta enzima al tracto respiratorio de animales experimentales, es posible evitar la infección por el virus de la influenza, ya que el virus no puede adsorberse a las células cuyo receptor específico para el virus ha sido degradado por la acción de la enzima. El receptor para el virus de la influenza se caracteriza por tener una molécula de ácido neuramínico en su extremo distal, el cual forma parte de un pequeño polímero de moléculas de carbohidrato (oligosacárido); este polímero está unido en forma covalente a una proteína insertada en la membrana celular.
El caso mejor estudiado de la penetración de un virus en la célula hospedera
está representado por el caso del fago T2. La cola de este fago es contráctil
y en su forma extendida consiste de 24 anillos de subunidades que forman una
funda que rodea a un elemento central. Cada anillo consta de 6 subunidades pequeñas
y 6 subunidades mayores. Después de la adsorción del fago a la pared celular,
ocurre una contracción de la cola que resulta en una fusión de las subunidades
pequeñas y grandes para dar 12 anillos de 12 subunidades. El núcleo de la cola
no es contráctil y por lo tanto es expulsado e impulsado a través de las capas
externas de la bacteria; a continuación, la cabeza del fago se contrae y esto
resulta en la inyección del ADNATP)
en la funda de la cola del fago; la energía para la contracción de esta funda
proviene de la conversión de la ATP en adenosina difosfato (ADP)
por medio de una reacción hidrolítica que libera un grupo fosfato de la ATP
(figura 111.2.).
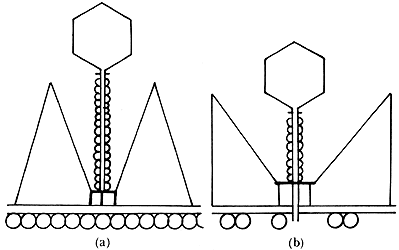
FIGURA III.2. Esquema del mecanismo de penetración del material genético del
fago T4 o T2 a través de la pared celular de la bacteria. (a) Las clavijas del
fago entran en contacto con la pared celular y la funda se encuentra extendida.
(b) La funda de la cola se contrae y el material genético del fago penetra la
pared celular; la lisozima presente en el fago digiere la porción de pared celular
localizada directamente bajo la partícula viral.
Muchos bacteriófagos carecen de fundas contráctiles y todavía se desconoce el mecanismo detallado por medio del cual penetran en las bacterias. Sin embargo, existe evidencia de que algunos de estos fagos introducen en la célula material proteico además del ácido nucleico.
Las células animales carecen de pared celular y sólo están rodeadas por la membrana plasmática que es muy flexible y cambiante en sus componentes estructurales. Las células animales continuamente introducen elementos del medio externo por medio del proceso de pinocitosis y a través de un procedimiento similar, pero inverso, exportan al medio diversas substancias como enzimas, hormonas y neurotransmisores. Los virus animales solamente pueden infectar células que poseen receptores específicos para el virus en particular. Por lo tanto, se requieren diferentes receptores para diferentes tipos de virus. Se conoce con poco detalle el mecanismo preciso por medio del cual los virus penetran en las células animales. Buena parte del problema radica en que la mayoría de las partículas virales que infectan a una célula son incapaces de iniciar con éxito la multiplicación del virus.
Usualmente, estas partículas no infecciosas superan a las partículas infecciosas
en proporción de 1000:1, y no existen métodos bioquímicos o microscópicos que
puedan distinguir entre ambos tipos de partículas virales antes de que haya
ocurrido la infección propiamente dicha. Todos los virus ARN y
ADN producen estas partículas defectuosas conocidas como interferentes-defectuosas
(ID), las cuales son el resultado de errores en la síntesis de ácido nucleico
viral. Estas partículas ID son mutantes que carecen de segmentos de ácido nucleico
y por lo tanto son incapaces de reproducirse sin la ayuda de partículas virales
normales capaces de suplir la información genética ausente en el genoma de las
partículas ID. Por esta razón, la propagación de las partículas ID es óptima
cuando las células son infectadas en altas multiplicidades de infección. Las
partículas ID deprimen el rendimiento de la progenie viral infecciosa debido
a que compiten por ciertos productos sintetizados en cantidades limitadas por
las partículas virales infecciosas.
Los virus con envoltura pueden penetrar a la célula hospedera por medio de
la fusión entre las envolturas virales y la membrana de la célula. Tanto los
virus con envoltura como los virus que carecen de ésta pueden ser introducidos
a la célula por medio del proceso de pinocitosis (figura III.3.). La
fusión de membranas ocasiona la liberación del genoma viral en el citoplasma
de la célula, pero en el caso de la pinocitosis el virus entero es contenido
en una vesícula formada a partir de la membrana plasmática. Es probable que
esta vesícula se fusione a su vez con alguna de las membranas internas de la
célula y la cubierta viral es modificada a consecuencia de esta fusión, lo que
da lugar a la liberación del ácido nucleico viral. Es importante hacer notar
que la penetración del virus y la subsecuente eliminación de las envolturas
virales no implican forzosamente la presencia intracelular de ácido nucleico
viral desnudo. El ácido nucleico viral puede permanecer unido a las proteínas
internas del virus, las cuales pueden incluir enzimas necesarias para la replicación
del virus. En el caso de cierto tipo de virus ARNARNARN

FIGURA III.3. Esquema de la penetración y desnudamiento
de los virus en células animales. (a) Penetración y desnudamiento por medio
de la fusión de las membranas viral y plasmática. (b) Penetración y desnudamiento
por pinocitosis seguida por fusión con la membrana citoplasmática interna.
La gran mayoría de los virus animales son muy ineficientes en lograr la penetración
de las células susceptibles. Por ejemplo, en infecciones por poliovirus, la
mayor parte del ARN
En teoría, resulta posible evitar las infecciones virales interfiriendo con los mecanismos de adsorción y penetración del virus. Sin embargo, la mayoría de los receptores están constituidos por proteínas y glicoproteínas que tienen funciones importantes en el funcionamiento normal de la membrana celular y sólo en forma incidental resultan ser de importancia tal para las necesidades del virus. Por lo tanto, estas proteínas no pueden ser eliminadas o modificadas sin afectar a la célula misma. Todavía se sabe muy poco en relación con la química de las proteínas que forman parte de las cubiertas virales y hasta la fecha solamente se conoce una sustancia bien caracterizada capaz de inhibir la adsorción y penetración de un virus sin que, por otra parte, induzca efectos secundarios indeseables. Esta sustancia es la amantadina, que puede evitar ciertos eventos en la penetración del virus de la influenza, pero todavía no se conoce con exactitud su mecanismo de acción.
c) CLASIFICACIÓN FUNCIONAL DE LOS VIRUS
Los virus muestran una gran diversidad en su morfología: la estructura de sus
ácidos nucleicos, el modo de infección, regulación y desarrollo. Por lo tanto,
resulta difícil establecer un concepto clasificador que simplifique el análisis
del proceso de replicación (reproducción) viral. Sin embargo, David Baltimore
ha propuesto un sistema de clasificación de los virus basado en el modo como
éstos expresan sus genes y llevan a cabo la replicación de su material genético.
En esta clasificación los virus están divididos en grupos de acuerdo con el
modo como llevan a cabo la síntesis del ARNARNARNm es designado como positivo (+) ARN y las
cadenas de ADN o de ARN o de ambos que son complementarias
en secuencia de nucleótidos a la del ARNm, son denominadas como
negativas (-). Aquellas cadenas de nucleótidos cuya secuencia no es complementaria
a la del ARNm son denominadas también como positivas (+). Con base
en esta terminología, es posible distinguir seis clases de virus:
Clase 1: está constituida por todos los virus que tienen un genoma formado
por ADN de cadena doble. En esta clase no se aplica la designación
+/-, pues diferentes especies de ARN>m se originan a partir de diferentes
segmentos de ambas cadenas del ADN viral.
Clase II: consta de virus cuyo genoma está constituido por ADNARNm.
En esta clase de virus, el ADN del genoma debe ser temporalmente
convertido a la forma de cadena doble antes de que ocurra la transcripción del
ADN en ARNm.
Clase III: está compuesta por virus cuyo genoma es ARN
de cadena doble. Todos los virus conocidos que forman parte de este grupo tienen
genomas segmentados, pero el ARNARN
Clase IV: está representada por los virus con ARN de cadena
sencilla cuya secuencia es la misma del ARNm. En estos virus la
síntesis de una cadena complementaria al ARNARN
Clase V: está formada por los virus que poseen un genoma de ARNARN
Clase VI: consta de virus que poseen un genoma de ARN de
cadena sencilla y que producen un ADN intermediario durante el
proceso de replicación. En algunos miembros de esta clase el ARN
del genoma y el ARNm tienen la misma secuencia.
d) LA REPLICACIÓN DEL ADN VIRIL
El mecanismo por medio del cual una molécula de ADN es duplicada
(replicada) in vivo es el mismo, independientemente del origen viral
o celular del ADN. A primera vista, la replicación del ADN
parece un proceso sencillo: una enzima polimerasa se mueve a lo largo de la
molécula de ADN produce dos cadenas hijas a partir del templado
constituido por las cadenas de la molécula madre. Este modelo de replicación
implica que en cada una de las moléculas hijas existe una cadena derivada de
la molécula original y otra cadena formada por ADN recién sintetizado,
o sea, la replicación del ADN es de tipo semiconservativo. Este
hecho fue demostrado por Meselson y Stahl a través de un famoso y ahora ya clásico
experimento.
Debido a su tamaño relativamente pequeño y a la facilidad con que pueden ser
manipuladas in vitro, las moléculas del ADN viral han sido
frecuentemente utilizadas para estudiar el mecanismo de la síntesis de ADN
en general. Toda cadena, lineal de ADNADN son antiparalelas, o sea, tienen secuencias complementarias
pero que corren e direcciones opuestas. Por lo tanto, una consecuencia del modelo
semiconservativo para la replicación del ADN consiste en que una
de las cadenas hijas es sintetizada en dirección 3' ®
5', mientras que la otra cadenas, hija es sintetizada en dirección 5'®
3'. Sin embargo, todas las ADN polimerasas, tanto virales como
celulares, purificadas hasta la fecha, sintetizan ADN solamente
en la dirección 5'® 3'. Una solución a este
problema consiste en que la síntesis de una de las cadenas hijas se realiza
en forma continua en dirección 5'® 3' a lo
largo de la cadena madre que sirve como templado, la llamada cadena líder.
Mientras que la síntesis de la otra cadena hija ocurre en forma discontinua
pero también en dirección 5'® 3' a lo largo
de la otra cadena madre denominada la cadena rezagada. Los fragmentos de ADN
producidos por la síntesis discontinua (fragmentos de Okazaki) pueden ser unidos
por la acción de una enzima conocida como ADN ligasa. Sin embargo,
otro problema en la replicación del ADN consiste en que las ADN
polimerasas necesitan la presencia de un fragmento de ácido nucleico que sirva
como punto de iniciación para la síntesis de ADN, o sea, no pueden
iniciar la síntesis de novo. Por su parte, la ARN polimerasa
que sintetiza el ARN no requiere de la presencia de un fragmento
iniciador para llevar a cabo la síntesis del polinucleótido. Por lo tanto, la
ARNARN
complementarios a la cadena madre de ADN; dichos fragmentos servirán
como puntos de iniciación para la síntesis del ADN que formará
parte de la nueva cadena hija. Posteriormente, son degradados los fragmentos
de ARNADN
resultantes son unidos por acción de la enzima ADN ligasa.
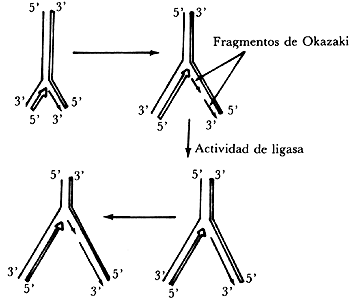
Figura III.4. Esquema de la síntesis discontinua del ADN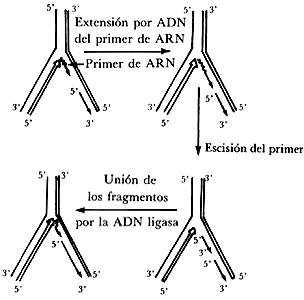
Figura III.5 Participación de un primer de ARN
El proceso de replicación del ADNADN. Se ha calculado que el índice de error en la fidelidad
de copiado equivale a la introducción de un nucleótido erróneo por cada 109
-10 10 nucleótidos copiados en forma complementaria.
Esta alta fidelidad de copiado se debe a que las ADN polimerasas
(cuando menos en bacterias) tienen la capacidad de "editar" el ADN
recién sintetizado y corregir los errores en la copia de la secuencia de nucleótidos
por medio de una actividad enzimática asociada con la polimerasa; esta actividad
conocida como exonucleasa 3'![]() 5' permite romper la unión establecida entre el OH- presente
en el extremo 3' de la cadena de
5' permite romper la unión establecida entre el OH- presente
en el extremo 3' de la cadena de ADNADN (figuras
III.4 y III.S.).
Los bacteriófagos T contienen moléculas lineales de ADN de cadena
doble, las cuales son replicadas ya sea por la acción de polimerasas específicas
a estos fagos o por las polimerasas de la célula hospedera que han sido modificadas
en su especificidad a consecuencia de la infección viral. Los productos inmediatos
de la replicación del ADNADN original. Estas grandes moléculas pueden
ser formadas por la unión de los extremos de moléculas lineales de ADN
o por medio de un proceso cíclico llamado círculo rodante que permite
la replicación continua de un templado circular para producir estructuras compuestas
de múltiples unidades moleculares (figuras III.6 y III.7.). La formación de
grandes moléculas concatenadas explica por qué las propiedades estructurales
y genéticas de los fagos T sugieren que su mapa genético es circular. En estos
fagos el precursor inmediato del ADN viral es una gran molécula;
esta molécula es fragmentada por la acción de enzimas nucleasas que dividen
la macromolécula en subunidades cuya longitud corresponde a la del ADN
original. Esta fragmentación ocurre antes o durante el proceso de encapsidación.
Durante la replicación del fago T4 se generan moléculas que poseen secuencias
redundantes en sus extremos terminales (ej.: ABC... YZABC). De hecho, en una
población de fagos T4 no todas las moléculas de ADN viral empiezan
con la misma secuencia, y a pesar de que estas moléculas son lineales, el análisis
genético muestra que su mapa genético es circular. Esto es consecuencia de la
fragmentación de múltiples cadenas concatenadas, las cuales son reducidas al
tamaño correcto para poder ser empacadas en las cabezas de los fagos. El mecanismo
de círculo rodante ha sido particularmente estudiado en el caso de algunos fagos,
como el fago l el fago ØXI74.
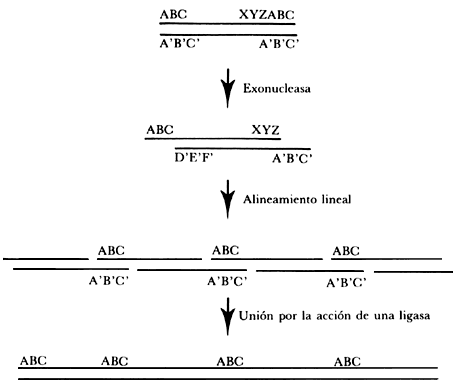
Figura III.6. Posible mecanismo para la producción de cadenas de ADN
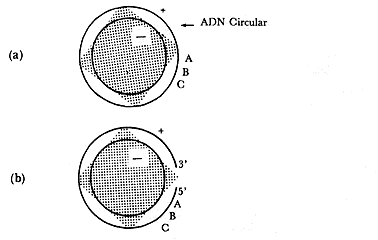
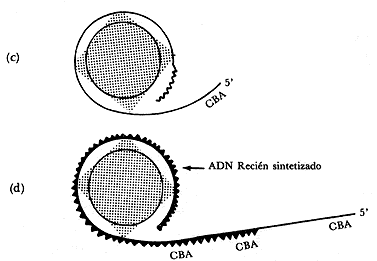
Figura III.7. El mecanismo del círculo rodante.(a) ADNADN polimerasa añade nucleótidos en el extremo 3 de la cadena
abierta, de manera que produce desplazamiento del extremo 5 . (d) El desplazamiento
del extremo 5 se hace más extenso en la medida que la enzima polimerasa recorre
el templado de ADN circular (cadena negativa). El resultado es
la formación de un ADN con longitud mayor a la normal.
En general, la replicación de los virus ADNADN celular y una característica
común es la presencia de estructuras circulares temporales cuando menos en algunas
de las etapas del proceso de replicación. La abundancia del ADN
circular en diferentes tipos de virus sugiere que el círculo representa el formato
más importante en la replicación del ADN viral, y la forma lineal
de la molécula es una adaptación (particularmente en el caso de los fagos T)
que permite efectuar la inyección del ácido nucleico viral a través de la cola
del virus. Solamente los fagos con cola tienen genomas lineales, los otros tipos
de fago poseen genomas circulares.
En los últimos quince años se han logrado importantes avances en el conocimiento
de los mecanismos de replicación del ADN en varios tipos de virus
animales. La gran variedad en el tamaño y organización de los genomas virales
implica una gran diversidad en los detalles asociados con la replicación del
ADN
Sin embargo, es importante hacer notar que todavía existen múltiples incógnitas
respecto a la replicación del ADN tanto en los virus como en las
células en general. La autonomía de los virus en cuanto a su capacidad para
replicar el ADNARNADN
Se conocen varios casos en los cuales un tipo de virus animal no puede replicarse en el interior de algún tipo de células en particular a pesar de haber sido capaz de iniciar la infección en las mismas. Por ejemplo, los adenovirus humanos pueden infectar cultivos de células renales de mono, pero no pueden crecer en estas células. Sin embargo, la coinfección de dichas células con virus SV40 permite la replicación del adenovirus por medio de la formación de una progenie de híbridos SV4Oadenovirus, los cuales contienen diferentes cantidades de sus respectivos genomas unidos en forma covalente. Esto implica que el virus SV4O actúa como auxiliar para la replicación del adenovirus, proporcionando factores que están ausentes en ese tipo de célula hospedera en particular, factores que son necesarios para la replicación del adenovirus.
Frecuentemente se observa que la coinfección de una misma célula con dos diferentes mutantes o variedades de un mismo tipo de virus, cada uno de los cuales es defectuoso en alguna función esencial para la replicación del genoma viral, resulta en la producción de progenie viral con capacidad infectiva normal debida a la formación de híbridos entre los dos tipos de mutante, los cuales se complementan cancelando así sus respectivas deficiencias genéticas y funcionales, de manera que estos híbridos pueden desencadenar una infección productiva. Este fenómeno de complementación ha sido usado ampliamente para mapear y caracterizar los genes que codifican proteínas virales ya sean éstas de tipo funcional o estructural.
e) SíNTESIS DEL ARN
GENÓMICO VIRAL
EN LOS VIRUS ARN
La síntesis del ARN por parte de los virus ARN involucra
la replicación, que puede ser definida como la producción de una progenie de
genomas virales (ARN en este caso), y la transcripción que consiste
en la producción de ARN cuya secuencia de nucleótidos es complementaria
a la del genoma. Debido a que los genomas de los virus ARN pueden
ser de sentido positivo (+) o sentido negativo (-) [véase la clasificación de
Baltimore], la transcripción en estos virus, a diferencia de lo que ocurre en
el caso de los virus ADN, no es siempre sinónimo de la síntesis
de ARN mensajero.
La mayoría de los virus ARN poseen moléculas de cadena sencilla
y por lo tanto la replicación consiste en que una secuencia de ribonucleótidos
deerminada debe ser copiada para producir exactamente la misma secuencia, por
ejemplo: ACGU ![]() ACGU. La
información actualmente disponible indica que el apareamiento entre las bases
A-U y C-G es la clave para la replicación del
ACGU. La
información actualmente disponible indica que el apareamiento entre las bases
A-U y C-G es la clave para la replicación del ARN viral; por lo
tanto, en estos virus se aplican también los principios fundamentales relacionados
con la replicación del ADN
A principios de los años sesenta fueron descubiertos los primeros fagos ARN
y casi al mismo tiempo se demostró que los picornavirus, que se caracterizan
por tener ARN de cadena sencilla, son capaces de replicarse en
células animales en las cuales la síntesis del ADN y su subsecuente
transcripción en moléculas de ARN mensajero celular había sido
inhibida por la droga actinomicina D, la cual se intercala en la molécula
de ADNADN, de manera que las enzimas como la ADNARN polimerasa no pueden cumplir con la función de llevar
a cabo la replicación o la transcripción de este ADN. En presencia
de actinomicina D se detiene la síntesis de ARN celular; por lo
tanto, se pueden infectar las células con virus ARN en presencia
de precursores radiactivos del ARN (como 3H-uridina)
y colectar muestras de estas células a intervalos apropiados después de la infección;
estas muestras pueden ser fraccionadas por medio de detergentes y solventes
orgánicos de manera que se pueden aislar y analizar las nuevas moléculas de
ARN, cuya síntesis ha sido inducida por la infección viral.
La mayoría de los virus ARN (con excepción de los retrovirus)
se pueden replicar en presencia de inhibidores de la síntesis de ADN;
este hecho descarta la participación de ADN intermediario en la
replicación de estos virus. En 1963, Montagnier y Sanders demostraron la presencia
de ARN de cadena doble en células infectadas por el virus de la
encefalomiocarditis (EMCV), el cual posee solamente ARN de cadena
sencilla. Así, pronto fue establecido que el ARN de cadena doble
es una forma intermediaria en la replicación de los virus ARN (con
excepción de los retrovirus). Este ARN de cadena doble se denomina
forma replicativa (FR) y se caracteriza por ser insensible a la acción de la
enzima ribonucleasa (ARNasa), la cual sólo digiere el ARN
de cadena sencilla. Posteriormente, ha sido posible aislar otro tipo de ARN
intermediario constituido por moléculas de cadena doble cuyos extremos están
desapareados originando "colas" de ARNARN constituye el intermediario de replicación (IR). Sin embargo,
el FR y el IR parecen tener papeles diferentes en la replicación de diferentes
tipos de virus ARN.
El fago Qb representa el modelo mejor estudiado
de la síntesis del ARNARN polimerasa dependiente de ARNARN del fago Q/b.
La síntesis de la cadena (-) de ARN complementaria al genoma viral
es detectada por la aparición de un nuevo ARN no infeccioso que
es resistente a ser digerido por la enzima ARNARN, que representa a la forma replicativa
(FR), coincide con la pérdida de infectividad de las moléculas de ARN
viral que sirvieron como templado. La síntesis de esta cadena (-) de ARN
es llevada a cabo por la replicasa del fago, la cual está constituida por varias
subunidades de proteína, algunas de las cuales son proteínas codificadas por
la célula hospedera (como los factores de elongación EF; Tu y Ts, normalmente
involucrados en el proceso de síntesis de proteínas) las cuales son incorporadas
para formar la llamada holoenzima de la Qb
replicasa. Posteriormente, la síntesis de la nueva cadena (+) de ARNARNARNARNARN
El ARNARN se encuentran
libres de muchas restricciones asociadas con el ciclo de vida del virus. Esta
situación es similar a un estado de evolución precelular, cuando los factores
ambientales de la selección natural actuaban directamente sobre el material
genético en lugar de hacerlo sobre el producto (proteína) codificado por el
gene. Sol Spiegelman y colaboradores diseñaron un experimento para determinar
qué es lo que ocurre con las moléculas de ARN cuando la única necesidad
consiste en que estas moléculas se repliquen tan rápidamente como les sea posible.
El producto de la reacción entre la Qb replicasa
y el ARN viral purificado puede actuar como templado para la síntesis
de más ARN. Por otra parte, cuanto más larga es una molécula de
ARN más tiempo tardará en replicarse. Considerando estos factores,
resulta lógico pensar que las nuevas moléculas de ARN podrán replicarse
más rápidamente si eliminan información genética que no tiene una importancia
esencial para el proceso de replicación, de esta manera las moléculas de ARN
pueden disminuir su tamaño y el tiempo necesario para la replicación de las
propias moléculas. Por ejemplo, si se añade la enzima Qb
replicasa a una mezcla de reacción constituida por moléculas enteras y medias
moléculas de ARN Qb purificado,
la replicación de las medias moléculas se realizará en la mitad del tiempo necesario
para replicar las moléculas enteras. Esto resulta en un exceso de medias moléculas
que continúan sirviendo como templado para la síntesis de nuevas medias moléculas,
generando así un exceso absoluto de moléculas más pequeñas. Spiegelman preparó
una mezcla de reacción consistente en ARN Qb
purificado, trifosfatos de los ribonucleótidos apropiados y la enzima Qb
replicasa. Después de una corta incubación, la mezcla de reacción fue diluida
121/2 veces en otro tubo de ensayo que contenía la misma concentración de la
enzima replicasa y los ribonucleótidos precursores, pero en ausencia de ARNQb
. Esta secuencia de incubaciones y diluciones fue repetida 75 veces y la duración
de las incubaciones fue siendo reducida paulatinamente aunque el factor de dilución
fue mantenido constante. Después de la transferencia número 75 fue posible aislar
una población de moléculas derivadas del ARN Qb
original, las cuales solamente contenían 17% de la secuencia de nucleótidos
presente en el ARNARN disminuye progresivamente cuando
es sometida a este proceso de selección en función de la velocidad de replicación.
El único factor que tiene un efecto limitante en el acortamiento de las moléculas
de ARNARNQb
.
La replicación del fago Qb es sólo un ejemplo de
las múltiples estrategias de replicación exhibidas por los virus ARN.
Una vez más, el lector interesado deberá consultar la bibliografía para conocer
detalles sobre la replicación de otros virus ARN.
Una pregunta importante es por qué el ácido nucleico purificado a partir de
ciertos tipos de virus tiene capacidad infectiva, mientras que el ácido nucleico
purificado a partir de otros virus carece de esta capacidad. La respuesta consiste
en que los virus pertenecientes a las clases II, V y VI (de acuerdo con la clasificación
de Baltimore), requieren que su información genética sea transcrita en otro
tipo de ácido nucleico diferente al presente en el virus original. En la mayoría
de los casos, esta transcripción es mediada por enzimas específicas del virus,
las cuales están almacenadas en la partícula viral. Ejemplo de estas enzimas
son la ARN polimerasa dependiente de ADN, característica
del virus de la vacuna; la ARN polimerasa dependiente de ARNADN
polimerasa dependiente de ARN característica de los retrovirus.
El ácido nucleico purificado a partir de estos virus carecerá de estas enzimas
necesarias para la transcripción y subsecuente replicación de dicho ácido nucleico,
y las células infectadas no cuentan con enzimas capaces de utilizar estos tipos
de ácido nucleico viral como templado.
f) LA REGULACIÓN DE LA EXPRESIÓN DE LOS GENES VIRALES
Cuando una célula es infectada por un virus, no todos los genes virales son expresados a un mismo tiempo y, por lo tanto, no todas las proteínas virales son sintetizadas al mismo tiempo. La mayoría de estas proteínas virales no son sintetizadas en forma continua. Algunas proteínas virales son sintetizadas durante unos cuantos minutos al principio de la infección, otras son sintetizadas en las etapas tardías de la infección y otras más son sintetizadas durante periodos que equivalen a la mitad del ciclo infeccioso.
Cuando se expresa un gene, la información genética presente en la secuencia
de nucleótidos del ácido nucleico original es transcrita en una secuencia complementaria
constituida por ARN mensajero, la información contenida en este
ARN mensajero es traducida en el interior de las estructuras conocidas
como ribosomas; en esta traducción interviene otro tipo de ARN
conocido como ARN de transferencia (ARNt), del cual
existen cuando menos veinte tipos diferentes, cada tipo de ARNt
sirve para transportar específicamente uno de los veinte tipos diferentes de
aminoácidos que forman parte de las proteínas. La traducción consiste en interpretar
los codones constituidos por tripletas de nucleótidos presentes en la secuencia
del ARN mensajero (ARNm). Existen 61 codones diferentes
que codifican a los 20 aminoácidos diferentes, o sea, que un mismo tipo de aminoácido
puede ser designado por más de un codón. Además, existen otros tres codones
cuya función es actuar como signos determinación en la síntesis de proteínas.
Cada codón (con excepción de aquellos que actúan como signos de terminación)
es reconocido por su respectivo anticodón, constituido por una tripleta de nucleótidos
con secuencia complementaria a la del codón; este anticodón se encuentra en
un extremo de la molécula del ARNt correspondiente. Así, el producto
de la traducción está constituido por una cadena de aminoácidos, o sea, una
proteína cuya secuencia de aminoácidos es correspondiente a la secuencia de
codones presente en el ARNm, secuencia interpretada por los anticodones presentes
en los ARNt que actúan como transportadores de los aminoácidos.
i) Regulación en los bacteriófagos ADN
El control de la expresión genética puede ocurrir en el nivel de la transcripción,
en el nivel de la traduccion o en ambos niveles. En el caso de las bacterias
infectadas por fagos ADNADN en ARNm es realizada por la enzima ARN
polimerasa, la cual en bacterias como la E. coli está formada por cien
diferentes cadenas polipeptídicas (proteínas): a, b, bws;
estas proteínas están unidas entre sí por puentes de hidrógeno en la siguiente
proporción: a, b, bws La proteína o factor s
puede ser fácilmente separada del resto de la ARN polimerasa que
retiene la actividad catalítica encargada de la síntesis del ARNm.
El factor s tiene como función el reconocimiento de las señales para la iniciación
de la transcripción; estas señales están presentes en las llamadas secuencias
promotoras incluidas en el ADN.
Durante la infección de una bacteria por fago T7 se forma una serie de moléculas
discretas de ARNARNARNm temprano, el cual consta de 4 especies;
y ARNm tardío, que consta de 8 o 9 especies diferentes. En el fago
T7 solamente una de las cadenas del ADN viral sirve como templado
para la síntesis de ARNm esto indica que los genes de este fago
están codificados en la misma cadena de ADNARNARN polimerasa de la bacteria hospedera.
La ARNARNARN
polimerasa bacteriana se encarga de transcribir los llamados genes tempranos
del genoma viral. Este primer tipo de ARNm producido es de tipo
policistrónico, o sea, incluye en una sola molécula de ARNm el
mensaje contenido en varios genes. Sin embargo, una enzima ribonucleasa propia
de la célula bacteriana (ARNasa III) corta e saje correspondiente
a un solo gene en particular. Como ya fue mencionado, la transcripción del gene
1, y su posterior traducción, resulta en la síntesis de una ARN
polimerasa viral que se encarga de transcribir los llamados genes virales tardíos.
La transcripción de cada clase o tipo de ARN
El fago T7 inhibe las funciones sintéticas propias de la célula bacteriana.
Una proteína codificada por uno de los genes tardíos del fago T7 es capaz de
pegarse a la ARN ARNm
bacteriano y eliminando de paso la síntesis de nuevas moléculas de ARNm
viral de tipo temprano. El genoma del fago T7 tiene un peso molecular de
25 x 106 daltones y una capacidad de codificación
equivalente a 30 genes de tamaño promedio. Hasta la fecha han sido identificados
25 genes de este tipo de virus; estos genes han sido ordenados en un mapa genético
lineal en el cual los genes que se expresan en forma temprana están concentrados
en el extremo del genoma (ADN) viral. Por lo tanto, considerando
que la síntesis de ARNm ocurre en la dirección 5' ® 3', resulta
que los transcritos correspondientes a los genes tempranos están concentrados
en el extremo 3' del ARNm viral.
En el caso de la infección por fago T4, es posible identificar tres clases
de ARNARNm
tempranos inmediatos, ARNm tempranos tardíos y ARNARNm tempranos inmediatos son sintetizados durante
el primer minuto de infección. Los ARNm tempranos tardíos son sintetizados
a partir de 2 o 3 minutos después de iniciada la infección. Los ARNARNm dd
fago T4 es sensible al antibiótico rifampicina. Es sabido que este antibiótico
afecta a la subunidad b, de la ARN polimerasa,
bacteriana; por lo tanto, esta subunidad debe participar en la síntesis del
ARNm del fago T4. Experimentos en los cuales la ARN
polimerasa bacteriana ha sido marcada radiactivamente antes de la infección
por fago T4, indican que las subunidades a y
b, de la ARN polimerasa son conservadas durante el ciclo
de infección; sin embargo estas subunidades son modificadas. Dos minutos después
de iniciada la infección ocurre una modificación de las subunidades de la ARN
polimerasa bacteriana por medio de un proceso conocido como adenilación; esto
modifica la especificidad de la enzima que suspende la síntesis de ARNm
viral de tipo temprano inmediato y empieza a sintetizar ARNm viral
de tipo temprano tardío. Existe evidencia de que a los 10 minutos de infección
la estructura de la subunidad b,' es modificada;
esto resulta en un nuevo cambio en la especificidad de la ARN polimerasa,
la cual empieza a sintetizar ARNm virales tardíos. Existen otros
factores que también participan en la regulación de la transcripción del fago
T4; entre éstos podemos mencionar: la síntesis de un factor de naturaleza proteica
capaz de hacer antagónica la normal terminación de las cadenas de ARNm
(factor de antiterminación), este factor permite que la ARN polimerasa
bacteriana continúe transcribiendo el ADN viral hasta llegar a
los genes distales. También ocurre la síntesis de factores similares al factor
s, capaces de reconocer señales de iniciación de la transcripción que no son
reconocidas normalmente por el factor o propio de la bacteria hospedera.
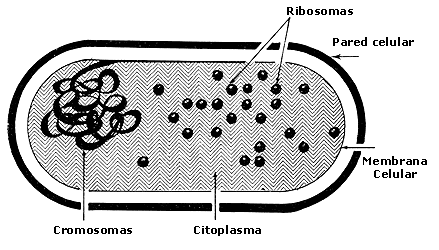
Figura III.8. Esquema de una célula bacteriana (procariote).
ii) Regulación en los virus animales
La regulación de la expresión genética de los virus animales puede ocurrir
en el nivel de la transcripción, traducción o de ambos procesos, y en un grado
que varía entre los diferentes tipos de virus y también durante el ciclo de
multiplicación de cada virus en particular. La investigación de los virus animales
ha permitido elucidar mecanismos de regulación genética, totalmente diferentes
a los presentes en los sistemas bacterianos. En muchos casos todavía se ignora
la mayoría de los eventos involucrados en la regulación de los genes virales.
Sin embargo, el estudio de los virus animales ha servido como poderosa herramienta
para conocer detalles de la biología molecular de las células eucarióticas,
o sea, células que se caracterizan por tener núcleo y otros organelos intracelulares
a diferencia de las células procarióticas (como las bacterias) que carecen de
organelos intracelulares (figuras III.8 y III.9).
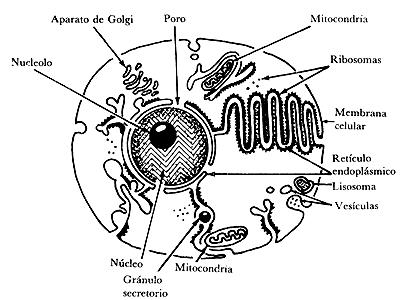
Figura III.9. Esquema de una célula animal (eucariote).
El genoma completo del virus de la polio, un tipo de virus ARNARN perteneciente a la clase IV de la clasificación de Baltimore;
estos virus se caracterizan por producir un ARNm cuya secuencia
es idéntica a la del ARN que constituye el genoma viral; para esto
se requiere la síntesis previa de una cadena de ARN con secuencia
complementaria a la del ARN del genoma viral. Esta cadena complementaria
sirve como templado para la síntesis del ARNm viral. El virus de
la polio es capaz de inhibir la síntesis de macromoléculas propias de la célula
hospedera, de esta manera todos los recursos y precursores moleculares presentes
en la célula son dedicados a la producción de componentes virales y, por lo
tanto, no resulta sorprendente que la célula muera a consecuencia de la infección
viral. En las células infectadas por el poliovirus una de las proteínas virales
introducida a la célula junto con el virión es la causa de que se inicie la
inhibición de las funciones celulares. Particularmente es afectada la síntesis
del ARN
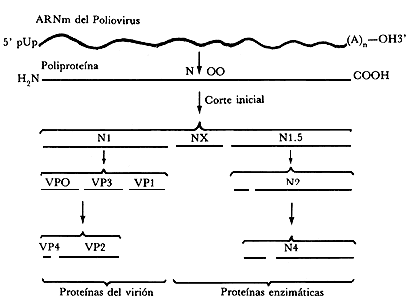
Figura III.10. Esquema de la síntesis de las proteínas del virus de la poliomielitis.
Los picornavirus hacen sus proteínas funcionales por medio de la traducción
del ARN mensajero viral en una cadena continua de aminoácidos (la
poliproteína NOO=. durante la síntesis de esta poliproteína se producen cortes
primarios que dan origen a las proteínas precursoras N1, NX y N1.5. Ni es fragmentada
para formar las proteínas estructurales del virión, mientras que NX y los productos
del N1.5 probablemente están involucrados en funciones intracelulares como l
a síntesis de ARN viral.
En el caso de los virus ARNARNARNARNm(+), que es traducido en proteínas, y el ARN(+),
que sirve como templado para la síntesis de nuevos genomas virales constituidos
por ARN(-). Recordemos que por convención el ARNm
es (+) y todo ácido nucleico de secuencia complementaria a la de dicho ARNARN(+): el ARN(+)
que servirá como templado para la síntesis del ARN(-) viral es
un fiel complemento de la secuencia de nucleótidos presente en el genoma ARN(-)
viral, mientras que el ARNm(+) viral carece de una porción de la
secuencia de nucleótidos complementaria al extremo 5´ del ARN(-)
correspondiente al genoma viral. Así, el ARNm no puede servir como
templado para la síntesis de segmentos completos del genoma viral.
Los ortomixovirus son únicos entre los virus ARN debido a que
parte de su ciclo de multiplicación se lleva a cabo dentro del núcleo celular.
Inmediatamente después de la infección, la partícula viral desnuda es transportada
al interior del núcleo celular y en etapas más avanzadas de la infección, algunas
proteínas virales recién sintetizadas migran del citoplasma (su lugar de síntesis)
hacia el núcleo. El paso de moléculas a través de la membrana nuclear es un
proceso altamente selectivo y constituye un nivel de control presente únicamente
en las células eucarióticas.
Todos los virus ADN, con excepción de los poxvirus, sintetizan
su ARNm a partir de una molécula de ADN de cadena doble, la cual
se ubica en el núcleo de la célula infectada y, por lo tanto, representa el
modelo más cercano para el estudio de la síntesis de ARNm en las
células eucarióticas. Las histonas constituyen el principal tipo de proteínas
que normalmente se encuentran asociadas con el ADN celular; estas
histonas se encuentran también asociadas con el genoma de algunos virus ADN
como los papovavirus, lo que subraya la similitud estructural entre la cromatina
celular y la cromatina viral. El tamaño de los genomas de los virus ADN
animales varía dos órdenes de magnitud, desde los parvovirus, cuyo ADN
tiene un peso molecular promedio de 1.5 x 106
daltones, hasta el virus de la vacuna cuyo ADN tiene un peso molecular
de 160 x l06daltones. Los virus más
grandes son menos dependientes de las funciones de la célula hospedera para
multiplicarse y por lo tanto pueden hacerlo aun cuando las células hospederas
se encuentran fuera de la fase S del ciclo celular, misma que constituye el
periodo normal de duplicación del ADN celular. Los virus pequeños
solamente pueden replicarse durante la fase S del ciclo celular; y los virus
de tamaño intermedio tienen la capacidad de inducir a la célula para que entre
en la fase S. Casi todos los virus ADN tienen la capacidad de transformar
células en cultivo, volviéndolas de tipo tumoral (canceroso). Este fenómeno
será discutido con detalle más adelante. Sin embargo, es posible especular que
la transformación celular puede resultar a consecuencia de una aberración en
el mecanismo normal por medio del cual el virus interacciona con los factores
celulares que regulan la división celular. También es importante mencionar que
gran parte de la información genética contenida en el genoma de los virus ADN
más grandes parece duplicar información ya presente y expresada en las células
que se encuentran en la fase S del ciclo celular.
v) Regulación en los papovavirus
Los papovavirus constituyen un grupo de virus ADN animales. El virus del polioma y el virus de simios SV40 son los papovavirus más estudiados. Estos virus tienen un genoma circular constituido por ADN de cadena doble que codifica proteínas virales tempranas y tardías, las cuales son sintetizadas a partir de la traducción de ARNm virales tempranos y tardíos. El ADN de los papovavirus es transcrito por la ARN polimerasa celular tipo II, la cual normalmente es la encargada de sintetizar el ARNm celular. El ARNm viral de tipo temprano es sintetizado a partir de una cadena de ADN diferente a la que da origen al ARNm tardío. En el virus SV40, la proteína temprana más importante es el antígeno tumoral mayor o T-antígeno; esta proteína viral migra hacia el núcleo celular y supuestamente modifica el ADN celular, de manera que se vuelve susceptible a ser replicado. El virus SV40 también sintetiza otro antígeno tumoral menor o t-antigeno. Por su parte, el virus del polioma sintetiza tres diferentes antígenos tumorales. El papel de estos antígenos en la transformación celular será discutido más adelante.
Otras proteínas tempranas codificadas por el virus SV40, pero cuya función se desconoce, son el U-antígeno, que también se ubica en el núcleo celular, y el antígeno de transplante-tumor específico (TSTA), que se ubica en la membrana celular. La fase inicial de la infección viral es seguida por la inducción de la síntesis de enzimas celulares y ADN celular, en forma independiente de las necesidades celulares. A continuación se inicia la síntesis de ADN viral seguida por la síntesis de ARNm viral tardío. Las proteínas tardías son ensambladas con el ADN viral para formar los nuevos viriones. A pesar de que los ARNm tempranos y tardíos son sintetizados a partir de diferentes cadenas del ADN viral, ambos tipos de ARNm están presentes en el núcleo de la célula infectada, incluso en las etapas avanzadas de la infección. Por lo tanto, la síntesis predominante de proteínas virales tardías se logra por medio del transporte selectivo hacia el citoplasma de aquellos transcritos de ARNm viral que corresponden a las proteínas de tipo tardío.
vi) Regulación en los adenovirus
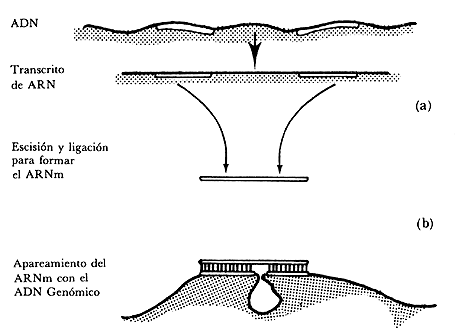
Figura III. 11. (a) Producción del ARN mensajero de un adenovirus. (b) El
asa de ADN formada por el apareamiento con el ADN genómico puede ser observada
mediante el microscopio electrónico y proporciona evidencia de que el ARNm es
formado a partir de regiones no contiguas del ADN genómico. En la ilustración
solamente está representada una cadena del ADN.
Los adenovirus poseen una cantidad de ADN seis veces mayor que la de los papovavirus. Sin embargo, son muy similares sus estrategias de control genético: síntesis temprana de proteínas virales, replicación del ADN viral, síntesis de proteínas virales tardías. En el caso de los adenovirus, tanto la ARN polimerasa celular tipo II como la tipo III participan en la transcripción de ARNm viral temprano y tardío. El estudio de la replicación de los adenovirus ha contribuido a establecer que el ARNm de ciertos virus es codificado, al igual que el ARNm de las células eucarióticas, por regiones no contiguas del ADN. Esto implica que el transcrito inicial del ARN viral es fragmentado en forma específica y los fragmentos adecuados son unidos por una enzima ARN ligasa (figura III.11). En el núcleo de la célula infectada por el adenovirus ocurren mecanismos de control genético altamente complejos. Además de la fragmentación y ligado del ARNm, existen otros procesos como la poliadenilación, que consiste en la adición de un polímero constituido por 150 a 200 nucleótidos de adenina, al extremo 3' del ARNm. Este fenómeno incrementa la estabilidad del ARNm. Otro proceso es el capping del ARNm viral, el cual consiste en la adición de un nucleótido especial: 7-metil guanosina, al extremo 5' del ARNm. Este nucleótido puede ser hipermetilado posteriormente. El cap protege el extremo 5' del ARNm evitando que sea degradado por enzimas nucleasas o fosfatasas o por ambas, lo cual incrementa la estabilidad del mensaje. También se observa un transporte diferencial del ARNm viral en el nivel de la membrana nuclear; la permeabilidad de esta membrana al ARNm recién sintetizado cambia continuamente durante el proceso de infección, de manera que el espectro de proteínas virales al ser sintetizadas también cambia en forma continua.
vii) Regulación en los herpesvirus
Los herpesvirus contienen aproximadamente cuatro veces más ADN que los adenovirus.
En los herpesvirus la síntesis de ARNm tardíos es independiente de la síntesis
de ADN viral y celular. Así, cuando se inhibe la síntesis de ADN, todavía es
posible observar la acumulación de ARNm temprano y tardío en el núcleo celular.
Sin embargo, la síntesis de las proteínas virales sigue un riguroso sistema
de inducción y represión que ocurre en tres fases. Las proteínas de tipo a
son las primeras en ser sintetizadas después del inicio de la infección; estas
proteínas a inducen a su vez la síntesis de
las proteínas virales b las cuales reprimen
la síntesis de las proteínas a e inducen la
síntesis de las proteínas virales g, las cuales
a su vez reprimen la síntesis de las proteínas b.
La evidencia disponible indica que los mecanismos de control en la síntesis
de estas proteínas virales ocurre en el nivel de la traducción y el procesamiento
de los ARNm virales dentro del núcleo de la célula infectada.
En el caso del virus Herpes simplex tipo 1, existe evidencia reciente de que la infección viral produce un número limitado de rupturas en las cadenas del ADN celular; estas rupturas inducen un cambio en la estructura tridimensional de este ADN celular y en las relaciones o asociaciones que mantiene este ADN celular con el núcleo-esqueleto o estructura subnuclear. El desprendimiento del ADN celular de los sitios de anclaje a la subestructura nuclear se manifiesta entre otras cosas por la inhibición de la síntesis del ARN y ADN celulares. Al parecer, la posición que guardan las asas de ADN celular en relación con la subestructura nuclear tiene un papel muy importante en la potencialidad de este ADN para ser replicado y transcrito. La alteración en la posición del ADN celular inducida por la infección viral puede ser un mecanismo económico y eficiente para lograr la inhibición de la síntesis de macromoléculas celulares.
viii) Regulación en los poxvirus
Los poxvirus que incluyen al virus de la viruela y de la vacuna son los únicos virus ADN animales que se multiplican en el citoplasma de la célula infectada. También son los virus más grandes y tienen capacidad para codificar 50 veces más genes que los papovavirus. El sitio de la multiplicación viral en el citoplasma se manifiesta por la virtual formación de un "se gundo núcleo". Los viriones de los poxvirus contienen una multitud de enzimas cuyas actividades son un duplicado de aquellas normalmente presentes en el núcleo celular. Estos viriones poseen su propia ARN polimerasa dependiente de ADN al igual que enzimas capaces de adenilar, metilar y añadir cap a los ARNm virales. La presencia de control en el nivel de la traducción es evidente en la síntesis de la enzima viral timidina cinasa, la cual es una proteína temprana cuya síntesis se detiene una vez que aumenta la síntesis de proteínas virales tardías, algunas de las cuales parecen ser la causa de la inhibición de la síntesis de proteínas tempranas como la timidina cinasa.
En las células infectadas por virus tanto las proteínas como los ácidos nucleicos virales son sintetizados por separado y posteriormente ensamblados para formar nuevas partículas virales. Los virus pueden autoensamblarse en un proceso similar a la cristalización, ya que las partículas virales, al igual que los cristales, constituyen estructuras que se encuentran en un estado mínimo de energía libre. Sin embargo, el genoma viral también puede especificar ciertos factores "morfogenéticos" que no contribuyen directamente a formar la estructura del virión, pero son necesarios para el proceso de ensamblaje.
El fenómeno de autoensamblaje ocurre en la formación de diversas estructuras biológicas como los flagelos celulares. Sin embargo, el ejemplo mejor estudiado es la reconstitución in vitro del virus del mosaico del tabaco. Este virus consta de un largo filamento helicoidal de ARN que está incluido en una estructura constituida por pequeñas subunidades idénticas de proteína "A"; estas subunidades están dispuestas en forma helicoidal. Las proteínas del VMT forman diferentes tipos de agregados moleculares cuando se encuentran en solución, dependiendo de las condiciones ambientales, particularmente la fuerza iónica y el pH. Las estructuras discoidales son el tipo más común de agregado proteico que ocurre bajo condiciones fisiológicas. Sin embargo, la interacción de los discos de proteína con el ARN viral resulta en la estabilización de la forma helicoidal. Cuando se mezclan subunidades de proteína "A" y ARN viral, la polimerización es lenta y la formación de viriones maduros requiere de casi seis horas. Cuando se mezclan los discos de proteína "A" con ARN viral bajo las mismas condiciones del experimento anterior, la polimerización es rápida y en cinco minutos se ensamblan viriones maduros.
El modelo más aceptado para explicar el ensamble del VMT es el asa en movimiento.
Este modelo propone que una molécula de ARN en forma de horquilla
se inserta, a través del orificio central de un disco formado por subunidades
de proteína "A", en el espacio o mandíbula presente entre los dos discos de
proteína "A". A consecuencia de esta interacción, los discos son desfasados
dando origen a una estructura helicoidal, la cual se perpetúa por medio de la
adición de nuevos discos de proteína en la parte superior de la hélice en crecimiento.
El asa producida por la tracción del ARN hacia arriba del orificio
central de la partícula en crecimiento constituirá el asa en movimiento que
se inserta en el orificio del siguiente disco adicional, desfasándolo a su vez
y convirtiéndolo en una estructura helicoidal (figura III.12). Este modelo predice
que en partículas de VMT ensambladas parcialmente las puntas 5' y 3' del ARN
viral deben protuir a través de alguno de los extremos de la partícula viral
en formación. Este hecho ha sido confirmado por microscopia electrónica.
El ensamble dirigido de los nuevos viriones es característico de virus complejos como los fagos del grupo T. El caso más estudiado es el del fago T4. El primer avance en la elucidación del ensamblaje del fago T4 se obtuvo a partir del estudio de mutantes letales condicionales. Cuando se infecta una cepa no permisiva de E. coli con fagos que tienen mutaciones en cualquiera de sus genes estructurales, no se producen nuevas partículas virales. Sin embargo, cuando se examinan bajo el microscopio electrónico los lisados obtenidos a partir de estas bacterias infectadas con fagos mutantes, se encuentra la presencia de estructuras correspondientes a los componentes del fago. Así, bacterias infectadas con fagos mutantes en el nivel de los genes 34, 35, 36, 37 y 38, acumulan partículas virales que parecen normales, salvo porque carecen de las fibras de la cola. Por lo tanto, se concluye que estos genes codifican proteas involucradas en el ensamble de las fibras de la cola; la adición de estas fibras es un evento tardío en el ensamble de las nuevas partículas virales. Las fibras se acuman en bacterias infectadas con fagos mutantes en los genes 34, 35, 36 y 38, pero no en los mutantes en el gene 37, por lo que se deduce que este gene 37 codifica la principal proteína estructural de las fibras de la cola del fago. La aplicación de esta metodología a bacterias infectadas con otras cepas diferentes de fagos mutantes permitió identificar la función de muchos otros genes del fago T4y establecer que la cabeza, la cola y las fibras del fago son sintetizadas en forma independiente.
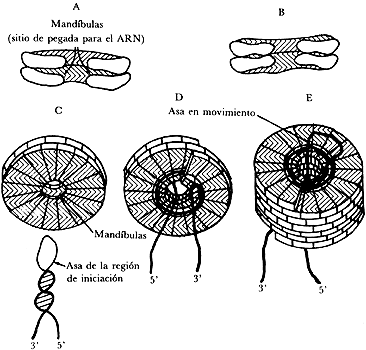
Figura III. 12. Modelo de asa en movimiento para el ensamble del virus del
mosaico del tabaco (VMT). La nucleación se inicia con la inserción de una horquilla
de ARN viral en el orificio central del primer disco de proteínas tipo "A".
El asa se intercala entre dos capas de subunidades y se pega alrededor de la
primera vuelta del disco. Como resultado del modo de iniciación, el extremo
más largo del ARN viral forma un asa en movimiento a la cual se le añaden rápidamente
discos adicionales formados por subunidades de proteína "A".
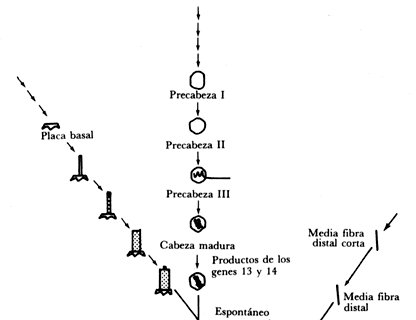
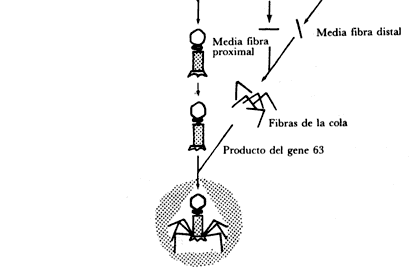
Figura III.13. Ensamble del bacteriófago T.4
Estudios complementarios realizados in vitro han permitido conocer más detalles del proceso de ensamblaje del fago T4. Por ejemplo, fagos carentes de fibras aislados a partir de bacterias infectadas con mutantes en los genes 34-38 fueron mezclados con un extracto obtenido de bacterias infectadas con una cepa de fagos mutantes en el gene 23, la cual no puede sintetizar cabezas virales. El resultado de este experimento fue la formación in vitro de viriones completos e infectivos, ya que el extracto del mutante en el gene 23 actuó como donador de fibras de la cola, mientras que el otro extracto proporcionó las cabezas del fago. Este tipo de experimento es análogo a los estudios de complementación genética, pero con la diferencia de que estos últimos se realizan in vivo, o sea, dentro de las células infectadas.
La figura III.13 muestra la secuencia de ensamble del fago T4. Los productos de los genes 13 y 14 no están involucrados directamente en el proceso de unión; sin embargo, deben ser funcionales para que pueda ocurrir la unión entre cabezas y colas. Las cabezas se unen a las colas en forma espontánea; por lo tanto, los genes 13 y 14 deben estar involucrados en alguna modificación de las cabezas maduras, la cual es un prerrequisito para la adición de la cola. En contraste, las fibras de la cola no se unen espontáneamente a la placa basal, sino que requieren la participación activa del producto del gene 63 para poder llevar a cabo esta unión.
El correcto ensamblaje de muchos virus esféricos y también de algunos fagos con cabeza y cola requiere la participación de proteínas que no están presentes en el virus maduro. A estas proteínas se les conoce como proteínas formadoras del andamio. Por ejemplo, durante el ensamble del fago P22 aproximadamente 250 moléculas de las proteínas del andamio catalizan el ensamble de 420 moléculas de la proteína de la cubierta viral, de manera que estas proteínas forman una procabeza de cubierta doble, la cual contiene ambos tipos de proteína. Cuando ocurre la encapsidación del ADN viral, todas las proteínas formadoras del andamio son expulsadas de la procabeza, de manera que estas proteínas quedan libres para participar en ciclos subsecuentes de ensamble de las procabezas. En el caso del fago T4, la proteína formadora del andamio es el producto del gene 22; esta proteína es removida de la procabeza por medio de una enzima proteolítica (capaz de degradar proteínas) en el momento que ocurre la encapsidación del ADN viral.
Durante el ensamblaje de los adenovirus las proteínas formadoras del andamio son eliminadas en el momento que ocurre la encapsidación del ADN viral, pero no se sabe si estas proteínas son destruidas o reutilizadas en el ensamble de otras partículas virales. Existe evidencia de que en el proceso de ensamble de los herpesvirus y los poxvirus se reciclan las proteínas formadoras del andamio.
La proteína codificada por el gene B del fago ØXI74 no está presente en el virión maduro, pero participa en forma catalítica en el ensamble del fago. En células infectadas por ØXI74, la proteína del gene F se agrega para formar pentámeros al igual que la proteína del gene G; estos pentámeros reaccionan en presencia del producto del gene B para formar un agregado proteico más complejo, el cual probablemente constituye los vértices de la cápside viral icosaédrica.
h) FRAGMENTACIÓN DE PROTEÍNAS VIRALES
En la mayoría de los casos estudiados, la formación de viriones maduros requiere la fragmentación de grandes proteínas precursoras una vez que éstas se han ensamblado para formar procabezas o proviriones. Por ejemplo, en la maduración de la cabeza del fago T4, la proteína producto del gene 23 (p23) es fragmentada para generar la proteína p23*, que es 17% más corta que p23. En ausencia del ácido nucleico, las proteínas íntegras forman agregados más estables que las proteínas fragmentadas. Esto es consistente con la observación de que la fragmentación de las proteínas estructurales ocurre justamente antes de la encapsidación del ácido nucleico viral.
En las células infectadas por picornavirus y togavirus ocurren dos tipos de fragmentación postraducción de las proteínas virales. Por ejemplo, el genoma completo del poliovirus es traducido en un solo polipéptido gigante, el cual es fragmentado en tres polipéptidos más pequeños. Uno de estos polipéptidos es la proteína NCVPl o proteína que pertenece a la cápside viral. Esta proteína es precursora de las cuatro proteínas presentes en el virión maduro. NCVPl se deriva de la región 5' del genoma viral y es sintetizada en forma completa antes de ser fragmentada; esto sugiere que es necesario que la proteína NCVPl se pliegue en el espacio para adquirir una conformación tridimensional antes de que ocurra la fragmentación de dicha proteína. La fragmentación de NCVPl da origen a las proteínas VPO, VPl y VP3, las cuales se encuentran asociadas entre sí en el interior de las células infectadas al igual que en las cápsides virales. Después de que el ARN viral es encapsulado, VPO es fragmentada para producir las proteínas del virión denominadas VP2 y VP4. La fragmentación inicial del producto primario de la traducción del genoma viral representa un caso de fragmentación formativa. Este proceso probablemente constituye un mecanismo utilizado por las células animales como substituto para la iniciación interna de la síntesis de proteínas en mensajes policistrónicos (mensajes que contienen la información correspondiente a varios genes). La fragmentación del NCVPl en VPO, VP1 y VP3, y la subsecuente fragmentación de VPO en VP2 y VP4, representan ejemplos de fragmentación morfogenética (figura III.10).
i) ENSAMBLE DE LOS VIRUS CON ENVOLTURA
Un gran número de virus, particularmente de virus animales, poseen una envoltura
lipídica como parte de su estructura. Por ejemplo, los herpesvirus se replican
en el núcleo celular y aunque las proteínas virales son sintetizadas en el citoplasma
celular, estas proteínas son reintroducidas al núcleo celular. Después del ensamble
de la nucleocápside, el virus brota a través de la membrana nuclear y de esta
manera adquiere la envoltura. Antes de que ocurra este proceso, la membrana
nuclear es modificada por medio de la incorporación de proteínas virales específicas,
las cuales son glicosiladas, o sea, se les añaden moléculas de carbohidratos.
Sin embargo, la gran mayoría de los virus con envoltura la adquieren a partir
de la membrana celular. Se han identificado cuatro eventos principales en la
maduración de estos virus. Primero, se forma la nucleocápside en el citoplasma
celular. Segundo, ciertas áreas de la membrana celular incorporan glicoproteínas
virales. Tercero, la nucleocápside se alinea a lo largo de la superficie interna
de la membrana modificada y finalmente brota de la célula. Durante este proceso,
ninguna proteína de la membrana celular es incorporada en las partículas virales,
aunque la mayor parte de los lípidos presentes en la envoltura viral son derivados
de los lípidos normalmente presentes en la membrana de la célula hospedera.