VII. EL OLFATO
EL OLFATO es el sentido que nos permite oler. Este fenómeno ocurre cuando ciertas sustancias se introducen en la nariz y tenemos la sensación de oler.
VIII. TRANSICIONES DE FASE Y DIFUSIÓN
Antes de que podamos oler cualquier cosa, las sustancias que se desprenden de ésta deben llegar a nuestra nariz. En general, las moléculas olorosas experimentan dos procesos antes de llegar a nuestra nariz. El primero de ellos ocurre cuando las moléculas se desprenden de la sustancia en que se encuentran y el segundo al transportarse estas moléculas hasta nuestra nariz. Para entender cómo ocurren estos procesos reseñaremos brevemente los fenómenos físicos siguientes: a) la evaporación y la sublimación y b) la difusión.
En la naturaleza las sustancias pueden existir en uno de estos tres estados o fases: líquido, sólido o gaseoso.
De nuestra experiencia cotidiana sabemos que después de cierto tiempo de estar calentando agua empieza a aparecer vapor. Se dice que el agua se evapora. Este proceso es un ejemplo de una transición de fase: el agua pasó de la fase líquida a la fase gaseosa.
También sabemos que en la evaporación del agua ocurren otras cosas. Este líquido se evapora cuando llega a una temperatura de 100°C si uno está al nivel del mar. Si se calienta agua en un lugar que esté sobre el nivel del mar, por ejemplo a 1 000 m de altura, entonces la temperatura a la que se evapora el agua ya no es de 100°C sino que es de 96°C; es decir, al aumentar la altura sobre el nivel del mar la temperatura de evaporación disminuye.
Por otro lado, a determinada altura sobre el nivel del mar, el aire de la atmósfera ejerce presión sobre todos los objetos (Figura 52). Esta presión recibe el nombre de presión atmosférica. Al subir sobre el nivel del mar, la cantidad de atmósfera que hay encima de uno va disminuyendo, por lo que la presión que ejerce el aire también irá disminuyendo.
Combinando los hechos mencionados en los dos últimos párrafos, podemos concluir que al disminuir la presión atmosférica sobre el agua su temperatura de evaporación también disminuye.
En general, un líquido que no sea agua también se puede evaporar. La temperatura a la que ocurre este proceso depende de la presión atmosférica a la que se encuentre el líquido. Mientras menor sea la presión atmosférica menor será la temperatura de evaporación.
Tratemos de entender esta última afirmación a partir de un punto de vista microscópico. En primer lugar, dos átomos o moléculas experimentan una fuerza entre ellos. Las características de la fuerza dependen de la distancia que haya entre dichas partículas. Así, si las partículas están separadas hay una fuerza de atracción entre ellas (Figura 53). A medida que aumenta la distancia, disminuye la magnitud de esta fuerza. Si la distancia disminuye sigue habiendo atracción, llegando un momento en que al intentar "meterse" una de las partículas dentro de la otra, la fuerza empieza a ser repulsiva (Figura 54). Una partícula no permite que otra la penetre. Esta es la base del llamado principio de impenetrabilidad de la materia.
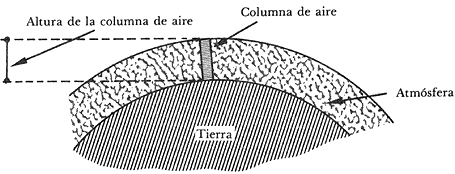
Figura 52. El aire que está encima de nosotros pesa y causa la presión atmosférica. Mientras mayor sea la altura sobre el nivel del mar, menor será la altura de la columna de aire que nos esté presionando.
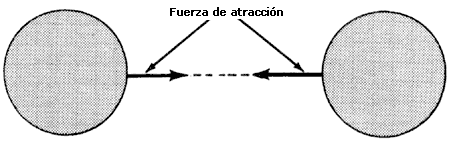
Figura 53. Dos átomos o moléculas que están separadas se atraen.
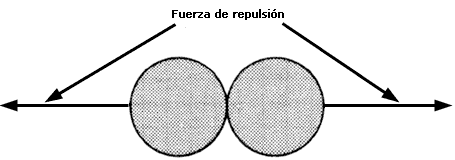
Figura 54. Dos átomos o moléculas que intenten meterse uno dentro del otro se repelen .
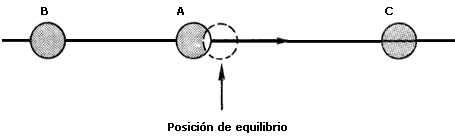
Figura 55. En un sólido los átomos están en sus posiciones de equilibrio. Si el átomo A se sale de esta posición.
Por otro lado, sabemos que las sustancias están compuestas de átomos o moléculas. Estos componentes microscópicos se encuentran siempre en movimiento. Por ejemplo, en el caso de un gas los átomos se muven casi todo el tiempo en líneas rectas, excepto cuando se encuentran en la cercanía de otro átomo y chocan. En este caso los átomos cambian sus direcciones de movimientos. Por otro lado, los átomos de un sólido se encuentran oscilando alrededor de puntos fijos de la sustancia; en un sólido los átomos no se separan distancias grandes como en el caso de un gas; se dice que en el caso de un sólido sus átomos están localizados. Este efecto de localización se debe a las fuerzas de atracción que ejercen los átomos o moléculas entre sí. Al tratar de separarse la partícula A de su posición, por ejemplpo, la que está en el otro extremo, la C, la atrae haciendo que se regrese (Figura 55). Al regresarse, la partícula A se pasa de su posición de equilibrio y entonces la partícula B la atrae en sentido opuesto. El resultado neto es que la partícula A oscila alrededor de su posición de equilibrio.
En un líquido ocurre algo intermedio entre los casos de un gas y de un sólido. Los átomos de un líquido se mueven estando un buen tiempo localizados y después se mueven separándose de sus vecinos, para posteriormente volverse a localizar en otro punto y así sucesivamente. Este efecto de localización también es debido a las fuerzas de atracción entre las partículas. La única diferencia con el caso de un sólido es que en el estado líquido las fuerzas entre los átomos se manifiestan con magnitudes más pequeñas que en el caso del estado sólido.
¿Por qué en un sólido las fuerzas de atracción entre las partículas tienen mayor magnitud que en un líquido? De lo que acabamos de presentar, es claro que para que las fuerzas en un sólido sean de mayor magnitud que en un líquido las partículas que forman al sólido deben estar más cercanas unas de otras que en el caso de un líquido. ¿Por qué ocurre esto? Esta situación se debe a dos efectos que compiten entre sí: el efecto de la temperatura y el de la presión.
Mientras mayor sea la temperatura de una sustancia, mayor será la energía con la que se muevan sus partículas y por tanto, éstas se moverán con mayor velocidad. Mientras más rápidamente se muevan, menos tiempo tendrán de estar juntas y por tanto, en promedio estarán más separadas, con el resultado de que la fuerza de atracción entre ellas será de menor magnitud. En conclusión, a mayor temperatura menor será la fuerza de atracción y por tanto la sustancia estará ya sea en el estado líquido o en el gaseoso.
El otro efecto que compite con el de la temperatura es el de la presión. Este efecto opera en sentido opuesto. Mientras mayor sea la presión que se ejerza sobre una sustancia; sus moléculas se apretarán más y tenderán a estar más cercanas unas de otras, o sea que ejercerán entre sí fuerzas de mayor intensidad.
Según lo dicho, podemos darnos cuenta de que la fase en que se encuentre una sustancia depende tanto de su temperatura como de su presión. Consideremos las siguientes posibilidades.
Supongamos que una sustancia se mantiene a la misma temperatura todo el tiempo y que variamos el valor de su presión, por ejemplo, la aumentamos. Esto se puede lograr de varias maneras, una de las cuales sería comprimirla. Supongamos además que inicialmente la sustancia está en fase gaseosa. Al empezar a aumentar la presión, sus átomos comienzan a estar más juntos unos de otros y empieza a haber una fuerza de atracción. A medida que aumenta la presión la fuerza de atracción aumenta hasta que llega cierto momento en que la sustancia se vuelve un líquido. Si se sigue aumentando la presión seguirá aumentando la magnitud de la fuerza de atracción entre sus partículas y las distancias entre las partículas seguirán disminuyendo, hasta llegar un momento en que el líquido cambie a la fase sólida.
Si se partiera inicialmente de una sustancia en fase sólida y, a la misma temperatura, se le disminuyera la presión; ocurriría lo que acabamos de reseñar pero en sentido opuesto.
Nos damos cuenta entonces que una sustancia puede cambiar de fase si se le mantiene a la misma temperatura y se va cambiando su presión.
También pueden ocurrir cambios de fase si se mantiene el mismo valor de la presión de una sustancia y se va cambiando su temperatura. Esto se puede lograr, por ejemplo, si la sustancia experimenta la presión atmosférica y se le va calentando o enfriando. Supongamos que inicialmente la sustancia esté en la fase sólida. Al empezar a calentar y aumentar la temperatura, sus moléculas empiezan a moverse más rápidamente con lo cual se van alejando unas de otras. Al ocurrir esto, las fuerzas de atracción entre ellas disminuyen su magnitud. Llegará un momento en que las moléculas se separan tanto entre sí que la sustancia se vuelve un líquido. Al seguir aumentando su temperatura, las partículas del líquido siguen separándose más y más hasta que la fuerza de atracción entre ellas es tan pequeña que ya no hay cohesión. En este momento el líquido se vuelve un gas.
Concluimos que una sustancia puede cambiar de fase si se le mantiene a la misma presión y su temperatura se cambia.
De lo anterior vemos que las transiciones de fase ocurren en el siguiente orden:
o en el orden inverso. Esto significa que si, por ejemplo, se tiene un sólido y se le quiere convertir en gas se tiene que pasar por la fase líquida, intermedia. Esto es cierto solamente si la presión a la que ocurren estas transiciones es suficientemente alta. Si se llevan a cabo estas transiciones a presiones cada vez menores, existe un valor de la presión para cada sustancia llamado presión del punto triple, abajo del cual el orden arriba indicado ya no se cumple. En este caso, un sólido se puede transformar directamente en un gas sin pasar por la fase líquida.
A esta transición de sólido a gas se le llama sublimación. El proceso inverso también se da abajo de la presión del punto triple una sustancia gaseosa, al ser enfriada, se transforma directamente a la fase sólida.
La presión del punto triple es muy pequeña para muchas sustancias; sin embargo, para algunas es bastante alta. Por ejemplo, para el bióxido de carbono es muchísimo más alta que la atmosférica. Por tanto, si uno tiene un trozo de bióxido de carbono sólido, el llamado hielo seco, y se le calienta, empieza a despedir vapor. Es decir, se sublima transformándose directamente de la fase sólida a la gaseosa. Algunas otras sustancias, como los desodorantes sólidos, también tienen valores de la presión del punto triple muy altos, por lo que si se les calienta a la presión atmosférica se subliman emitiendo gas.
Una experiencia muy familiar es cuando en un vaso de agua soltamos una gota de tinta. Sabemos que después de cierto tiempo toda el agua del vaso se coloreará, es decir, la tinta se habrá esparcido por todo el volumen del agua. Se dice que la tinta se difundió a través del agua.
El fenómeno de difusión de una sustancia en otra ocurre cuando una de ellas presenta diferencias de concentración. Aclararemos esta afirmación. En el caso de la tinta y el agua arriba mencionado, ocurre que en el instante inicial toda la tinta está concentrada en una región muy pequeña del espacio, a saber, aquella que ocupa la gota. En el resto del agua no hay tinta. Por lo tanto, hay una diferencia de concentraciones de tinta entre esta región y cualquier otra región del vaso. Ahora bien, en presencia de esta diferencia de concentración hay una tendencia a que la concentración de tinta se uniformice. En este proceso las moléculas que componen la tinta se mueven en todas direcciones, pero el movimiento neto o promedio ocurre en la dirección y sentido de las regiones en que no hay tinta, o ya iniciado el proceso, en dirección y sentido en que la concentración de tinta sea menor.
Es importante aclarar que las moléculas de la tinta no se mueven directamente de una región a otra. En general, el tipo de movimiento que realiza cada una de ellas es en zigzag. Si la molécula de tinta se moviese, directamente, dado que su velocidad es muy alta, digamos 2 000 km/h, el tiempo que tardaría cada una de ellas en cruzar el vaso sería de 0.00004 segundos. Sin embargo, el tiempo que tarda en uniformizarse es en general de varios segundos o más. Lo que ocurre es, como se decía, que las moléculas de tinta no se mueven directamente ya que experimentan choques con las moléculas del agua que las retrasan y hacen que su trayectoria sea en zigzag. Sin embargo, la tendencia es a uniformizar el valor de la concentración de la tinta. Este proceso se llama difusión.
Una vez que la concentración de la tinta es la misma en todas las regiones del vaso, deja de haber difusión; es decir, cuando la concentración tiene el mismo valor en todos los puntos del vaso, cesa este fenómeno difusivo.
Por tanto, la difusión se da solamente cuando hay diferencias de concentración y ocurre de tal forma que tiende a eliminar estas diferencias, es decir, a uniformizar la concentración.
VII.2 ¿CÓMO LLEGAN LAS SUSTANCIAS OLOROSAS A NUESTRA NARIZ?
Cuando estamos en un extremo de una habitación y alguien abre una botella de perfume, en el otro extremo oleremos el perfume aun con los ojos cerrados y sin que se nos avise de su presencia. Los fenómenos que ocurren para que esto suceda son los siguientes: en general, a cierta altura sobre el nivel del mar, o sea para cierto valor de la presión atmosférica, las temperaturas ambientes son un poco más altas que la temperatura de evaporación del perfume. Por tanto, al dejar abierta la botella el perfume se evapora. Cuando la botella está cerrada, al evaporarse el perfume y no poder escapar el gas, la presión que experimenta el perfume aumenta por lo que su temperatura de evaporación también aumenta. Este aumento rebasa el valor de la temperatura ambiente y en consecuencia deja de ocurrir la evaporación.
Mientras más alta sea la temperatura de la localidad, mayor será la cantidad de perfume que se evapore. Asimismo, mientras menor sea la presión atmosférica, o sea mientras más alto estemos sobre el nivel del mar, mayor será la cantidad de perfume que se evapore.
Una vez que se empieza a evaporar el perfume, su concentración aumenta en la cercanía del lugar en que se encuentra la botella, generándose una diferencia de concentración. Así empieza a operar otro mecanismo, el de la difusión. El perfume se empieza a difundir a todo el volumen de la habitación hasta que algunas de sus moléculas llegan a nuestra nariz.
Si en la habitación hubiese viento, entonces además de la difusión, las moléculas del perfume serían arrastradas por el viento.
También podemos oler algunas sustancias que son sólidas. En estos casos lo que ocurre es que el valor de la presión atmosférica es menor que el valor del punto triple del sólido y por tanto, a una temperatura suficientemente alta el sólido se sublima, es decir, pasa directamente de sólido a gas, sin hacerlo por la fase líquida. De nuevo una vez que hay gas de la sustancia, empieza a operar el mecanismo de difusión.
Al entrar en una cocina olemos la comida que se está cocinando. En este caso, como es fácil convencerse, de las ollas sale gas o vapor con moléculas de la comida; que por medio de la difusión llegan a nuestra nariz.
La nariz es el órgano mediante el cual se realiza la entrada y salida del aire que respiramos. También podemos respirar por medio de la boca, ya que en el fondo de ella, en la nariz interna, hay un conducto que se comunica con los conductos nasales (Figura 56). En la parte superior de estos conductos, entre nuestros ojos, se encuentra el epitelio sensitivo, que consiste en un conjunto de cilios bañados dentro de una mucosa muy pegajosa en la que se mueven. Los cilios (Figura 57) forman los extremos de las células olfativas propiamente dichas, las cuales están conectadas por fibras a los glomérulos que forman el bulbo olfativo. Estas fibras cruzan un hueso con muchas aberturas pequeñas, ya que el bulbo olfativo se encuentra dentro del hueso craneano.
Del otro extremo de los glomérulos salen las células mitrales de donde emergen las terminales nerviosas que se conectan al cerebro.
De hecho, desde los cilios que están en la nariz interna hasta la salida de las células mitrales se forma un conducto nervioso que es el único en nuestro cuerpo que tiene salidas al exterior.
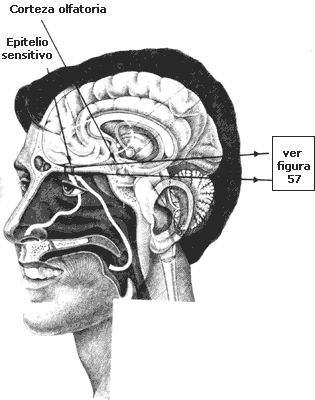
Figura 56. Caminos que toma el aire dentro de la cabeza humana.
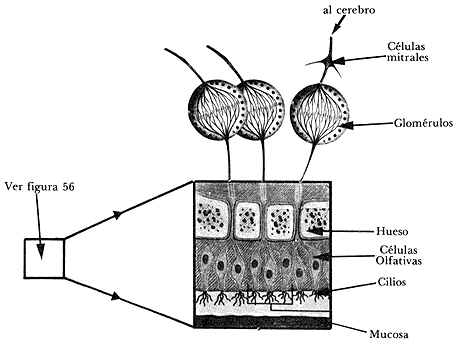
Figura 57. Esquema del epitelio sensitivo que nos permite oler.
VII.4. ¿CÓMO PERCIBIMOS LOS OLORES?
Cuando un objeto, emite un olor y nos llega a la nariz esto quiere decir que moléculas de dicho objeto se han desprendido de él y llegado, por difusión o arrastre, a nuestra nariz. Estas moléculas entran en la nariz debido a la aspiración que realizamos cuando respiramos. En este proceso, el aire que inhalamos arrastra a las moléculas que están en la vecindad de la nariz. La corriente de aire que entra da lugar a una corriente secundaria que pasa por el epitelio sensitivo (Figura 56). La cantidad de aire y por tanto la fracción de moléculas del objeto oloroso que se deposita en el epitelio es muy pequeña.
También llegan corrientes de aire desde la boca. La comida que tenemos en la boca también despide moléculas que son arrastradas hasta el epitelio sensitivo. Este hecho tiene como consecuencia que la sensación predominante al comer provenga no del gusto que se inicia en la lengua sino del olfato.
La sensación de oler se experimenta cuando las moléculas aromáticas llegan a la mucosa nasal, en donde se disuelven. Así, estas moléculas entran en contacto con los cilios (Figura 57).
Hasta hoy en día no se ha podido determinar con certeza el mecanismo por medio del cual se inicia el proceso a través de los receptores nerviosos que nos dan la sensación de oler. Mencionaremos algunas ideas que se han expuesto y que parecen tener algunos elementos que pueden ser verdaderos.
En primer lugar, en general, somos muy sensibles a una cantidad extraordinariamente grande de olores distintos. A primera vista podríamos pensar que hay un nervio olfatorio sensible a cada olor posible. Sin embargo, hasta hoy en día no se han encontrado estas diferencias en los cilios nasales.
En muchos casos resulta que la presencia de un átomo particular en la molécula de la sustancia olorosa es la que le da su olor peculiar. Como ilustración podemos mencionar el caso del agua, cuya molécula tiene un átomo de oxígeno y dos de hidrógeno, H2O. Si se sustituye el átomo de oxígeno por uno de azufre se obtiene el sulfito de hidrógeno, H2S. Esta última sustancia despide el olor de huevos podridos. Otro ejemplo es el del bióxido de carbono que tiene un átomo de carbón y dos de oxígeno. Su fórmula química es CO2. Este gas no tiene olor. Si ahora reemplazamos los oxígenos por átomos de azufre obtenemos el disulfuto de carbono, cuya fórmula química es CS2. Resulta que el olor de este último compuesto nos es repelente. Vemos que la sustitución de un átomo de oxígeno por uno de azufre lleva a cambios notablemente desagradables en el olor de las sustancias.
Por otro lado, existen algunas evidencias de que no es nada más la composición química específica de las molécas olorosas, sino también su forma la que hace que reaccionemos a su olor. En efecto, existen sustancias cuyas moléculas tienen composiciones químicas diferentes pero con formas muy parecidas, y sentimos que tienen olores muy parecidos. Por ejemplo, el alcanfor, el exacloroetano, el ciclooctano son compuestos que tienen composiciones químicas muy distintas pero sus moléculas tienen formas y tamaños muy parecidos. Cuando olemos estos compuestos nos dan casi la misma sensación, la del alcanfor.
Sin embargo, la explicación desde el punto de vista molecular de cómo olemos
sigue sin respuesta definitiva.