II. ELECTRODOS DE REFERENCIA
LOS PROCESOS que tienen lugar en la interfase metal-solución de
cualquier metal en contacto con un electrolito (medio agresivo), no se pueden
medir de una manera absoluta (tiene que ser tan sólo relativa). El metal en
contacto con el electrolito tiene, por un lado, tendencia a disolverse, con
lo que queda cargado negativamente.
y, por otro lado, a que iones del electrolito se depositen sobre el metal:
con lo que se alcanza el equilibrio en un determinado momento:
Se ha creado, pues, una diferencia de potencial entre el metal y el electrolito. Para poder medir esta diferencia de potencial se adoptó un electrodo patrón que es el electrodo normal de hidrógeno, al cual, por convención y a cualquier temperatura, se le asignó el valor cero.
Este electrodo está constituido por una lámina de platino-platinado, sobre
la cual se hace burbujear hidrógeno gas a la presión de una atmósfera, sumergida
en una solución ácida (electrolito), cuya actividad de iones hidrógeno a 25°C
es la unidad, de acuerdo con la reacción de equilibrio:
En las condiciones mencionadas, el potencial de este electrodo es únicamente
función del pH, según la siguiente expresión:
Tomando como referencia el electrodo de hidrógeno, el potencial de un metal
cualquiera sumergido en una solución de sus iones de actividad igual a la unidad,
corresponde a la fuerza electromotriz de una pila, en la cual el semielemento
metal/solución de sus iones actúa como polo positivo, o sea de cátodo, y el
electrodo de H2 como polo negativo,
o ánodo, según la convención propuesta por la Unión Internacional de Química
Pura y Aplicada (IUPAC), universalmente aceptada. Lo anterior lo
podemos representar de una manera esquemática como:
donde una barra indica la presencia de una interfase y la doble barra significa
la presencia de una unión electrolítica o puente salino entre ambos semielementos
de la pila. En la convención propuesta, el polo negativo o ánodo se coloca en
el lado izquierdo de la pila, en la forma en que tiene lugar la reacción de
oxidación:
Los electrones generados en esta reacción pasarán al otro electrodo, positivo o cátodo, a través de un conductor metálico externo, de cobre por ejemplo, donde los iones Me n + serán reducidos. La reacción global del proceso será la siguiente:
H2 + Me n +
El potencial de la pila propuesta se puede determinar a partir de
pila = Ecátodo
-Eánodo
Basándose en lo anterior, se pueden presentar dos casos:
pila < 0 El primer caso supone, dado que el electrodo de H2, por convenio, se toma con
un potencial de 0 voltios, que necesariamente el semielemento que actúa como
polo positivo debe de tener un potencial de reducción positivo, lo cual en términos
energéticos equivale a decir que la reacción
está desplazada hacia la derecha. Un voltímetro que uniera los dos semielementos que constituyen la pila debería conectarse de tal manera que el polo (-) se uniera al electrodo de hidrógeno y el polo (+) al del metal. Es decir, el polo (+), de mayor potencial siempre (cátodo), se une a ese mismo polo del voltímetro y el polo (-), de menor potencial (ánodo), se une al negativo del voltímetro. En estas condiciones, la diferencia de potencial medida, correspondiente a la pila formada, sería numéricamente igual al potencial de reducción del semielemento derecho de la pila, Me n+/Me. Si se construyen pilas de estas características, se podrían determinar los potenciales de reducción de todos aquellos semielementos cuyo potencial es positivo o mayor que 0 (el del hidrógeno).
En el segundo caso, al ser el potencial de la pila menor que cero (negativo),
esto implica necesariamente que el flujo de electrones irá en sentido contrario,
es decir, que la producción de electrones se deberá a la oxidación (disolución)
del metal del semielemento de la derecha:
lo cual implica que la reacción está desplazada hacia la derecha, favorecida
energéticamente. Es tos electrones suministrados serán tomados por el otro semielemento,
y tendrá lugar la siguiente reacción.
Me + 2H +
Todos aquellos semielementos que unidos a un electrodo normal de hidrógeno den un potencial de pila negativo, con la convención propuesta, tendrán un potencial de reducción más negativo que el del hidrógeno, o sea menor que 0.
De esta forma se construye la serie electroquímica de los metales, representada
en el cuadro 3.
|
|
||||
|
Sistema
|
Semirreacción
|
Potencial E°, V A 25°C
|
||
|
|
||||
|
Li + / Li
|
Li + 1e-
|
|
Li
|
-3.045
|
|
K +/ K
|
K ++ 1e
|
|
K
|
-2.925
|
|
Cs +/Cs
|
Cs ++ 1e-
|
|
Cs
|
-2.923
|
|
Ba2+ / Ba
|
Ba2+ + 2e-
|
|
Ba
|
-2.90
|
|
Sr2 + Sr
|
Sr 2++ 2e-
|
|
Sr
|
-2.89
|
|
Ca2 +
/Ca
|
Ca 2++ 2e
|
|
Ca
|
-2.87
|
|
Na + / Na
|
Na ++ 1e-
|
|
Na
|
-2.714
|
|
Mg 2+ / Mg
|
Mg 2++ 2e-
|
|
Mg
|
-2.37
|
|
Al 3+ / Al
|
Al 3+
+ 3e-
|
|
Al
|
-1.66
|
|
Mn2+ / Mn
|
Mn 2+ + 2e-
|
|
Mn
|
-1.18
|
|
Cr 2+ / Cr
|
Cr 2+ + 2e-
|
|
Cr
|
-0.913
|
|
V 3+ / V
|
V3++ 3e-
|
|
V
|
-0.876
|
|
Zn 2+ / Zn
|
Zn 2++ 2e-
|
|
Zn
|
-0.762
|
|
Cr 3+ / Cr
|
Cr 3++ 3e-
|
|
Cr
|
-0.74
|
|
Fe 2+ / Fe
|
Fe 2+ 2e-
|
|
Fe
|
-0.99
|
|
Cd 2+
/ Cd
|
Cd 2+
2e-
|
|
Cd
|
-0.402
|
|
In 3+
/ In
|
In 3+ + 3e-
|
|
In
|
-0.342
|
|
Co 2+ / Co
|
Co 2+ 2e-
|
|
Co
|
-0.277
|
|
Ni 2+ / Ni
|
Ni 2+ + 2e-
|
|
Ni
|
-0.250
|
|
Sn 2+ / Sn
|
Sn 2++ 2e-
|
|
Sn
|
-0.136
|
|
Pb 2+ / Pb
|
Pb 2+ + 2e-
|
|
Pb
|
-0.126
|
|
Fe 3+ / Fe
|
Fe 3+ + 3e-
|
|
Fe
|
-0.036
|
|
H + / H 2
|
2H + + 2e-
|
|
H2
|
0.000
|
|
Cu 2+ / Cu
|
Cu 2++ 2e-
|
|
Cu
|
0.337
|
|
Hg 2+ / Hg
|
Hg 2+ + 2e-
|
|
2 Hg
|
0.789
|
|
Ag 2+ / Ag
|
Ag 2+ + 1e-
|
|
Ag
|
0.799
|
|
Hg 2+ / Hg
|
Hg 2+ + 2e-
|
|
Hg
|
0.857
|
|
Pd 2+ Pd
|
Pd 2+ + 2e-
|
|
Pd
|
0.987
|
|
Pt 2+ / Pt
|
Pt 2+ + 2e-
|
|
Pt
|
1.19
|
|
Au 3+ / Au
|
Au 2+ + 3e-
|
|
Au
|
1.500
|
|
|
||||
Hay que resaltar que en la bibliografía norteamericana, es común que se trabaje con potenciales de oxidación, por lo que serán los mismos en valor absoluto, pero con el signo cambiado. Por ejemplo, el oro (Au) tiene un potencial de reducción alto y positivo porque es fuerte su tendencia a aparecer en su estado reducido; consecuentemente, su tendencia a la oxidación es pequeña y su potencial de oxidación es alto en valores absolutos, pero negativo.
Las dificultades operativas que se presentan en el manejo de un electrodo de hidrógeno, demasiado frágil para la mayoría de las aplicaciones prácticas, han dado lugar a la utilización de otros electrodos de referencia que lógicamente deben de reunir determinadas condiciones. Aparte de ser manejables y de construcción sencilla, la condición fundamental es que el potencial de equilibrio de la reacción de óxido-reducción (redox) que tenga lugar en ellos, permanezca constante respecto al electrodo de hidrógeno. En estas condiciones, en cualquier momento se podría referir un potencial al del electrodo de hidrógeno o viceversa.
Como electrodos de referencia se utilizan los siguientes:
1) Electrodo de calomelanos. Este electrodo está formado por mercurio cubierto por una capa de cloruro insoluble (calomelanos), Hg2Cl2 en equilibrio con una disolución de cloruro potásico, KCl, que puede ser 0.1 N, 1 N o saturada. El contacto eléctrico con el mercurio se realiza por medio de un hilo de platino. Un esquema de este electrodo se presenta en la figura 7(a).
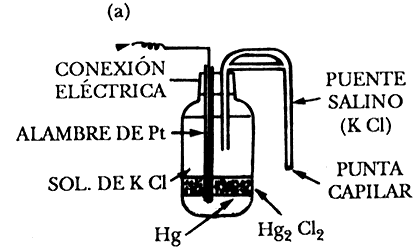
Figura 7 Electrodos de referencia: a) Calomelanos saturado, ECS
La reacción del electrodo de calomelanos es:
Así pues, si el electrodo actúa como ánodo (-) la reacción es hacia la izquierda,
![]() (oxidación);
si el electrodo actúa como cátodo (+), la reacción es hacia la derecha,
(oxidación);
si el electrodo actúa como cátodo (+), la reacción es hacia la derecha, ![]() (reducción).
(reducción).
2) Electrodo de plata/cloruro de plata (Ag/AgCl). Está formado por un hilo de Ag sobre el cual se deposita AgCl, generalmente por vía electroquímica, en una solución de NaCl o KCl, en la cual el hilo de Ag actúa como ánodo, como se muestra en la figura 7(b).
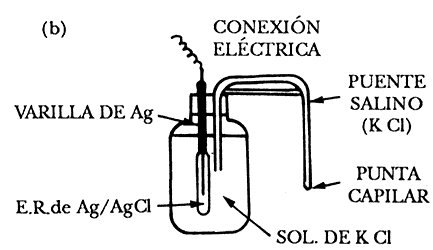
Figura 7 b) Plata /cloruro de plata, Ag/AgCl
La reacción electródica es la siguiente:
y su potencial de equilibrio a 25°C es:
En agua de mar, el valor del potencial es aproximadamente de + 0.25 V respecto al electrodo normal de hidrógeno (ENH) a 25°C. El potencial del electrodo depende muy especialmente de la salinidad de la solución en la cual el electrodo está sumergido.
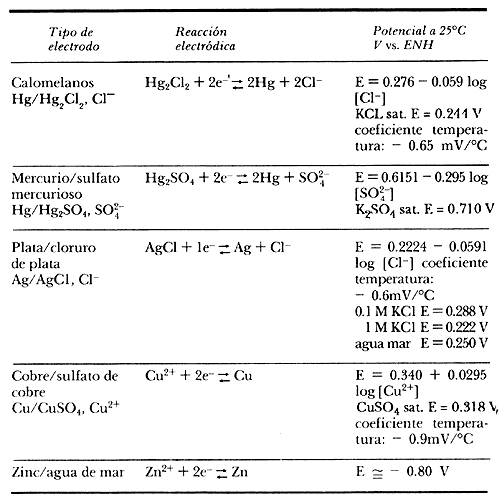
3) Electrodo de zinc (Zn). Está constituido por un bloque de Zn de alta pureza; generalmente se utiliza una aleación de Zn como la empleada para los ánodos galvánicos de Zn de composición como la especificada por la norma militar americana: MIL-A-18001 H (véase el cuadro 4).
La reacción electródica es la siguiente:
y su potencial de equilibrio a 25°C es:
El potencial en agua de mar es de cerca de -0.80 V vs. ENH.
Se emplea como electrodo de referencia fijo en agua de mar, como alternativa a los de Ag/ AgCl. También puede utilizarse en el suelo. Un esquema del mismo se presenta en la figura 7 (c)
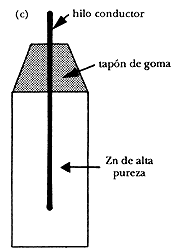
4) Electrodo de cobre/sulfato de cobre (Cu/CuSO4). Está formado por una barra cilíndrica de Cu sumergida en una solución de CuSO4 saturada. El contacto electrolítico con la solución o suelo se realiza mediante un puente salino constituido (formado) por un tapón de madera de balsa. En la figura 7(d) se ilustra este tipo de electrodo.
Figura 7 d) Cobre/ sulfato de cobre, Cu/CuSO4.
La reacción de electrodo es la siguiente:
su potencial de equilibrio a 25°C viene dado por:
Con la solución saturada de CuSO4,
se tiene E = + 0.318 V vs. ENH, pero para uso práctico se considera
un valor de 0.30 V. Este tipo de electrodo puede utilizarse en cualquier
ambiente, sea en el suelo o agua de mar, aguas dulces o saladas. Entre otras
ventajas, presenta la sencillez de su preparación y su gran estabilidad. Cuando
se utiliza en agua de mar, puede contaminarse con cloruros, por lo cual es aconsejable
más bien en el suelo, en aguas dulces y en salmueras.
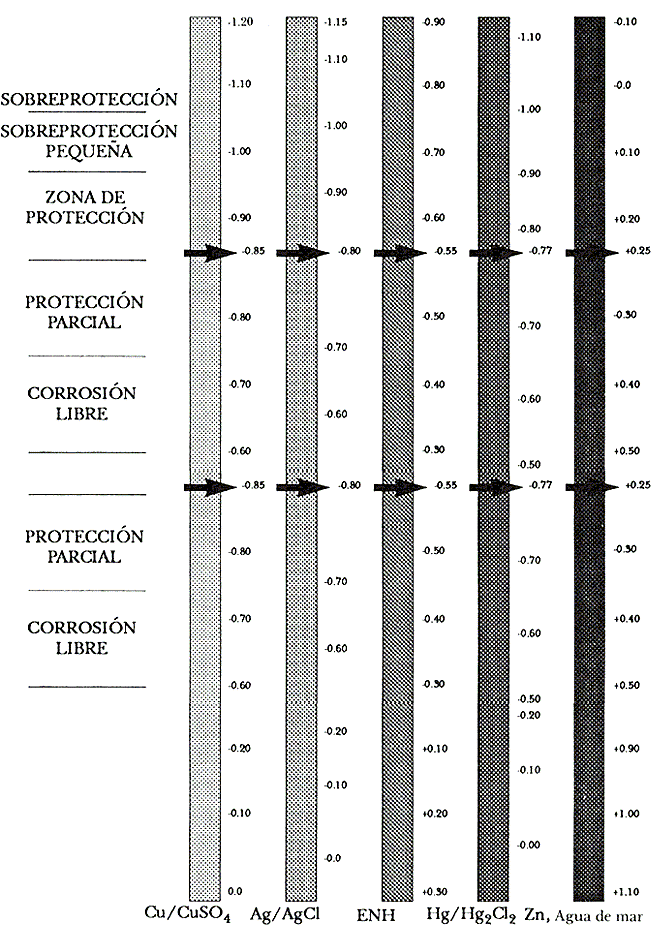 |
Figura 8. Equivalencia aproximada entre las escalas de potencial relativas a los electródos de referencia utilizados en protección catódica, con indicación de los intervalos de corrosión, protección y sobreprotección para acero al carbono.