III. CORROSIÓN ELECTROQUÍMICA
UNA celda electroquímica es una combinación del tipo siguiente:
|
Conductor electrónico (metal) |
Conductor iónico (electrolito) |
Conductor electrónico (metal) |
En ella pueden tener lugar procesos electroquímicos con el paso de una corriente eléctrica. Si la celda electroquímica produce energía eléctrica, causada por el consumo de energía química, se dice que tenemos una celda galvánica o pila. Si, en cambio, la celda electroquímica consume corriente de una fuente de corriente externa, almacenando como consecuencia energía química, se dice que tenemos una celda electrolítica.
Algunas celdas galvánicas reciben nombres especiales. Una celda de corrosión es una celda o pila galvánica en la cual las reacciones electroquímicas que tienen lugar conducen a la corrosión. Una celda de corrosión de dimensiones muy pequeñas (por ejemplo ( < 0.1 mm) se conoce como celda de acción localizada o microcelda galvánica. Las celdas locales o micropilas se dan, por ejemplo, en aleaciones multifásicas o en metales con recubrimientos que presentan buena conductividad eléctrica o en inclusiones de óxidos, sulfuros, carbón, etc. La acción de estas celdas a menudo conduce a un ataque localizado, tal como picaduras o corrosión bajo tensión.
Para la notación de los dos electrodos en una celda electroquímica (galvánica o electrolítica) son válidas las siguientes definiciones generales: El ánodo es el electrodo en el cual, o a través del cual, la corriente positiva pasa hacia el electrolito. El cátodo es el electrodo en el cual entra la corriente positiva proveniente del electrolito.
Generalmente, se toman como válidas las siguientes reglas:
1) La reacción anódica es una oxidación y la reacción catódica una reducción.
2) Los aniones (iones negativos) migran hacia el ánodo y los cationes (iones positivos) hacia el cátodo. Hay que hacer notar que particularmente en una celda galvánica, por ejemplo en una pila seca (Figura 9), la corriente positiva fluye del polo (+) al (-) en el circuito externo, mientras que dentro de la celda, la corriente positiva fluye del (-) al (+).
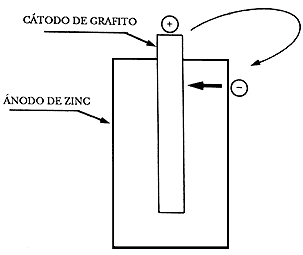
Figura 9. Dirección de la corriente positiva en una pila seca.
La corrosión electroquímica es un proceso espontáneo que denota siempre la existencia de una zona anódica (la que sufre la corrosión), una zona catódica y un electrolito, y es imprescindible la existencia de estos tres elementos, además de una buena unión eléctrica entre ánodos y cátodos, para que este tipo de corrosión pueda tener lugar. La corrosión más frecuente siempre es de naturaleza electroquímica y resulta de la formación sobre la superficie metálica de multitud de zonas anódicas y catódicas; el electrolito es, en caso de no estar sumergido o enterrado el metal, el agua condensada de la atmósfera, para lo que la humedad relativa deberá ser del 70%.
El proceso de disolución de un metal en un ácido es igualmente un proceso electroquímico. La infinidad de burbujas que aparecen sobre la superficie metálica revela la existencia de infinitos cátodos, mientras que en los ánodos se va disolviendo el metal. A simple vista es imposible distinguir entre una zona anódica y una catódica, dada la naturaleza microscópica de las mismas (micropilas galvánicas). Al cambiar continuamente de posición las zonas anódicas y catódicas, llega un momento en que el metal se disuelve totalmente.
Las reacciones que tienen lugar en las zonas anódicas y catódicas son las siguientes:
| O2+2H2O
+ 4e- |
(medio ácido) |
} |
(oxidación) |
|
(medio neutro y alcalino) |
(reducción) |
Ya que la corrosión de los metales en ambientes húmedos es de naturaleza electroquímica, una aproximación lógica para intentar parar la corrosión sería mediante métodos electroquímicos. Los métodos electroquímicos para la protección contra la corrosión requieren de un cambio en el potencial del metal para prevenir o al menos disminuir su disolución.
La protección catódica, en este sentido, es un tipo de protección (electroquímico) contra la corrosión, en el cual el potencial del electrodo del metal en cuestión se desplaza en la dirección negativa. Los principios de la protección catódica pueden ilustrarse mediante un diagrama termodinámico potencial - pH, como se muestra en la figura 10, en el caso del hierro (Fe).
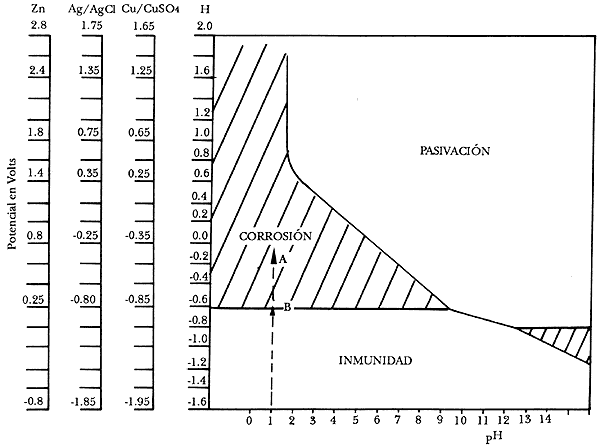
Figura 10. Diagrama potencial -pH para el Hierro (Fe).
Consideremos un espécimen de acero al carbono sumergido en ácido clorhídrico (HCl) de concentración 0.1 M. El acero se disolverá con desprendimiento de hidrógeno (H2). El potencial de corrosión del espécimen quedará entre los potenciales de equilibrio correspondientes al electrodo de H2 y Fe (puntos A y B en la figura 10).
De acuerdo con el diagrama, hay un camino para prevenir la corrosión mediante un cambio de potencial. Aplicando una corriente catódica, el potencial del espécimen de acero se desplazará en la dirección negativa, hacia la zona de inmunidad, en la cual el metal, termodinámicamente, se encuentra estable (no se puede corroer). Para lograr este desplazamiento del potencial en la dirección negativa, el objeto que se corroe se une eléctricamente a un metal más negativo en la serie electroquímica, un ánodo, formando una celda galvánica en la que actuará como cátodo. Para que el metal esté protegido catódicamente, el valor de su potencial de electrodo tiene que quedar por debajo de su potencial de corrosión en la solución mencionada. Su disolución será así prevenida totalmente (protección catódica completa) o al menos disminuirá (protección catódica incompleta). Como consecuencia de la corriente que circule en la celda galvánica formada, en el metal protegido catódicamente tendrá lugar el desprendimiento de hidrógeno o la reducción de oxígeno.
FUNDAMENTOS DE LA PROTECCIÓN CATÓDICA
Como se ha señalado, para que exista la corrosión electroquímica o húmeda, como se le conoce también, es fundamental que se ponga en funcionamiento una pila galvánica que denota la existencia de un ánodo, un cátodo y un electrolito. En el momento en que uno de estos tres elementos básicos para el funcionamiento de una pila falle, ésta dejará de funcionar y por tanto se detendrá la corrosión.
Los sistemas de protección contra la corrosión están basados en la eliminación de alguno de estos elementos o en hacerlos inoperantes.
El procedimiento que elimina todos los ánodos de la superficie metálica haciéndola toda catódica, se conoce con el nombre de protección catódica.
¿Cómo se puede volver catódica una superficie metálica? Existen dos procedimientos diferentes para lograrlo:
a) Conectando el metal que se trata de proteger a otro menos noble que él, es decir, más negativo en la serie electroquímica (Cuadro 3). Este sistema se conoce como protección catódica con ánodos galvánicos o de sacrificio y consiste realmente en la creación de una pila galvánica en que el metal a proteger actúe forzosamente de cátodo (polo positivo de la pila), mientras que el metal anódico se "sacrifica", o sea que se disuelve (Figura 11). Como el metal más comúnmente utilizado en la práctica por su bajo precio y alta resistencia mecánica es el acero, los metales que se puedan conectar a él y que deben tener un potencial más negativo quedan reducidos en la práctica al zinc (Zn), aluminio (Al), magnesio (Mg) y a sus aleaciones.
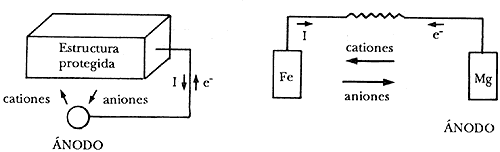
Figura 11. Protección catódica con ánodos galvánicos o de sacrificio.
b) Conectando el metal a proteger al polo negativo de una fuente de alimentación de corriente continua, pura o rectificada, y el polo positivo a un electrodo auxiliar que puede estar constituido por chatarra de hierro, ferro-silicio, plomo-plata, grafito, etc. Este sistema se conoce con el nombre de protección catódica con corriente impresa. Un esquema simplificado del mismo se presenta en la figura 12.
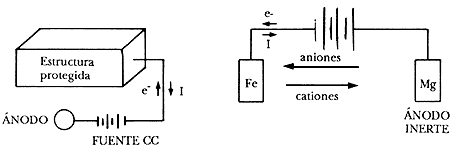
Figura 12. Protección catódica con corriente impresa.
Desde el punto de vista de la termodinámica, la protección catódica se basa en la existencia de un potencial y de una zona de inmunidad, en el correspondiente diagrama de estabilidad termodinámica o diagrama potencial - pH, más conocido como diagrama de Pourbaix. Si consideramos este diagrama para el caso del hierro (acero) figura 10, se puede observar en él que están perfectamente delimitadas las zonas de corrosión, inmunidad y pasividad. Para poder pasar el hierro a la zona de inmunidad hay que rebajar su potencial a un valor de 0.62 V con respecto al electrodo de referencia de hidrógeno, que equivale a -0.80 V con respecto al Ag/AgCl. Esta será, pues, otra definición de la protección catódica. La densidad de corriente que será necesario aplicar para conseguir rebajar el potencial de la estructura a proteger (0.80 V) al valor señalado. Éste será un dato de gran valor ya que influirá directamente en la economía del sistema.
Desde un punto de vista cinético, en un sistema cualquiera en el cual tenga lugar el fenómeno -de corrosión, existe un balance perfecto entre las reacciones anódicas y catódicas sobre la superficie del metal. En un diagrama de Evans se ejemplifica lo anterior en la figura 13(a) que representa un diagrama que relaciona la densidad de corriente con el potencial.
Por razones de simplicidad en la construcción gráfica, se acostumbran representar ambos procesos, anódico o de oxidación y catódico o de reducción, en un mismo cuadrante con lo que se obtiene, como se indica en la figura 13(b) el diagrama de Evans, o el de Evans-Tafel si en lugar de utilizar la corriente se emplea el logaritmo de la corriente (Figura 13(c)). Polarizando la superficie del metal que se corroe a un valor igual o inferior a Ea (Figura 13) se anula la reacción anódica en el metal, siendo Ipc la corriente catódica que tendrá que ser suministrada por el sistema de protección catódica.
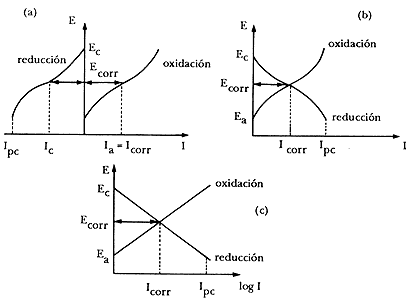
Figura 13. Diagrama de Evans de un sistema en corrosión.
Cuando la cinética de los dos procesos, anódico y catódico, es tal que una pequeña variación en la corriente catódica provoca una gran variación en la corriente anódica (o sea en la corriente de corrosión), se dice que el sistema está bajo control catódico. Inversamente, cuando una pequeña variación en la corriente anódica produce un gran desequilibrio en el proceso catódico, o sea, en la intensidad de corrosión, se dice que el sistema está bajo control anódico. En la figura 14 se representan ambos casos.
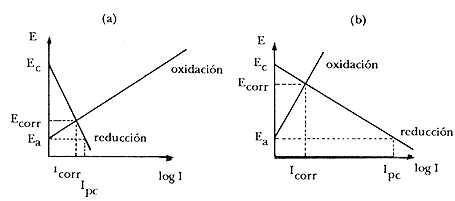
Figura 14. Sistema bajo control: (a) anódico, (b) catódico.
En los sistemas en corrosión en los cuales la reacción catódica predominante
es la reducción del oxígeno, O2, agua de mar por ejemplo,
según
se tiene un control catódico. La intensidad de corriente depende de la disponibilidad del O2 que llega a la interfase metal/electrolito, la cual está limitada por la velocidad con que el O2 llega del seno del electrolito hasta la interfase.
Por lo general, un sistema de protección catódica puede considerarse como una
pila o celda galvánica. Teniendo en cuenta una micropila de corrosión cualquiera,
como la que se muestra en la figura 15(a), o un esquema equivalente de la misma
(Figura 15(b)), se tiene:
En esta misma figura, Ea es el potencial del ánodo, Ec
el potencial del cátodo, Ra la resistencia del ánodo y Rc
la resistencia del cátodo. Existe siempre una resistencia asociada al ánodo
y al cátodo que limita la corriente producida por una pila de corrosión, Io,
que como se desprende del circuito eléctrico de la figura 15(b), debe ser igual
a la corriente que circula por ambos electrodos, Ia e Ic,
o sea: conocida como la corriente de corrosión de la pila Icorr.
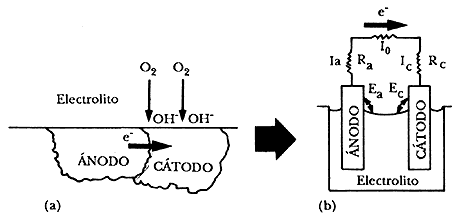
Figura 15. (a) Micropila corrosión. (b) Esquema eléctrico equivalente.
Si se introduce en el sistema anterior un tercer electrodo, un ánodo galvánico,
designado como P, tendremos una pila con tres electrodos (Figura 16). Si aplicamos
la ley de Kirchoff se obtiene:
c = Ia
+ Ip
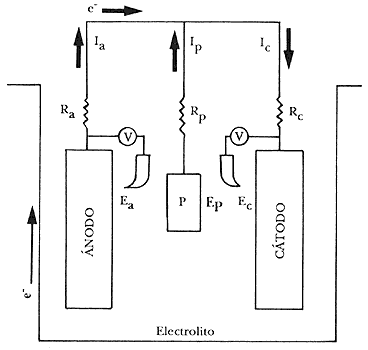
Figura16. Esquema eléctrico equivalente.
La fuerza electromotriz (fem) entre el ánodo y el cátodo es:
| Ec - Ea = (Ia+Ip)Rc +IaRa = IaRc+IpRc+IaRa |
| Ec - Ea = Ia(Rc + Ra) + Ip Rc, |
de donde, despejando la se tiene lo siguiente:
|
Ia =
|
(Ec
- Ea) - IpRc
|
|
|
|
|
Rc+Ra
|
|
Ec
- Ea
|
= I o,
|
|
|
|
|
Ra
+ Rc
|
|
Rc
|
= K,
|
|
|
|
|
Ra
+ Rp
|
Ia = Io - KIp.
Haciendo que KIp = Io, se tiene que Ia = 0, o sea la condición de que la corriente de corrosión sea cero, para lo cual se tiene que cumplir que
|
Ip
= Io/K = Io
|
Ra
+ Rp
|
|
|
|
|
Rc
|
Anulando así la corriente de corrosión, se proporciona el sistema de protección.