II. FLUIDOS MULTIFÁSICOS
EN EL capítulo anterior hemos presentado un conjunto de sistemas,
algunos de los cuales verdaderamente podemos llamar fluidos o líquidos, y otros
que, sin serlo estrictamente, se comportan como tales y exhiben características
o propiedades singulares si se les compara con los líquidos ordinarios como
el agua, el aire, el alcohol, etc. Por esta razón su comportamiento merece el
calificativo de exótico. Pero en la naturaleza existen gran variedad
de fenómenos en los cuales intervienen líquidos que per se no son necesariamente
exóticos, pero que, al entrar en contacto con otro sistema, que puede o no ser
un líquido, dan lugar a un comportamiento que bien pudiera calificarse como
tal. Vierta el lector el contenido de una botella de cerveza en un tarro y observe
la formación caprichosa de la espuma. La cerveza no es por sí misma un líquido
exótico (¡aunque el bebedor, si la ingiere en grandes cantidades, puede llegar
a serlo!), pero la espuma, que no es un líquido ni un gas, sino una "interfase"
caprichosa de ambos, sí tiene rasgos que bien pueden calificarse de exóticos.
¿Qué es la espuma?, ¿es posible definirla o caracterizarla de algún modo?

Veamos otro ejemplo. Tómese un poco de aceite, como el lubricante que usamos en los automóviles, y colóquese en un frasco. Agreguemos otro tanto de agua y agitemos. Lo que se forma es una mezcla caprichosa, medio blancuzca, que al contacto con la luz arroja destellos multicolores, y que al dejarla reposar se va nuevamente separando en el aceite y agua originales. Bueno, ¡casi!, porque en medio queda una pequeña capa, que llamaremos nuevamente interfase, que ni es agua ni es aceite, sino un residuo de la mezcla original. Algunas veces llamamos a estas mezclas emulsiones. Unas son estables, lo que quiere decir que no se separan en sus componentes en intervalos de tiempo cortos, horas, días, quizá meses, y otras, como la formada por el agua y el aceite, son menos estables. Son mezclas exóticas, ¿o no?. Lógicamente surgen preguntas como ¿qué es una emulsión?, ¿cómo la caracterizamos físicamente?
Veamos un último ejemplo. ¿Qué le gustaría seleccionar al lector, un trozo de mantequilla, uno de queso, la tinta contenida en el tintero y que estamos usando para escribir, la pintura labial o la pintura vinílica, un litro de aire de la ciudad de México, etc.? ¿Qué tienen en común estos sistemas? A primera vista nada. Unos parecen líquidos, otros juraríamos que son sólidos y el aire contaminado, un gas, naturalmente. Y, sin embargo, sí tienen algo en común: todos los sistemas nombrados están formados por agregados de partículas muy finas cuyas dimensiones son mucho mayores que las atómicas, pero muy pequeñas para ser percibidas a simple vista.
Además, están aglutinadas entre sí de alguna manera y genéricamente se conocen con el nombre de "coloides" (del griego kola significa pegamento y eldos forma). La ciencia de los coloides representa hoy en día una de las ramas más importantes de la fisicoquímica por razones que, en función de los sistemas arriba mencionados, puede el lector fácilmente adivinar. Es interesante señalar que los alquimistas de la Edad Media ya conocían un coloide conocido como "oro potable", formado por una suspensión de partículas muy finas de oro y que tenía usos medicinales.
Tanto las emulsiones como la espuma y los sistemas referidos en los párrafos anteriores, forman parte de un gran mundo al que nos referiremos como el estado coloidal (Tabla 1).
ABLA 1. Diferentes tipos de dispersiones coloidales
|
Medio dispersor
|
Fase dispersa
|
||||||||
|
Gas
|
Líquido
|
Sólido
|
|||||||
|
Gas
|
----------
|
Nieblas y nubes
|
Humos
|
||||||
|
Líquido
|
Espumas |
{
|
Cerveza Crema batida |
Emulsiones
|
{
|
Mayonesa Leche |
Sols
|
{
|
Azufre en agua Oro en agua |
|
Sólido
|
Espuma sólida (Hule espuma) |
Gels ........ gelatinas,....... |
Suspensiones sólidas (algunos plásticos) |
||||||
Tratemos de entender un poco más este mundo. Si ponemos sal o azúcar en agua
y agitamos, ambas desaparecen (siempre y cuando la cantidad de sal o azúcar
no sea excesiva) y decimos que se han "disuelto" en el agua, que han formado
una solución. En realidad lo que ocurre es que los átomos que forman
la sal, unos de sodio y otros de cloro, se combinan con el agua para formar
una sola entidad a la que llamaremos un ion. Esta imagen es un tanto burda,
pero servirá a nuestro propósito de poner un ejemplo claro. Si, por otra parte,
ponemos almidón en agua y agitamos, ante nuestra vista aparece un líquido blanco,
opaco, que en realidad está formado por una minada de partículas de almidón
suspendidas en el agua: no se forman unidades (iones) como en la solución. Hablamos,
entonces, de una suspensión: un gran número de medicamentos, pinturas, shampoos,
etc., son suspensiones, de allí la necesidad de agitarlas antes de usarlas.
Bien, un sistema coloidal está formado por una suspensión formada por partículas
cuyo tamaño oscila entre 0.2 micras y 5 milimicras2 ![]() i.e., no son visibles con un microscopio ordinario. En términos más técnicos,
un coloide es una dispersión de partículas muy finas de un sistema en el seno
de otro, que usualmente es un gas o un líquido. Ahora podemos visualizar mejor
lo antes dicho.
i.e., no son visibles con un microscopio ordinario. En términos más técnicos,
un coloide es una dispersión de partículas muy finas de un sistema en el seno
de otro, que usualmente es un gas o un líquido. Ahora podemos visualizar mejor
lo antes dicho.
En efecto, el smog, el humo de un cigarro o de una chimenea, están formados por partículas sólidas dispersas en un gas, el aire. Pero la niebla o las nubes son sistemas formados por la dispersión de pequeñísimas gotas de un líquido, agua, en un gas, el aire. La emulsión de agua y aceite es una dispersión de un líquido en otro líquido y finalmente la espuma consiste de pequeñísimas burbujas de gas, el bióxido de carbono de la cerveza, que se dispersan en el líquido. Y el lector podrá ponerse a meditar sobre la enorme cantidad de estos sistemas que usamos cotidianamente: cremas de afeitar, shampoos, desodorantes, insecticidas, etc. Sobra, pues, insistir de nuevo en la importancia tecnológica de la ciencia de los coloides.
Si bien no todos los coloides nos pueden parecer muy exóticos, hay algunos que sí lo son. Empezaremos por mencionar un caso de todos más que conocido: el del jabón. Este material que utilizamos todos los días es un coloide que además, sobra decirlo, produce espuma. Pero quién en su niñez no gozó una propiedad extraordinaria de los jabones: jugar con una solución acuosa de ellos haciendo, mediante un arillo metálico, pompas de jabón. ¿Quiere el lector intentarlo otra vez? Una excelente composición para hacer pompas de jabón muy estables es la siguiente: mézclense 28.2 gramos ácido oleico que puede conseguirse con relativa facilidad, 100 mililitros de sosa cáustica (NaOH), 300 mililitros de glicerina y 1 200 mililitros de agua. El observar los bellos colores que por interferencia de la luz se forman en la película es por sí sola una buena razón para hacer el experimento, y también para comprobar que estas películas, por lo menos en cuanto a su colorido, son un tanto exóticas. Sin embargo las espumas, como en el caso de la cerveza, el jabón, la crema de afeitar, etc., no siempre son tan agradables ni deseables. ¡Imagínese el lector lo que pasaría en los cilindros del motor de su automóvil si al ponerlo a funcionar el aceite produjera espuma! Posiblemente su acción lubricante se vería mermada y el desgaste de las piezas aumentaría considerablemente. Así pues, en muchos casos semejantes ciertos agentes estabilizadores deben agregarse a un material para evitar la formación de espuma. En efecto, una descompostura frecuente de los motores es que debido al excesivo calentamiento se deforman algunas de las juntas entrando en contacto el agua del sistema de enfriamiento y el aceite del motor. ¡Así que goce Ud. de la espuma de su cerveza o de la espuma del jabón, pero tenga cuidado de poner el aceite adecuado al motor de su automóvil y de evitar el sobrecalentamiento!
Sin embargo, no todas las espumas son nocivas y vale la pena detenernos un momento para decir cómo se fabrican y mencionar algunos de sus usos más comunes. La forma más socorrida, y también la más cara, de generar una espuma es la que se observa al abrir una cerveza y verterla en un vaso, el método de los aerosoles. Está basado en la presencia de un líquido espumoso, agua por lo común, y un agente que induzca la formación de espuma, casi siempre un gas disuelto en el líquido a presión alta. En la cerveza y los refrescos gaseosos, el agente que induce la formación de espuma es el bióxido de carbono (CO2).
El agua se pone en presencia de una sustancia que tenga la propiedad de inducir un cambio energético favorable que aumente el área superficial, permitiendo así que las moléculas del agente espumante pasen por el líquido y formen la interfase gas-líquido característica de la espuma. A esta sustancia se le llama un surfactante, ya que se acumula en la superficie induciendo la formación de espuma. En otro método muy usado, el líquido espumoso y un gas se fuerzan a fluir a través de una columna empaquetada con obstáculos como bolitas de vidrio o de acero inoxidable. En la superficie de estos obstáculos se forman películas delgadas de líquido que el gas infla para formar burbujas. También se puede formar espumas de baja densidad usando generadores de aspiración de aire mecánicos o de otra índole. En los últimos, el líquido espumoso se rocía sobre una malla de metal perforado sobre la cual sopla un generador de aire, en tanto que en los primeros el flujo de aire requerido para hacer la espuma está inducido por el propio spray o rociador del líquido.
Para terminar esta breve introducción a las espumas, sólo diremos que uno de sus principales usos se encuentra en los extinguidores de incendios, que seguramente los lectores habrán observado muchas veces. La sabiduría popular dice mucho al respecto, pues los taxistas utilizan con frecuencia una "Coca-Cola" familiar como extinguidor. Los perforadores de pozos de petróleo y de gas saben que las espumas les son útiles de muchas maneras, por ejemplo para extraer agua o azufre de un pozo inyectándole un surfactante y extrayéndola como espuma o para penetrar en formas geológicas de baja presión mediante un principio y una técnica muy largas de explicar aquí y otros usos similares.
Regresemos ahora a nuestra exposición general sobre los coloides, de los cuales las espumas son sólo un caso particular. En general hay dos clases de coloides, los liófilos o amantes de solventes y los lifóbicos o repelentes de solventes. A los primeros se les suele llamar geles y a los segundos sols. Los coloides liofílicos son sustancias que ordinariamente son solubles y se forman permitiendo que el solvente permanezca en contacto con el material sólido. Tal es el caso de la gelatina en presencia de agua (¡un poco caliente!). Los coloides liofóbicos son insolubles, pero pueden "dispersarse" en el solvente usando métodos artificiales. Los ejemplos que dimos al inicio de éste capítulo, como algunas medicinas, pinturas, el azufre, etc., dan lugar a los sols. Por ejemplo, una solución de látex de hule se utiliza para formar artículos de hule espuma de formas complejas, como guantes de hule. Este proceso está basado fundamentalmente en la distribución que tienen las cargas eléctricas en las partículas que forman el coloide, las cuales, en presencia de campos eléctricos, exhiben migraciones muy específicas y complejas que inducen una cierta estabilidad a la suspensión coloidal, la cual permite "conformar" al coloide en un momento dado. El estudio de los gels y sols es de gran actualidad por la enorme importancia que tienen en una multitud de procesos industriales, muchos de ellos sugeridos por los ejemplos que hemos mencionado aquí. El lector interesado en el tema puede consultar alguna de las lecturas generales sugeridas en la bibliografía, o a un nivel más elevado, cualquier texto de fisicoquímica que tenga un capítulo intitulado "coloides".
Como ejemplo final de uno de los temas más sorprendentes hoy en día y cuyos
patrones son verdaderamente exóticos e inmensamente bellos, hacemos una digresión
sobre un fenómeno aparentemente muy simple, el mezclado de dos fluidos. Ya hablamos
de cierto tipo de mezclado en los párrafos anteriores, cuando estudiamos las
emulsiones. Ahora trataremos un fenómeno ligeramente diferente. Un buzo provisto
de un tanque con aire se sumerge en el agua de un lago de aguas tranquilas.
Al respirar expulsa aire en forma de burbujas que ascienden a través del agua.
Si hemos sido un poco curiosos y hemos tenido la ocasión de presenciar este
acto, quizá hayamos observado que las burbujas adoptan formas curiosas al combinarse
e interactuar entre ellas de manera un tanto compleja. Muy a menudo este fenómeno
es difícil de apreciar por la dificultad de observar las burbujas en tal circunstancia.
Este fenómeno fue estudiado con gran meticulosidad por el ingeniero naval inglés
Henry-S. Helen-Shaw en el siglo pasado.

El dispositivo un tanto ingenioso utilizado por este investigador —el llamado
celda de Hele-Shaw— consiste de dos placas paralelas, transparentes y separadas
por una distancia muy pequeña, casi una rendija, y con un separador que corre
a lo largo de las orillas de las placas para mantenerlas separadas y evitar
la fuga del líquido entre ellas, que, usualmente, es muy viscoso, como la glicerina,
y puede ser bombeado hacia adentro o hacia afuera del espacio entre las placas
por una jeringa o una bomba pequeña. Si ahora se inyecta un fluido menos viscoso
como el aire, en el centro de uno de los extremos al espacio abierto, la glicerina
sufre un desplazamiento un tanto curioso. Se forma una burbuja de aire que,
con el tiempo, germina en una serie de "dedos" o extremos protuberantes, efecto
que se conoce como digitación viscosa (Figura 13).
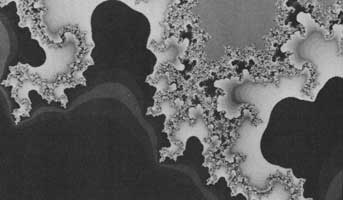
Figura 13. Digitación viscosa.
El fenómeno de la digitación viscosa tiene actualmente enorme importancia, no sólo tecnológica sino también científica. Respecto a la primera podemos citar varios ejemplos. Para los geólogos y los ingenieros petroleros es bien conocido el problema de extraer el crudo almacenado en yacimientos formados por rocas porosas, en donde cada pozo funciona más o menos como una celda de Hele-Shaw. Al inyectar agua, vapor u otro líquido no miscible, de menor densidad, el agua desplaza, en principio, al petróleo hacia la superficie y la eficiencia de la extracción depende en gran medida de la digitación viscosa. En efecto, si la presión es alta, entre otras cosas se forman grandes "dedos" de agua dentro del petróleo, lo cual hace que éste salga en menor proporción y, además, mezclado con agua. De ahí que el conocimiento de los detalles de la digitación viscosa sea importante para el proceso. Los primeros experimentos sobre este fenómeno, en el caso de aceite y agua, fueron realizados hace poco más de treinta años en Inglaterra, por Geoffrey I. Taylor y P.G. Saffman, y siguen siendo motivo de estudio.
En otras áreas de la ingeniería ocurren efectos muy similares, sobre todo en
aquellas en las cuales el concepto de mezcla tiene conotaciones vagas. En ingeniería
química, por ejemplo, se confía mucho en que un mezclado efectivo permita que
varias sustancias reaccionen químicamente entre sí de manera eficiente para
que los productos, cualesquiera que éstos sean, exhiban las propiedades deseadas.
Sabemos o creemos saber que la mezcla de café con crema es relativamente simple,
pues produce un líquido aparentemente sencillo, de color uniforme. Esto es en
general cierto cuando agitamos con una cuchara, pero inténtelo el lector con
dos líquidos más viscosos, por ejemplo dos tipos de pinturas vinílicas, y ¡oh
sorpresa!, el mezclado ni es tan uniforme ni tan simple. Podemos inclusive plantear
la pregunta sobre lo que diferentes investigadores entienden por mezclar: los
oceanógrafos y geofísicos usan el término revolver, que tiene la connotación
de homogeneidad; en la ingeniería de polímeros se usa la expresión combinar
y muchos ingenieros recurren al término agitar. Todos aparentan ser sinónimos,
mas un poco de reflexión nos hace ver que no es el caso. En la figura 14 vemos
rastros característicos de un mezclado de fluidos viscosos en una roca magnética
que contiene dos magmas diferentes y que en realidad es una revoltura y no una
mezcla homogénea.

Figura 14. Mezclado en una roca magnética con dos magmas diferentes.
(foto Jorge Ludiyán, UAM-I).
La combinación de dos polímeros o fluidos viscoelásticos resulta en patrones
como los ejemplificados en la figura 15, que es una combinación de estireno
con polibutadieno. A estos compuestos se les llama hoy en día compositos y sus
propiedades son un tanto versátiles como se muestra en las figuras 16 y 17.
En estos casos agitar, como en el ejemplo del café con crema y las pinturas
vinílicas, no conduce necesariamente a un resultado final unívoco.
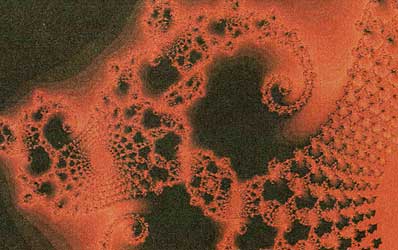
Figura 15. Combinación de dos polímeros. Contribución del Laboratorio de Investigación y Desarrollo de Industrias Negromex S.A. Foto: Víctor Castaño.
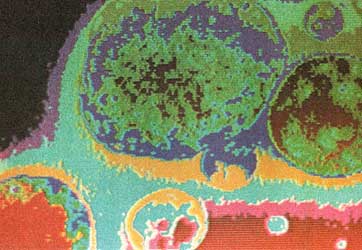
Figura 16. Ejemplo de composito. Contribución del Laboratorio de Investigación y Desarrollo de Industrias Negromex S.A. Foto: Víctor Castaño.

Figura 17. Ejemplo de composito. Contribución del Laboratorio de Investigación y Desarrollo de Industrias Negromex S.A. Foto: Víctor Castaño.
Pero, ¿qué tiene de exótico el mezclado? La respuesta aún no satisfactoria,
está ligada al concepto de "movimiento" en un fluido, según fue concebido por
vez primera por el famoso matemático suizo Leonardo Euler. El movimiento de
un fluido es la concepción matemática que expresa en qué punto del espacio se
encontrará una "partícula" de un fluido después de transcurrido un cierto intervalo
de tiempo. Así, si pudiéramos conocer este movimiento para un flujo dado, por
ejemplo un flujo lento en un canal estrecho, conoceríamos en principio todo
lo que es necesario conocer acerca del "mezclado" que este flujo produce. En
los pocos casos en que este proceso se ha podido estudiar, con el uso de poderosas
computadoras, se ha podido exhibir dos características un tanto singulares:
el proceso de mezclado es un fenómeno no lineal y segundo, está íntimamente
conectado con dos conceptos que desempeñan un papel determinante en la descripción
de fenómenos no lineales. El primero es el concepto geométrico denominado fractal
y el segundo un concepto estrictamente dinámico al que hoy nos referimos como
caos. ¡Y ambos exhiben patrones "exóticos"! El tema central de este capítulo
no versa sobre ellos, de hecho necesitaríamos todo el espacio de un tomo
de esta serie para hacerlo, mas para que el lector se forme una idea de ellos,
en la figura 18 ilustramos un fractal, producido por simulación en una computadora,
del proceso de digitación viscosa formado por la propagación de una gota de
aire en glicerina.
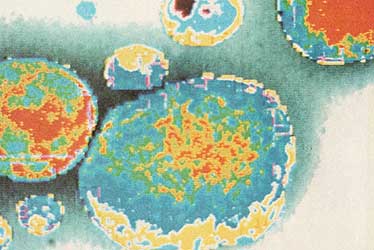
Figura 18. Ejemplo de fractal. Contribución del Laboratorio de Investigación y Desarrollo de Industrias Negromex S.A. Foto: Víctor Castaño.
En la figura 19 mostramos el patrón de un flujo turbulento (caótico) que, como se aprecia, genera estructuras un tanto caprichosas. Este flujo puede concebirse como estructuras fractales superpuestas que incluyen el concepto de remolinos.

Figura 19. Patrón de un flujo turbulento.
Aunque hoy se tiene la tendencia de afirmar que los fractales y el caos forman o integran una nueva ciencia, el lector debe ser muy precavido. Los primeros son estrictamente entes geométricos de estructura caprichosa, "exótica", cuyas propiedades han servido para imitar, sobre todo con base en simulaciones con computadoras, una variedad enorme de formas naturales, como copos de nieve, perfiles de costas, depósitos de metales en electrodos, descargas eléctricas, etc., pero carecen de contenido físico. Por otra parte, el caos es un fenómeno que se ha detectado desde hace más de cien años y se origina en las propiedades de las soluciones de ecuaciones diferenciales de sistemas dinámicos bien conocidos, y que surgen de las condiciones matemáticas impuestas o requeridas en la obtención de dichas soluciones; o bien, provienen de efectos no lineales que aparecen en ellas debido a las características intrínsecas del fenómeno en cuestión.