IV. L═QUIDOS SOBREENFRIADOS Y VIDRIOS
LA LECTURA del título de este capítulo habrá dado ya al lector por lo menos tres ideas en qué pensar. Primero, qué tiene de extraño o exótico un líquido sobreenfriado. Segundo, qué relación existe, si es que hay alguna, entre un líquido y un vidrio, pues de nuestra experiencia en la vida cotidiana sabemos que los vidrios se asemejan mucho más a los sólidos. Y tercero, qué relación existe entre dos fases de la materia en apariencia tan disímbolas entre sí, los líquidos sobreenfriados y los vidrios, ¡lo único exótico parece ser la asociación de ideas! Veamos.
Pensemos en un líquido ordinario, como el agua. A temperatura ambiente y presión atmosférica normales, el agua es un líquido y si a la misma presión disminuimos su temperatura, digamos enfriándola, el agua se solidifica a 4░C para formar hielo. Este fenómeno nos es más o menos conocido y no es remoto que extrapolemos lo que observamos en el agua a otros líquidos conocidos de manera de hacernos a la idea de que todo líquido al enfriarse solidifica. Pues bien, éste no es el caso. Si volvemos al agua y llevamos a cabo el enfriamiento en condiciones extremas de cuidado y pureza, esto es, evitando vibraciones o movimientos bruscos del recipiente que la contenga, cuidamos que no le caiga polvo o basura, enfriamos lentamente, etc., podemos pasar por debajo de 4░C y el agua continuara siendo líquida. Sin embargo, una vez que hemos sobrepasado la temperatura normal de congelación, cualquier perturbación, por pequeña que sea, rápidamente inducirá la transición al sólido. El agua se convertirá en hielo.
En todo ese intervalo de valores de la temperatura, menor cada uno de ellos a la temperatura de congelación, en el que el agua subsiste como un líquido, decimos que es un líquido sobreenfriado. Todo líquido ordinario, si se hace con cuidado, puede sobreenfriarse hasta un cierto grado. Esto es, existe una temperatura máxima más allá de la cual ya no es posible sobreenfriar al líquido y éste, inevitablemente se solidificará. Lo verdaderamente exótico de algunos líquidos es que pueden sobreenfriarse a temperaturas muy bajas y, aunque no aparentan solidificarse, exhiben un fenómeno verdaderamente curioso. En efecto, su viscosidad empieza a aumentar violentamente a medida que la temperatura disminuye y así alcanzar una consistencia tal que "su endurecimiento" los hace aparecer como sólidos, pero en realidad, al radiografiarlos con rayos X, se ve que tienen prácticamente la misma estructura atómica que un líquido. Decimos entonces que el líquido ha pasado a formar un estado vítreo o, en términos más corrientes, que se ha formado un vidrio.
Un ejemplo típico de este comportamiento se puede ver en el glicerol, mejor
conocido como glicerina, que a la temperatura ambiente es un líquido espeso
incoloro y de agradable sabor dulzón. Si se toma un poco de este líquido y se
enfría sin mayores cuidados, cristaliza como lo hace cualquier líquido. Pero
si el proceso de enfriamiento se lleva a cabo con los cuidados necesarios, la
glicerina puede enfriarse hasta temperaturas cercanas a 5 K
3![]() sin que se aprecie la formación de cristales. Es un líquido típico que puede
sobreenfriarse de manera, digamos así, espectacular. Y lo espectacular consiste
en que debajo de una cierta temperatura, aproximadamente igual a 180 K, las
propiedades de la glicerina son muy parecidas a las de un sólido, excepto su
radiografía con rayos X que muestra su similitud con el líquido. Decimos entonces
que, debajo de dicha temperatura, tenemos un vidrio.
sin que se aprecie la formación de cristales. Es un líquido típico que puede
sobreenfriarse de manera, digamos así, espectacular. Y lo espectacular consiste
en que debajo de una cierta temperatura, aproximadamente igual a 180 K, las
propiedades de la glicerina son muy parecidas a las de un sólido, excepto su
radiografía con rayos X que muestra su similitud con el líquido. Decimos entonces
que, debajo de dicha temperatura, tenemos un vidrio.
Así como la glicerina, otras sustancias como el propilenglicol 4![]() ,
la glucosa, el hule, etc., cuando se enfrían, llegan a formar vidrios. Pero
no todos los vidrios que conocemos se forman a partir de líquidos sobreenfriados
a bajas temperaturas. Los vidrios que usamos y vemos en la vida diaria están
formados de óxidos metálicos, siendo el de silicio (sílice) o vidrio de arena
el más común ¡y tienen que sobreenfriarse a más de 1 000 K! Pero además existen
los vidrios poliméricos, los cuales, como su nombre lo indica, están formados
a partir de polímeros, otros materiales exóticos que ya hemos mencionado. ¿Qué
es entonces un vidrio? ¿Y cuál es su conexión concreta con un líquido sobreenfriado?
Vamos a intentar responder primero la segunda pregunta para después abordar
la primera de manera más general.
,
la glucosa, el hule, etc., cuando se enfrían, llegan a formar vidrios. Pero
no todos los vidrios que conocemos se forman a partir de líquidos sobreenfriados
a bajas temperaturas. Los vidrios que usamos y vemos en la vida diaria están
formados de óxidos metálicos, siendo el de silicio (sílice) o vidrio de arena
el más común ¡y tienen que sobreenfriarse a más de 1 000 K! Pero además existen
los vidrios poliméricos, los cuales, como su nombre lo indica, están formados
a partir de polímeros, otros materiales exóticos que ya hemos mencionado. ¿Qué
es entonces un vidrio? ¿Y cuál es su conexión concreta con un líquido sobreenfriado?
Vamos a intentar responder primero la segunda pregunta para después abordar
la primera de manera más general.
Para responder a la segunda pregunta volvamos a los experimentos que hemos esbozado en los primeros párrafos del capítulo. Cuando un líquido se enfría, se convierte en un sólido cristalino, esto es, cristaliza. Cuando un líquido se enfría de manera que se pueda sobrellevarlo como un líquido sobreenfriado, no cristaliza. Se convierte, a una cierta temperatura, en un material con la apariencia de sólido pero que en realidad posee la estructura de un líquido. A esta fase la hemos llamados un vidrio. Si hacemos la radiografía de ambas fases, el sólido cristalino proyectará una estructura regular, ordenada, que en muchos casos, como el de varias sales de metales comunes, sodio, cobre, plata, etc., se percibe aún en su forma macroscópica, esto es, a simple vista.
Un cristal de cloruro de sodio (sal de cocina) bien cristalizado es casi un cubo perfecto. En cambio, el vidrio proyecta un orden que rápidamente se desvanece a medida que observamos distancias de unas cuantas veces las distancias interatómicas. Y esto es lo que se observa en los líquidos. El vidrio, entre otros materiales que tienen propiedades similares, es lo que se conoce como un sólido amorfo. Pero podría uno preguntarse si hay otras maneras de percibir estas diferencias a través de mediciones que se llevan a cabo en el laboratorio. Y la respuesta es sí.
Además, son éstas las mediciones no sólo más comunes, sino también las que arrojan información mucho más cuantitativa. Entre ellas, una de las más socorridas es la que examina el comportamiento de la propiedad conocida como calor específico de una sustancia cuando se varía la temperatura. Como es bien sabido, el calor específico es aquella propiedad de todo sistema que mide su inercia térmica. Así como la masa de un cuerpo es la medida de la resistencia que opone dicho cuerpo a que su estado de reposo o movimiento se altere debido a la acción de una fuerza externa, el calor específico es la resistencia que presenta una unidad de masa de un cuerpo cualquiera a que su temperatura se vea afectada cuando le suministramos energía. En esta forma, cuando leemos que una sustancia como el agua tiene un calor específico de una caloría por gramo y grado centígrado, lo que estamos diciendo es que por cada gramo de agua tenemos que suministrar una caloría de energía para elevar su temperatura un grado centígrado. En general, el calor específico de la mayoría de las sustancias —con excepción de los gases monatómicos helio, neón, etc.—, es una función de la temperatura, esto es, la inercia térmica depende de la temperatura del cuerpo y en algunos casos hasta de su densidad. Por otra parte, la teoría cinética de la materia permite establecer una correlación entre el calor específico de un material con las características más sobresalientes de su estructura atómica o molecular, según sea el caso. El conocimiento experimental de esta propiedad es, pues, una forma directa de corroborar las hipótesis en que se basan los modelos microscópicos.
Cuando se estudian los modelos microscópicos de los sólidos cristalinos se puede pensar en las vibraciones de los iones pesados alrededor de sus posiciones de equilibrio —como si fueran resortes— y también el movimiento de los electrones libres a través de la red cristalina. Estos fenómenos constituyen las dos grandes contribuciones microscópicas al calor específico del sólido. Los cálculos teóricos que surgen de este modelo concuerdan satisfactoriamente con el experimento. Si comparamos entonces el comportamiento del calor específico de un sólido cristalino con el de un líquido sobreenfriado en su fase vítrea o amorfa, podemos averiguar mucho sobre la estructura del segundo. Estas mediciones se han llevado a cabo por años en varios laboratorios del mundo, corroborando unos los resultados de otros y el comportamiento general se muestra, para el caso del glicerol, en la figura 33. La curva inferior representa el calor específico de la glicerina cristalizada. La curva superior, sobre todo, el intervalo contenido entre las temperaturas de congelación Tcongel y la de transición Tg muestra su comportamiento como un líquido sobreenfriado. Lo sorprendente es que debajo de Tg ~ 178 K, el comportamiento del calor específico para el vidrio y el sólido cristalino es prácticamente igual. Si quisiéramos dibujar las dos curvas casi se encimarían una sobre otra, como de hecho se indica en la figura. Y, sin embargo, este "casi" empleado en la frase anterior es aquí determinante.
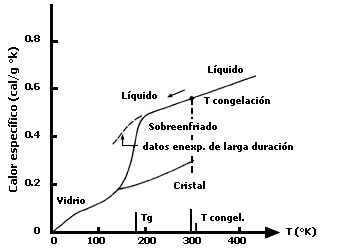
Figura 33. Los calores específicos del glicerol cristalino y el sobreenfriado.
Conocido el calor específico de una sustancia como función de la temperatura, resulta relativamente fácil obtener, de acuerdo con las leyes de la termostática, la propiedad llamada entropía. Resulta que esta función, como se ha explicado en otro volumen de esta serie, es una medida de la falta de organización de un sistema dado a nivel molecular. Siendo los sólidos cristalinos los sistemas más organizados, su entropía es menor que la del líquido correspondiente, la cual a su vez es menor que la del gas. De esta manera, si usamos la pequeña diferencia que existe entre los dos calores específicos, del sólido y del vidrio, para calcular sus respectivas entropías y las comparamos entre sí, podemos saber si uno está más o menos organizado que el otro. El resultado de este cálculo es espectacular y se muestra en la figura 34.
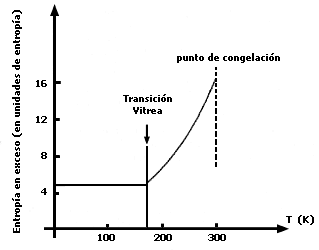
Figura 34. La línea sólida representa la cantidad por la cual la entropía de la glicerina sobreenfriada excede la de la glicerina cristalizada, de acuerdo con los resultados de la figura 33 (1 unidad de entropía = 1 cal /mol░ K).
En las ordenadas se ha graficado la entropía en exceso del vidrio con respecto
al sólido. Nótese que de ser sistemas igualmente organizados, este exceso sería
igual a cero. En las abscisas se grafica la temperatura ¡Debajo de 178 K el
vidrio tiene una entropía en exceso respecto a la del cristal que es casi constante
y aproximadamente igual a cinco unidades! 5![]() Así pues, concluimos que el vidrio tiene que ser un estado mucho más desorganizado
que el sólido y esto concuerda, naturalmente, con los resultados obtenidos con
las radiografías hechas por medio de rayos X. El vidrio, entonces, se asemeja
más a un líquido que a un sólido.
Así pues, concluimos que el vidrio tiene que ser un estado mucho más desorganizado
que el sólido y esto concuerda, naturalmente, con los resultados obtenidos con
las radiografías hechas por medio de rayos X. El vidrio, entonces, se asemeja
más a un líquido que a un sólido.
Estos resultados dan al lector una imagen de la conexión que buscamos entre la existencia de los vidrios y los líquidos sobreenfriados. Si tomamos como prototipo de estas sustancias a la glicerina, los resultados mostrados en las figuras nos dicen que los vidrios, en general, se forman a partir de toda una clase de sustancias que sean capaces de sobreenfriarse con relativa facilidad. Aunque el proceso no es tan simple como el aquí ejemplificado, porque las temperaturas son considerablemente mayores, los vidrios ordinarios también se forman al enfriar materiales inorgánicos (sales) a base de silicio (silicatos), de su fase líquida a la temperatura ambiente. Este mismo fenómeno fue descubierto hace apenas un par de décadas en las aleaciones metálicas. Éstas consisten generalmente de un metal noble o de transición y un metaloide (boro, carbono, silicio, fósforo, etc.). Los vidrios metálicos, llegan a tener propiedades sorprendentes. Por ejemplo, al contrario de los vidrios ordinarios, son buenos conductores eléctricos; también son maleables. Sus aplicaciones tecnológicas han sido considerables.
Ahora que más o menos tenemos una idea cualitativa de que un vidrio es el estado
amorfo que se obtiene a partir de un líquido sobreenfriado de muy alta viscosidad,
podemos pasar a la primera pregunta, y refrasear ésta en términos de cómo está
constituido un sólido amorfo. Mas para no salirnos de la tónica específica del
capítulo nos concentraremos en los vidrios, primero en su aspecto macroscópico.
En 1903, el químico alemán Gustavo Tammann hizo notar que no cualquier líquido
sobreenfriado forma un vidrio. Se requiere que a medida que nos aproximemos
a la temperatura de la transición vitrea su viscosidad sea considerablemente
mayor que la del agua. Veamos qué tanto mayor. A 20░C el agua tiene una viscosidad
de 10-2 poises
6![]() .
Según Tammann, para que un líquido sobreenfriado forme un vidrio su viscosidad
debe alcanzar valores entre 1012 y 1013 poises, esto es,
¡debe ser más de un billón de veces más viscoso que el agua! la condición de
Tammann puede entenderse si se emplea un modelo muy gráfico ideado por J.C.
Maxwell para distinguir entre el comportamiento de un sólido y el de
un líquido. Si tomamos un sólido cristalino y lo sometemos a un esfuerzo elástico
("lo jalamos"), aparece una deformación llamada deformación cortante. La relación
entre el esfuerzo y la deformación, si la primera no es muy grande, se conoce
como el módulo de deformación. Si a un líquido lo sometemos también a un esfuerzo
cortante, éste no se deforma, sino que fluye uniformemente con una rapidez que
depende de su viscosidad. De aquí que a Maxwell se le ocurrió sugerir que la
existencia de un flujo viscoso para un líquido cualquiera puede interpretarse
como el rompimiento continuo de la deformación elástica. De esta manera, si
en cualquier material ambos efectos están presentes, su importancia relativa
puede determinarse si se calcula la magnitud del cociente entre el módulo de
deformación y la viscosidad. Y es un resultado inmediato del análisis dimensional
mostrar que si ambas cantidades se expresan en unidades c.g.s., el cociente
tiene dimensiones de tiempo ie, se mide en segundos.
.
Según Tammann, para que un líquido sobreenfriado forme un vidrio su viscosidad
debe alcanzar valores entre 1012 y 1013 poises, esto es,
¡debe ser más de un billón de veces más viscoso que el agua! la condición de
Tammann puede entenderse si se emplea un modelo muy gráfico ideado por J.C.
Maxwell para distinguir entre el comportamiento de un sólido y el de
un líquido. Si tomamos un sólido cristalino y lo sometemos a un esfuerzo elástico
("lo jalamos"), aparece una deformación llamada deformación cortante. La relación
entre el esfuerzo y la deformación, si la primera no es muy grande, se conoce
como el módulo de deformación. Si a un líquido lo sometemos también a un esfuerzo
cortante, éste no se deforma, sino que fluye uniformemente con una rapidez que
depende de su viscosidad. De aquí que a Maxwell se le ocurrió sugerir que la
existencia de un flujo viscoso para un líquido cualquiera puede interpretarse
como el rompimiento continuo de la deformación elástica. De esta manera, si
en cualquier material ambos efectos están presentes, su importancia relativa
puede determinarse si se calcula la magnitud del cociente entre el módulo de
deformación y la viscosidad. Y es un resultado inmediato del análisis dimensional
mostrar que si ambas cantidades se expresan en unidades c.g.s., el cociente
tiene dimensiones de tiempo ie, se mide en segundos.
Para un líquido común y corriente, e independientemente de su temperatura, el módulo de deformación es del orden de magnitud de 10-11 unidades c.g.s. La viscosidad de estos líquidos, como el agua, es de 10-2 unidades c.g.s. (poises) luego el cociente 10-2 / 10-11 es de 10-13 segundos. Esto quiere decir que si aplicamos un esfuerzo cortante al agua, la deformación elástica "se rompe" o cede a los 10-13 seg (¡casi instantáneamente!) y el líquido fluye. Pero en el caso de un líquido sobreenfriado muy viscoso, la viscosidad será de 10+13 poises y entonces 1013 / 1011 = 100 seg ¡el rompimiento elástico ocurre al cabo de casi dos minutos, y si la viscosidad sigue aumentando a medida que la temperatura disminuye, este tiempo puede ser mayor. Físicamente, Tammann nos dice que los cambios en la configuración molecular de estos líquidos, cuando se someten a esfuerzos externos, pueden ser tan lentos como la duración misma del experimento y este "congelamiento" de la estructura molecular es precisamente lo que caracteriza al vidrio. Nunca tienen tiempo de alcanzar su configuración estable como sólidos cristalinos y permanecen en una fase muy semejante a la del líquido, pero con las moléculas inmovilizadas por los efectos de tan alta viscosidad. Piense el lector en un trozo de hule y tendrá una representación gráfica de esta idea. Algunos vidrios, como los magníficos emplomados de las catedrales góticas, se estima tomarán algunos miles de años en cristalizar. Al hacerlo, el vidrio se transformará en un sólido cristalino y se romperá, como los parabrisas de los automóviles, aparentemente sin razón alguna. Este proceso puede acelerarse por la acción de un agente externo que provoque esfuerzos considerables como un golpe, cambios de temperatura, etcétera.
Todas estas ideas, aparentemente esotéricas, pueden tener una influencia notable en la tecnología y fabricación de un vidrio ordinario. Si por ejemplo se toma un vidrio y su temperatura se eleva mucho más allá de la temperatura de transición, los cambios de su configuración molecular pueden llevarse a cabo con mucha mayor rapidez y siempre existe el peligro de que la cristalización ocurra. A este proceso en los vidrios se le conoce como vitrificación. Si esto sucede se estropea el vidrio. Un soplador de vidrio experimentado lo sabe y por tanto nunca mantiene el vidrio sobre la flama por mucho tiempo. Si lo hace, el vidrio devitifrica y una pléyade de pequeños cristales aparece en el vidrio dándole la apariencia de material opaco y congelado ¿le suena familiar al lector cuando piensa en muchas piezas de vidrio, como el de Mascarones, que se venden en los mercados? El vidrio devitrificado tiene una dureza mecánica muy reducida, por lo que puede llegar a ser inservible.
Lo más excitante del estudio de los vidrios es que, a pesar de que el hombre los ha trabajado por más de 4 000 años, y ha dominado completamente su tecnología, muy poco sabemos de ellos desde el punto de vista científico. Todos nos hemos maravillado de ver verdaderas obras de arte hechas de un sinnúmero de materiales vítreos, desde las copas para vino más finas y delicadas hasta las pesadas piezas de cristal cortado. Y sin embargo apenas estamos aprendiendo a conocer algo sobre los importantes procesos que ocurren durante la formación del vidrio. Por ejemplo, la temperatura de la transición vítrea no está definida unívocamente. Su valor depende del proceso mismo de enfriamiento y de otras variables como la presión, los esfuerzos cortantes a que está sometido el material, su grado de pureza, etcétera.
¿Cuáles son los aspectos más notables del comportamiento de las moléculas en un líquido muy viscoso que al sobreenfriarse forma un vidrio? ¿Y cómo clasificar estos diferentes aspectos para jerarquizarlos por su importancia en la formación del vidrio? ¿De qué manera dependen las "cualidades" de un vidrio de estos aspectos? Estas y muchas otras preguntas más, igualmente interesante e importantes, siguen siendo todavía una gran incógnita. El día que las lleguemos a responder no sólo habremos aprendido algo más de los líquidos exóticos que aparecen en la naturaleza sino que también podremos hablar de una tecnología sumamente importante, basada ahora en principios científicos.