VI. SUPERFLUIDEZ
Los fenómenos que exhibe la materia a temperaturas bajas, es decir, a temperaturas cercanas al cero absoluto (-273.2° C), son numerosos y diversos. A estas temperaturas las propiedades térmicas, eléctricas y magnéticas de muchas sustancias experimentan grandes cambios y, ciertamente, el comportamiento de la materia puede parecer extraño y exótico en comparación con el que muestra a temperaturas ordinarias. Sin duda, entre estos fenómenos los dos más extraordinarios e importantes son la superconductividad y la superfluidez. El primero ya lo hemos tratado en el capítulo anterior, en este capítulo examinaremos el segundo. Pero antes de decir en qué consiste y qué propiedades tiene la superfluidez, describiremos someramente las principales características del primer actor en este fenómeno: el elemento helio.
Después del hidrógeno, el helio es el elemento más ligero, tanto, que siempre tiende a subir a las capas superiores de la atmósfera, lo cual implica que cerca de la superficie terrestre prácticamente es inexistente. El aire ordinario únicamente contiene alrededor de cinco partes de helio por millón de partes de aire. Pero si el helio es escaso en la atmósfera, aún lo es más en la corteza terrestre, la cual sólo contiene, aproximadamente, ¡ocho partes por mil millones! Además, como el helio forma muy pocos compuestos químicos, rara vez se le encuentra combinado con otros elementos en líquidos o sólidos. Y, sin embargo, a pesar de ser tan escaso en la Tierra, abunda en el Universo del cual constituye el 23% de su masa.
Precisamente debido a su escasez natural en la Tierra el helio fue descubierto por primera vez en el Sol. La evidencia inicial de su existencia se produjo al analizar la luz emitida por el Sol durante un eclipse solar de 1868. Se detectaron ciertas líneas espectrales en la región amarilla del espectro, las cuales se identificaron, tres años más tarde, como producidas por un nuevo elemento al que se llamo helio, que en griego significa Sol. No obstante, a pesar de ser tan escaso y de las enormes dificultades que supuso su licuefacción, el helio ha sido el líquido más estudiado después del agua.
El núcleo del átomo de helio contiene dos protones, es decir, su número atómico es dos, pero puede contener de uno a seis neutrones, hecho que da lugar a la existencia de seis diferentes isótopos del helio. Al número de protones y neutrones del núcleo se le llama número de masa, de modo que este número, en los isótopos del helio, varía entre 3 y 8. Sin embargo, sólo los isótopos con números de masa 3 y 4 son estables, los restantes son inestables lo que significa que sus núcleos son radiactivos, emiten partículas, y al hacerlo se convierten rápidamente en otros elementos. El isótopo helio-4 (4He) es, relativamente, mucho más abundante que el helio-3 (3He), tanto en la atmósfera como en la corteza terrestre.
El helio tiene propiedades a la vez extrañas y fascinantes. Por ejemplo, su comportamiento frente a los cambios de temperatura es completamente diferente al de los demás elementos. En efecto, observamos repetidamente que si la temperatura de un gas se reduce de manera tal que su presión se mantenga siempre igual a la presión atmosférica durante este proceso de enfriamiento, entonces el gas se convierte en líquido. Más aún, si el líquido continúa enfriándose se convierte finalmente en sólido. Esta secuencia de transformaciones o cambios de fase ha sido bien establecida experimentalmente y ha hecho posible la licuefacción de muchos gases y la solidificación de los correspondientes líquidos. Al respecto ha sido necesario inventar y desarrollar nuevos métodos y técnicas de refrigeración a fin de producir las temperaturas cada vez más bajas necesarias para licuar los diferentes gases. Una breve relación de las etapas de esta jornada hacia las bajas temperaturas se muestra en la tabla 2, en la que se indica el logro obtenido y la temperatura alcanzable en cada etapa hasta 1960. Ahora bien, el helio no sigue la secuencia de cambios que acabamos de describir, es una excepción a la regla. Se observa, en cambio, que si la presión se mantiene igual a la presión atmosférica ambiente, el gas helio se licua a 4.2 K. pero no se convierte en sólido sin importar cuánto se disminuya su temperatura. En otras palabras, si bajo estas condiciones fuera posible alcanzar el cero absoluto, observaríamos que el helio nunca se congela, que siempre permanece en su fase líquida. Esta es su propiedad más importante pues, como veremos, da lugar a la superfluidez y a otros efectos espectaculares asociados a ella.
ABLA 2. La jornada de cien años hacia el cero absoluto
|
|
||||
|
Fecha
|
Investigador
|
País
|
Desarrollo
|
Temp. °K
|
|
|
||||
|
1860
|
Kirk
|
Escocia
|
Primer paso hacia la refrigeración intensa:
|
|
|
alcanzó temperaturas inferiores al punto
|
||||
|
de congelación del Hg.
|
234.0
|
|||
|
1877
|
Cailletet
|
Francia
|
El primero en licuar oxígeno: usó el
proceso
|
|
|
de expansión regulada del recipiente
|
||||
|
de presión; obtuvo sólo una fina neblina.
|
90.2
|
|||
|
1884
|
Wroblewski
|
Polonia
|
Primeras medidas de propiedades a bajas
|
|
|
y Olzewski
|
temperaturas: usó pequeñas cantidades
|
|||
|
de N2 y O2
líquídos.
|
77.3
|
|||
|
1898
|
Dewar
|
Inglaterra
|
El primero en licuar hidrógeno : usó
el efecto
|
|
|
Joule-Thomson e intercambiador de calor
|
||||
|
a contracorriente.
|
20.4
|
|||
|
1908
|
Kamerlingh
|
Holanda
|
Primero en licuar helio: usó el mismo método
|
|
|
Onnes
|
que Dewar; inmediatamente disminuyó la
|
|||
|
presión sobre el líquido para llegar
a 1 K.
|
4.2
|
|||
|
1927
|
Simon
|
Alemania
|
Inventó el aparato licuador de helio: usó
|
|
|
e Inglaterra
|
expansión adiabática del recipiente
a presión
|
|||
|
con preenfriamiento con H2
líquido.
|
4.2
|
|||
|
1933
|
Giauque
|
EUA |
Primera desmanetización adiabática.El
|
|
|
y MacDougall
|
pricipio fue propuesto primero por
|
|||
|
Giauque y Debye en 1926.
|
0.25
|
|||
|
1934
|
Kapitza
|
Inglaterra
|
Inventó el aparato para licuar helio con
|
|
|
y
URSS |
máquina de expansión: hizo posible la
|
|||
|
licuación del helio sin preenfriamiento
|
||||
|
con H2 líquido.
|
4.2
|
|||
|
1946
|
Collins
|
EUA |
Inventó el aparato comercial para licuar
|
|
|
helio: usó máquinas de expansión
e
|
||||
|
intercambiadores de calor a contracorriente.
|
||||
|
1956
|
Simon
|
Inglaterra
|
Primeros experimentos de enfriamiento
|
|
|
y Kurti
|
nuclear: usaron desmategnización
|
|||
|
adiabática de la etapa nuclear de
|
||||
|
una sal paragmagnética.
|
10-5
|
|||
|
1960
|
Kurti
|
Inglaterra
|
Alcanzó la temperatura más baja hasta
la
|
|
|
fecha: métodos de enfriamiento nuclear y
|
||||
|
aparato recientemente perfeccionado.
|
10-6
|
|||
|
|
||||
La licuefacción del helio fue lograda por el gran físico holandés Heike Kamerlingh Onnes, el 10 de julio de 1908 en el Laboratorio de Bajas Temperaturas de la Universidad de Leyden, Holanda. Fue un gran logro, pues de hecho inició el desarrollo de la física y la ingenieria de bajas temperaturas o criogenia. Además, permitió al mismo Kamerlingh Onnes descubrir en el mismo año el fenómeno de la superconductividad, o flujo de electrones sin fricción que, como ya vimos en el capítulo anterior, implica la desaparición de la resistencia eléctrica de un metal. Pero, además de los nuevos fenómenos y las múltiples aplicaciones prácticas a que dio lugar el comportamiento singular del helio, es importante señalar que precisamente las características de tal comportamiento constituyen la primera indicación de que las propiedades del helio sólo podrían entenderse utilizando conceptos diferentes de los que hasta entonces se habían empleado para explicar las propiedades de otros líquidos menos exóticos. Pero, antes de discutir estos conceptos, describamos las propiedades sorprendentes e insólitas que exhibe el helio.
En el mismo Laboratorio de Bajas Temperaturas de Leyden, en 1932, los físicos holandeses W.H. Keesom y su hermana A.F. Keesom descubrieron que si después de licuar al helio se le enfría hasta 2.19 K. pero manteniendo su presión igual a la atmosférica, el isótopo helio-4 sufre una transición de fase, pero no a una fase sólida, sino a una nueva fase líquida. A esta transición de fase se le llama el punto lambda porque cuando se grafica el calor específico Cs, del helio, que representa la cantidad de calor necesario para elevar su temperatura un grado, contra la temperatura T, se encuentra que la curva se parece a la letra griega l, según se muestra en la figura 44.
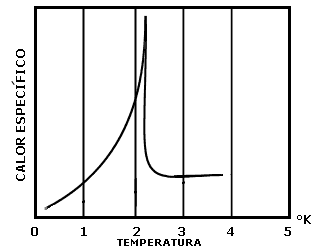
Figura 44. El punto lambda a 2.2 K marca la transición de helio líquido normal a superfluido. En este punto el calor específico decrece abruptamente.
A este nuevo estado se le llama helio-II, para distinguirlo del helio ordinario, helio-I, que existe a temperaturas superiores a 2.19 K. Para evitar confusiones resumamos la situación: el helio-4 puede hallarse en el estado líquido helio-I a temperaturas entre 4.2 K. y 2.19 K; a temperaturas inferiores alcanzará el nuevo estado líquido helio-II. Toda esta información puede expresarse de manera muy compacta y sencilla en términos del diagrama de fases del helio, mostrado en la figura 45, y que muestra cómo se comporta la presión en función de la temperatura e indica para qué valores de estas cantidades puede el helio exhibir sus fases gaseosa, líquida e inclusive sólida, pues efectivamente el helio puede solidificarse, pero únicamente a presiones mayores de 25 atmósferas. Con la restricción de mantener la presión igual a una atmósfera, como mencionamos antes, el diagrama indica que efectivamente el helio sólo puede ser líquido.
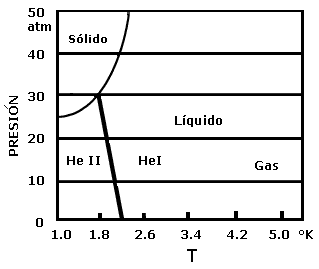
Figura 45. El diagrama de fases del helio.
En cambio, el isótopo helio-3 sólo puede existir en el estado líquido helio-I, al menos para temperaturas mayores de 0.1 K. Sin embargo, en 1972 se descubrió que el isótopo 3He tiene propiedades superfluidas a sólo unas milésimas de grado por encima del cero absoluto. Pero es el estado líquido helio-II el que muestra propiedades únicas.
Los hermanos Keesom y sus colaboradores también descubrieron en 1935 que el helio-II era un extraordinario conductor de calor: observaron que si un tubo capilar se llenaba con helio-II, ¡el calor se transportaba de un lado al otro del capilar 200 veces más rápido que en un alambre de cobre a la temperatura ambiente! Fue precisamente tratar de explicar esta sorprendente capacidad del helio para conducir calor lo que llevó al gran físico ruso P.L. Kapitza a descubrir la superfluidez en 1937, en el Instituto de Problemas Físicos de Moscú. Kapitza sospechaba que la extraordinaria conductividad térmica del helio-II no era la conductividad térmica ordinaria que se usa, por ejemplo, para describir la conducción de calor por un metal. Más bien, Kapitza creía que la gran conductividad del helio se debía a que el helio mismo se movía en el capilar, es decir, a que existía un flujo. Pero si esta conjetura era correcta, implicaba que el helio-II debía fluir con una extraordinaria facilidad y, por lo tanto, según hemos visto en capítulos anteriores, su viscosidad o resistencia interna al flujo sería forzosamente muy baja o nula. Es decir, que el helio-II debía ser un "superfluido". Para probarlo Kapitza realizó el experimento esquematizado en la figura 46, que muestra una pequeña rendija entre dos placas de vidrio sumergidas en un recipiente que contiene helio. El espesor de la rendija o "capilar" es pequeñísimo, aproximadamente de medio micrón, que es igual a la mitad de la millonésima parte de un metro.
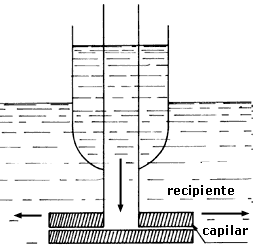
Figura 46. El experimento de Kapitza.
Kapitza observó que en el estado helio-I el helio no fluía a través del capilar, mientras que el helio-II pasaba por él rápidamente igualando los niveles del líquido en el tubo capilar y en el recipiente. Midiendo este tipo de efecto, Kapitza llegó a la sorprendente conclusión de que la viscosidad del helio-II era muy pequeña, menor que una diezmilésima de la viscosidad del hidrógeno gaseoso. Es decir, que para todo propósito práctico la viscosidad del helio-II es nula y por lo tanto se comporta como un fluido ideal. Para describir esta propiedad del helio-II, Kapitza acuñó el nombre de superfluidez.
Esta cualidad del helio-II de poder encontrarse en sitios en donde el helio-I no puede estar, produce otros efectos espectaculares. Uno de ellos es el efecto fuente, que se produce, por ejemplo, con un dispositivo como el mostrado en la figura 47. Inicialmente el recipiente sólo contiene helio-II y el tubo consta de un tapón poroso de algodón en uno de sus extremos que desempeña el papel de un capilar, es decir, impedirá que el helio-I penetre al tubo cuando esta fase exista en el recipiente pero, como ya hemos visto, permite sin dificultad el paso de helio-II. Si ahora calentamos el interior del tubo haciendo circular una corriente eléctrica por la resistencia, pero de manera que la temperatura en el interior ascienda sólo ligeramente por encima de 2.19 K, entonces el helio-II dentro del tubo se convertirá en helio-I. Pero como el helio-II puede penetrar al tubo libremente y se comporta como si el helio-I no estuviera presente, más y más helio-II se convierte en helio-I hasta que éste no tiene más remedio que escapar por la boquilla superior del tubo produciendo una fuente. Nótese que este efecto en realidad es equivalente a operar una bomba sin partes móviles a temperaturas muy bajas.
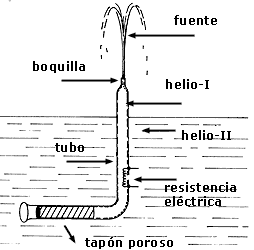
Figura 47. El efecto fuente producido por el helio superfluido.
Otra consecuencia de la superfluidez del helio es el efecto de reptación, que consiste en que una película muy delgada de helio puede escalar las paredes del recipiente que lo contiene en aparente desafío a las leyes de la gravedad. Si tomamos un tubo de ensayo vacío pero enfriado a una temperatura inferior a 2.19 K, y lo sumergimos parcialmente en un recipiente que contiene helio-II, observaremos que el helio trepa por las paredes exteriores del tubo y penetra en él hasta que el nivel de helio-II dentro es igual al nivel del recipiente (Figura 48 (a)). Pero también ocurre el efecto inverso, a saber, si ahora se eleva el tubo de manera que esté fuera del recipiente, el helio reptará en sentido inverso escalando las paredes interiores, saldrá del tubo reptando por sus paredes exteriores hasta llegar al extremo inferior del tubo desde donde goteará al recipiente (Figuras 48 (b) y (c)). Ahora bien, cualquier fluido que moja una superficie forma una película delgada, pero en el caso de los fluidos ordinarios su viscosidad es tal que la película se forma lentamente y fluye muy poco. En cambio con el helio-II la película se forma muy rápido y, como su viscosidad es nula, se mueve rápidamente. Se comporta más o menos como un sifón a lo largo del cual fluye el helio. La velocidad de flujo puede llegar a ser considerable, de 30 cm o más por segundo. Como es de imaginarse, este efecto causa problemas al diseñar recipientes para almacenar helio-II (criostatos), pues el líquido escala las paredes y ¡se escapa!
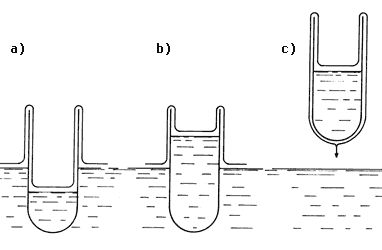
Figura 48. Película superfluida reptante.
Al tratar de comprobar su conjetura de que el transporte de calor del helio-II ocurría mediante el movimiento o flujo del helio mismo, Kapitza observó otro fenómeno desconcertante. Colocó una pequeña veleta cerca de la abertura de un tubo de ensayo de modo que cualquier flujo hacia el exterior del tubo sería fácilmente detectable y medible en términos de la desviación experimentada por la veleta. Llenó el tubo con helio-II y lo calentó e iluminó. Observó que la veleta se desviaba de su posición inicial indicando la presencia de un flujo saliente. Esto demostraba que el transporte de calor sí implicaba un flujo del helio, pero lo desconcertante y paradójico fue que a pesar de existir un flujo hacia el exterior, ¡el tubo no se vaciaba y permanecía lleno helio-II! Otro fenómeno paradójico como el anterior se descubrió al tratar de medir la viscosidad del helio con un viscosímetro de cilindros concéntricos (Figura 49). En este tipo de aparato se confina al fluido al espacio entre ambos cilindros y el cilindro exterior se hace girar lentamente. Un fluido viscoso ordinario transmite una fuerza y produce un par en el cilindro interior, el cual empieza a girar en la misma dirección. Por definición esta fuerza es una medida de la viscosidad del fluido. Lo sorprendente fue que al medir la viscosidad del helio-II con éste método resultó ser diferente de cero y, a ciertas temperaturas, incluso podía ser mayor que la viscosidad del helio-I.
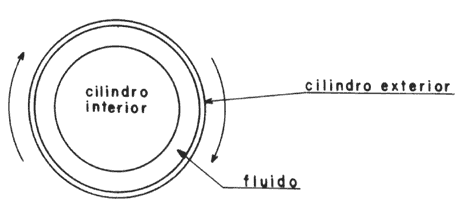
Figura 49. Viscosímetro de cilindros concéntricos.
¿Cómo es posible explicar estas paradojas?, ¿qué clase de líquido exótico es el helio-II que en algunos casos fluye con viscosidad nula, pero que en otros experimentos exhibe una viscosidad finita?, ¿cómo es posible que al calentarse el helio-II "salga" del recipiente que lo contiene pero que al mismo tiempo éste no se vacíe?
Para contestar estas preguntas es preciso recordar que la materia a escala
macroscópica, es decir, en cualquiera de las fases o niveles de agregación que
hemos considerado en este libro, posee tanto las propiedades ordinarias que
nos son familiares, como propiedades cuánticas fundamentales. Estas últimas
son manifestaciones del sistema peculiar de leyes que gobiernan las propiedades
de la materia a una escala microscópica, o sea, en las escalas propias del mundo
individual de los átomos y las moléculas. Ahora bien, a temperaturas ordinarias
el movimiento caótico, incesante, de los átomos y moléculas 8![[Nota 8]](../imgs/mcommnt.gif) enmascara totalmente el comportamiento cuántico de las partículas individuales
y, como resultado, sólo vemos las propiedades macroscópicas ordinarias, a las
que calificamos de clásicas para distinguirlas de las cuánticas. Pero
cuando la temperatura del sistema desciende hasta el dominio de las bajas temperaturas,
los movimientos térmicos de las partículas son mucho menores. Recuérdese que
la cantidad de energía cinética, es decir, debida al movimiento, que en promedio
se reparte entre las muchas moléculas de un material, determina la temperatura
del mismo. Entonces, en términos generales, podemos decir que si la temperatura
de un material aumenta, el movimiento de sus moléculas es mayor y viceversa.
Desde este punto de vista, en el mundo de los átomos y moléculas individuales,
bajas temperaturas significa "orden" y altas temperaturas "desorden". En consecuencia,
a temperaturas muy bajas, las propiedades cuánticas fundamentales de una sustancia
podrían ser observables y de hecho es precisamente lo que ocurre con el helio-II.
Su temperatura es tan baja que los movimientos térmicos de sus moléculas ya
no enmascaran a los efectos cuánticos y éstos se manifiestan plenamente a una
escala macroscópica. Así que el helio-II se transforma en un líquido cuántico
antes de solidificarse y, de acuerdo con las leyes cuánticas, puede permanecer
líquido aun en el cero absoluto. En efecto, uno de los principios de la física
cuántica es que el movimiento de los átomos no tiene que cesar completamente
en el cero absoluto. Por supuesto, esto es totalmente opuesto a nuestra intuición
"clásica" según la cual, dada la relación entre temperatura y movimiento molecular
mencionada anteriormente, este movimiento debería desaparecer por completo en
el cero absoluto. Por tanto, en estas regiones de temperatura esperaríamos que
al moverse poco los átomos las fuerzas atractivas entre ellos entraran en acción
y produjeran la solidificación del líquido.
enmascara totalmente el comportamiento cuántico de las partículas individuales
y, como resultado, sólo vemos las propiedades macroscópicas ordinarias, a las
que calificamos de clásicas para distinguirlas de las cuánticas. Pero
cuando la temperatura del sistema desciende hasta el dominio de las bajas temperaturas,
los movimientos térmicos de las partículas son mucho menores. Recuérdese que
la cantidad de energía cinética, es decir, debida al movimiento, que en promedio
se reparte entre las muchas moléculas de un material, determina la temperatura
del mismo. Entonces, en términos generales, podemos decir que si la temperatura
de un material aumenta, el movimiento de sus moléculas es mayor y viceversa.
Desde este punto de vista, en el mundo de los átomos y moléculas individuales,
bajas temperaturas significa "orden" y altas temperaturas "desorden". En consecuencia,
a temperaturas muy bajas, las propiedades cuánticas fundamentales de una sustancia
podrían ser observables y de hecho es precisamente lo que ocurre con el helio-II.
Su temperatura es tan baja que los movimientos térmicos de sus moléculas ya
no enmascaran a los efectos cuánticos y éstos se manifiestan plenamente a una
escala macroscópica. Así que el helio-II se transforma en un líquido cuántico
antes de solidificarse y, de acuerdo con las leyes cuánticas, puede permanecer
líquido aun en el cero absoluto. En efecto, uno de los principios de la física
cuántica es que el movimiento de los átomos no tiene que cesar completamente
en el cero absoluto. Por supuesto, esto es totalmente opuesto a nuestra intuición
"clásica" según la cual, dada la relación entre temperatura y movimiento molecular
mencionada anteriormente, este movimiento debería desaparecer por completo en
el cero absoluto. Por tanto, en estas regiones de temperatura esperaríamos que
al moverse poco los átomos las fuerzas atractivas entre ellos entraran en acción
y produjeran la solidificación del líquido.
Tomando en cuenta estas características inherentemente cuánticas del helio-II, en 1940 el gran físico ruso Lev Davidovich Landau propuso una teoría para explicar la superfluidez. La idea básica de esta teoría constituye un verdadero desafío a nuestro sentido común, pues propone que el helio-II ¡realiza dos movimientos diferentes simultáneamente! En otras palabras, que para poder describir completamente el flujo del helio-II es necesario especificar dos velocidades en cada punto y al mismo tiempo. Por supuesto que esto es muy distinto a lo que ocurre con un líquido menos exótico para el que es suficiente conocer una velocidad en cada punto para caracterizar su flujo. Pero recordemos nuevamente que el helio-II es un líquido cuántico y que nuestra intuición es clásica; luego, suposiciones como la anterior, que chocan con nuestro sentido común, pueden ser perfectamente válidas.
De hecho esta situación puede ser visualizada fácilmente en términos de un modelo más intuitivo. El mismo Landau y el físico húngaro Laszlo Tisza propusieron una analogía llamada el modelo de dos fluidos. Imaginemos que el helio-II está compuesto por dos líquidos que se mueven independientemente uno del otro, es decir que no ejercen fuerzas de fricción entre sí al moverse. Cada fluido tiene propiedades diferentes; por ejemplo, una de las componentes se mueve sin viscosidad, mientras que la otra es un líquido viscoso ordinario. A la primera Landau la llamó superfluida y a la segunda normal. Al fluir sólo la componente normal transporta calor; en cierto sentido puede decirse que esta componente es el calor mismo y que se ha separado de la masa del líquido y que se mueve respecto a la componente superfluida. Desde luego, este mecanismo de "conducción" de calor difiere completamente de nuestra idea usual de este proceso, que está asociada al movimiento térmico desordenado de las moléculas de un sistema. Pero no debemos olvidar en ningún momento que estamos haciendo una analogía. En la realidad sólo existe un líquido, el helio-II. Este modelo y sus características son sólo una herramienta que nos facilita el análisis y la descripción del sistema real.

El modelo permite explicar las paradojas de los experimentos anteriores, veamos cómo. En el experimento de Kapitza (Figura 47) el helio-II fluye sin fricción a través del capilar, mientras que en el viscosímetro de cilindros concéntricos muestra una viscosidad finita. De acuerdo con el modelo de los dos fluidos lo que diríamos es que en el primer caso es la componente superfluida la que se mueve por el capilar, en tanto que la componente normal no pasa. En el segundo experimento, es la componente normal la que transmite la fuerza entre ambos cilindros pues es un fluido ordinario con viscosidad, de manera que lo que se mide en este experimento es la viscosidad de la componente normal. La componente superfluida desde luego no tiene viscosidad y no transmite ninguna fuerza.

Figura 51. Lev Davidovich Landau.
Ahora consideremos el otro experimento paradójico realizado por Kapitza en el cual el helio-II a pesar de "salir" de un recipiente no lo vacía. En este caso únicamente la componente normal fluye y produce la deflexión en la veleta, la componente superfluida permanece en el recipiente. Nótese que, de acuerdo a lo que hemos mencionado antes, es el calor lo que se propaga hacia afuera del recipiente. En realidad se trata de una manifestación de un fenómeno más general del helio-II, a saber, su habilidad para transmitir ondas de temperatura. Para entender qué son estas ondas, recordemos las ondas sonoras en un fluido ordinario. El sonido se transmite por medio de una onda de presión. Una onda acústica o sonora puede producirse de diversas maneras, por ejemplo, por la vibración de una cuerda de violín o de la membrana de una bocina. Así se producen regiones de alta y baja presión, análogas a las que aparecen en la superficie del agua cuando se arroja un guijarro. Después de que la onda de presión pasa por un punto, la presión retorna al valor que tenía antes de su paso. Este mecanismo de propagación es muy diferente al de la temperatura. Sabemos que cuando se aplica calor en un punto de un material que inicialmente tiene una temperatura uniforme, parte de él calienta al material en ese punto, otra parte se propaga a los puntos vecinos los cuales también elevan su temperatura, aunque en menor cantidad. Cuando cesa de aplicarse calor a una región de material, ésta no "se propaga" como la onda sonora, sino que el calor se transmite y se aleja del punto en donde se suministró y la temperatura de este punto disminuye y se iguala a la temperatura del resto del material. El resultado neto es que la sustancia está más caliente. Sin embargo, este mecanismo ordinario de propagación del calor no ocurre en el helio-II. Si se suministra calor en un punto de este líquido, inmediatamente se produce una "onda de calor" que se propaga y se aleja del punto en cuestión. Aunque cese de suministrarse calor, la onda térmica continúa propagándose como una onda acústica, produciendo aumento en las temperaturas de los puntos por donde pasa. Pero cuando pasa por un punto y se aleja de él, su temperatura disminuye nuevamente a su valor anterior. Ya que ésta es precisamente la manera como se propaga la presión en una onda sonora, a ésta extraña onda térmica del helio se le llama el segundo sonido. La velocidad de propagación del segundo sonido puede medirse y resulta ser función de la temperatura. Por ejemplo, a 1.8 K es de 20 metros por segundo, que es una velocidad diez veces menor que la de una onda sonora o "primer sonido" a la misma temperatura (Figura 51).
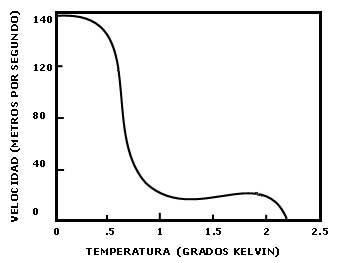
Figura 52. Velocidad del segundo sonido en helio II como función de la temperatura.
El fenómeno del segundo sonido también puede entenderse recurriendo a la teoría de los dos fluidos. Recuérdese que se supuso que el helio-II puede realizar dos movimientos simultáneos e independientes. Cuando ambas componentes del helio-II oscilan o se mueven al unísono en la misma dirección, se produce una onda sonora igual que en un líquido ordinario; pero si ocurre que las componentes se mueven en direcciones opuestas, pasando una a través de la otra, entonces se produce el segundo sonido.
Después de haber examinado algunos de los más importantes fenómenos que ocurren en el helio-II, resulta fácil comprender por qué este líquido ha sido objeto de tantos estudios. Los fenómenos que incluye no sólo son importantes por sí mismos, sino que al estudiarlos se ha ampliado nuestro conocimiento del mundo cuántico de los átomos y las moléculas. En el helio-II la naturaleza ha puesto un líquido cuántico a disposición de los físicos para su estudio y su investigación. El helio líquido es el refrigerante que nos provee de las temperaturas adecuadas para realizar investigación a temperaturas menores de 5 K, y, por esta razón, el descubrimiento de Kamerlingh Onnes al licuarlo en 1908 constituyó una de las más grandes contribuciones al avance de la ciencia.