III. ¿UNA PINTURA DE DIAMANTE?
EN EL mismo universo donde se mueven los Buendía puede uno encontrar a ese amigo con el nombre del viajero por excelencia, Ulises. Enamorado, loco por Eréndira, nos devela el secreto de las naranjas del huerto de su padre: partidas por la mitad, entre jugosos gajos, muestran enormes diamantes, ni siquiera en bruto, sino joyas, montañas de luz. Comparables, en buena cosecha naranjera, a algunos de los diamantes más famosos de la historia, por ejemplo, a una de las fracciones que resultaron del famoso Cullinan del que se dice pesaba 3 106 quilates (un quilate es igual a 0.2 gramos) y fue partido en 9 grandes piedras y 96 pequeñas.
Ulises y su padre holandés acumulan diamantes cosechando naranjas que han de guardar en caja de caudales. Procedimientos fantásticos que nada tienen que ver con las historias de los viejos buscadores que murieron junto con sus sueños en los exóticos escenarios de África.
Después de haber sido durante una larga época la fuente de un porcentaje muy alto de los diamantes que se descubrían en el mundo, el África austral ha pasado a ocupar un lugar más bien modesto entre los productores de los valiosos cristales. Quedan las minas abandonadas que muestran las entrañas reventadas del planeta. Como testigo del saqueo se halla un cráter de 1 097 metros de profundidad, el más profundo que haya excavado el hombre. De ese enorme cráter, monumento a la codicia que despierta una de las formas en que se presenta el carbono, salió el famoso diamante la Estrella de África, adorno magnífico del cetro británico.
Sólo en 1986 se arrancaron a la Tierra 88 millones de quilates. Ni se piense que las técnicas del viejo gambusino entran en acción en las operaciones a gran escala implicadas por tal cantidad de quilates. Ahora son los bulldozers y otras máquinas las que remueven toneladas de material por cada quilate. Una fracción importante de esos quilates se convierte en joyas, mientras otra parte se usa para fines industriales. Un quilate en bruto es pagado en unos ocho dólares por las filiales de De Beers, la gran compañía que controla el mercado de los diamantes. Una vez trabajado, cada quilate de un buen diamante puede llegar a costarle a un particular entre 12 500 y 15 000 dólares. Por otra parte, aunque no tanto, los diamantes utilizados en la industria resultan también bastante costosos.
La aplicabilidad industrial del diamante —lo mismo que su belleza como joya— proviene del arreglo de sus átomos, de esa otra belleza que el ojo humano no puede percibir: a nivel microscópico se muestra como un empacamiento de átomos de carbono en un orden que la figura 3 pretende describir. Este arreglo atómico confiere a los tales cristalitos una cantidad enorme de propiedades que a su vez los hace codiciables para aplicaciones variadísimas. Alrededor del 60 % de los diamantes que se extraen en el mundo se dedican a usos industriales.
La dureza del diamante es una propiedad proverbial que le viene directamente de la forma en que se enlazan sus átomos: enlaces fuertes, rígidos, tetraedrales, los describen los químicos. Además, un diamante puro tiene una conductividad eléctrica extremadamente baja y la conductividad térmica más alta conocida. Esto es, al mismo tiempo es un excelente aislante eléctrico y el mejor conductor del calor que se conoce. Si agregamos otras características como las propiedades piezoeléctricas, las propiedades ópticas y las propiedades químicas (tiene una gran resistencia ante los ataques químicos), encontraremos una gama amplísima de posibles aplicaciones. Algunas de ellas, desafortunada pero previsiblemente, de carácter militar.
Debe mencionarse que los diamantes no son eternos. No sólo se queman con relativa facilidad en presencia de oxígeno (quienes primeramente mostraron que el diamante es carbono puro, lo hicieron quemándolo) sino que son frágiles. Los golpes aplicados en direcciones muy particulares los hacen añicos.
Puede entenderse, pues, que no sólo se busca al diamante por cuestiones suntuarias y que muchos investigadores se hayan lanzado tras la idea de producir diamantes artificialmente. Esta idea, que pudiera parecer un sueño engendrado en la mente de Melquiades, taumaturgo allá cada cuando en Macondo y maestro de José Arcadio Buendía, es perfectamente realizable. Tan realizable y con tan fuertes consecuencias que se afirma que el mundo sólo conoce una pequeñísima parte de los resultados que se obtienen en la investigación de las propiedades del diamante: secretos industriales y secretos militares se atesoran aún con más celo que las naranjas de Ulises.
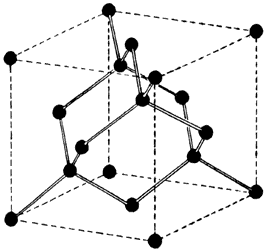
Figura 3. Representación de la estructura del diamante. Se resalta el hecho de que los enlaces entre átomos de carbono tienen direcciones muy precisas. Los puntos representan los átomos y las líneas entre ellos los enlaces electrónicos.
Aunque la preocupación del industrial que quiere invertir radica principalmente en los costos, aquí no hay lugar para analizarlos. Tan sólo consideraremos las dificultades que los causan.
La figura 4 muestra la estructura de la fase del carbono que es estable en las condiciones que prevalecen en el cascarón de nuestro planeta: el grafito. La otra fase, el diamante, es metaestable en esas condiciones. Que un sistema se halla en estado metaestable quiere decir que no ha alcanzado el estado de equilibrio sino que se quedó atrapado en un punto intermedio del que una excitación adecuada lo sacaría para precipitarlo hasta el equilibrio estable. Si la presión en la superficie de la Tierra fuera de unos miles de atmósferas, el diamante sería la fase estable y el grafito la metaestable. Podría pensarse que la forma de vida racional que existiese en esas condiciones, demasiado comprimida, vería al diamante como algo común y corriente y se pelearía por un trozo de grafito puro. Podemos apuntar que si eso sucediera no sería con fines suntuarios: el diamante siempre será más bello que el grafito. Desde luego que todas estas apreciaciones estéticas son subjetivas y a lo mejor los comprimidos seres de los que hablamos piensan y sienten completamente distinto. Pero esto es harina de otro costal. A quinientas mil atmósferas el carbón existiría sólo en la fase de diamante.
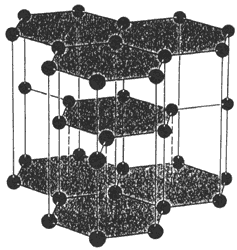
Figura 4. Representación de la estructura cristalográfica de grafito. Los puntos representan los átomos y las líneas entre ellos los enlaces electrónicos.
Al mercado de diamantes lo tienen sin cuidado todas estas discusiones acerca de las metaestabilidades, ya que los fuertes enlaces atómicos que construyen los electrones lo mantienen a salvo. Sí; los enlaces químicos del carbono le dan seguridad al mercado. Por una parte es muy difícil, sin aumentar la temperatura fuertemente, precipitar al carbono en su forma de diamante a su fase de grafito. Por otra, se necesita una cantidad enorme de energía para convertir grafito en diamante. Esta energía es necesaria para desbaratar los enlaces de la estructura de la figura 4 y reconstruirlos de tal manera que se produzca la estructura de la figura 3.
La posibilidad de sacarle la vuelta a todas las dificultades y, en vez de diamantes en bulto, crear recubrimientos de diamante, así, como si estuviéramos pintando, se vislumbra a través de una publicación firmada por J. W. Rabalais y S. Kasi (Science, Vol. 239, p. 623, febrero de 1988).
La receta se dice fácil: Tómese una superficie de níquel perfectamente limpia y aplíquesele, en ultra-alto vacío, un haz de iones de carbono con energia de 75 electronvoltios hasta que la dosis sea superior a 2 x 1016 iones por centímetro cuadrado.
Pasemos por alto las dificultades, nada triviales, de conseguir una superficie perfectamente limpia, de crear el ultra-alto vacío, y de producir el haz de iones de carbono, y planteemos un par de preguntas: ¿cómo saben los investigadores que lo que quedó depositado sobre la superficie del níquel es diamante y no grafito o alguna otra cosa?, ¿de dónde salió la energía para producir la fase metaestable del carbono, es decir, el diamante? La razón para hacer la primera pregunta nos parece clara. Aun tomando en cuenta las dificultades involucradas, este procedimiento nos parece tan fascinante como fantástico es cosechar naranjas que envuelven diamantes pulidos. Los señores investigadores nos tienen que asegurar que la receta nos va a funcionar siempre. Esto es algo que en la ciencia desempeña un papel esencial: todo experimento reportado debe ser reproducible. La segunda pregunta es de rigor: si tanto nos ha dicho la experiencia acerca de las dificultades para "hacer" diamantes, ¿cómo es que de repente, así sin más, al bombardear una superficie, obtenemos un recubrimiento de diamante?
La respuesta a la primera pregunta es la figura 5. A primera vista, sobre todo a quien no tiene mucha familiaridad con la picología, esto puede parecer un desatino. Antes que nada (y, sobre todo, antes de perder la paciencia) observe el lector que las cuatro curvas (a), (b), (c) y (d), tienen estructuras distintas: fueron producidas con una técnica de estudio de superficies que se denomina Espectroscopía electrónica Auger o simplemente Auger, cuyos detalles fatigaremos en un capítulo posterior.
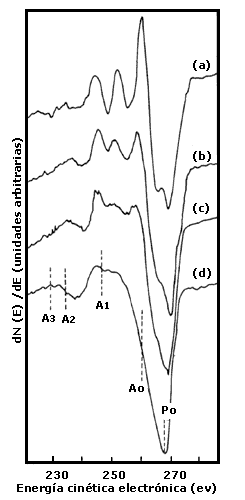
Figura 5. Evolución de la forma de la línea Auger al cambiar la dosis de iones de carbono sobre el níquel. (a) Curva característica de carburos de níquel producida con una dosis de 2.0 x 10 15 iones / cm2, el espesor es de una monocapa; (b) Una dosis entre 6.0 x 1015 y 8.0 x 1015 iones/cm2 produce varias capas en las que todavía hay compuestos metal-carbón aunque empiezan a aparecer características del carbón; (c) Curva característica del grafito que se produce con dosis de 9.0 x 1015 iones/cm2; (d) Con dosis superiores a 2.0 x 1016 iones/cm2 aparece la línea característica del diamante.
Los gráficos de Auger deben considerarse como las huellas digitales de los materiales. A un experto le basta ver uno de esos gráficos para decir si ha producido una película de diamante o de grafito. Imaginemos que tenemos un catálogo de huellas. La curva (a) nos informaría que si la dosis de iones de carbono es baja, de unos 2 x 1015 iones por centímetro cuadrado, apenas para cubrir la superficie con una monocapa, se forman compuestos de níquel y carbono: carburos de níquel. Al aumentar la dosis se produce la curva (b), correspondiente a capas de compuestos metal-carbón y al inicio de combinaciones entre los átomos de carbono. Cuando el espesor ha crecido suficientemente, de tal manera que el espesor de la película de carbono no permite "ver" los enlaces níquel-carbono, la espectroscopía Auger produce la curva del grafito que aparece en la figura 5 como (c). Mediante otros métodos los investigadores pudieron comprobar que el paso del níquel puro al carbono puro se da rápidamente, o sea, que la región donde aparecen los enlaces níquel-carbono es muy reducida. La curva (d) es la "huella "del diamante producida a dosis superiores a 2 x 1016 iones por centímetro cuadrado.
En la figura 6 se comparan, en un rango más amplio de energía de los electrones sonda, las curvas del grafito y de la película de diamante. Ahí se ven algunas diferencias entre ambas curvas, diferencias que no se muestran en la figura 5.
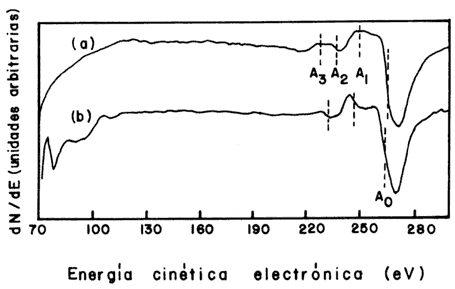
Figura 6. Comparación de las curvas Auger obtenidas de una película de diamante (a) y una de grafito (b).
Prolijos y meticulosos, Rabalais y Kasi usaron al menos otras cuatro técnicas de superficie para cerciorarse de que habían producido una película de diamante.
Ahora, dediquemos unas cuantas líneas al problema de la energía de activación necesaria para producir la fase metaestable. Sucede que cuando un ion choca sobre la capa de carbono previamente depositada se producen temperaturas que van de mil a diez mil grados Kelvin. Estos fuertes incrementos de temperatura duran una fracción pequeñísima de segundo (1011 segundos) y se extienden a un círculo que incluye unos cuantos átomos. Al menos esto es lo que dicen los modelos que permiten explicar la aparición de la tan mentada película. No se tiene otra explicación.
El caso es que ahora "podemos" forrar una pieza con una película de unas micras de espesor que cambia completamente la forma en la que el material favorecido encara al hostil mundo exterior. Una aplicación trivial sería una hoja de afeitar que durara más que el usuario. "... y a mi hijo, ya no tan imberbe, le lego mi hoja de afeitar que perteneció a mi padre y antes a mi abuelo." Los experimentos de Rabalais han tenido éxito sobre otros materiales aparte de níquel, materiales tales como oro, silicio, y algunos más. Falta ver cuántos substratos responderán de igual manera. Podríamos ahora olvidarnos, si quisiéramos vivir sin fantasía, de las naranjas del holandés, pero, por otro lado, podemos enriquecer nuestras risas porque ya no tenemos que ir a morir a las inhóspitas tierras de las minas de diamante si nuestro interés no es una enorme piedra sino que nos basta tan sólo con los resultados de esta pintura de diamante.