II. LA QUÍMICA DEL CAOS
EN 1921, W. C. Bray, investigador de la Universidad de California,
realizaba un estudio sobre la transformación del agua oxigenada catalizada por
diversas sustancias. En particular, el trabajo consistía en evaluar la eficiencia
del yodo para promover la mencionada reacción. Recordemos que un catalizador
es una sustancia que acelera la velocidad de una transformación química, y que
permanece inalterado al final de la misma. Además de ser eficiente para convertir
el mayor número de moléculas-reactivo por unidad de tiempo, un catalizador debe
poseer otra propiedad muy preciada: la de ser selectivo, es decir, que
ante la posibilidad de llevar a cabo la conversión por diferentes rutas, escoge
preferentemente una de ellas, lo que orienta la reacción hacia determinado tipo
de productos. En presencia de yodo como catalizador, el agua oxigenada se descompone
en productos de acuerdo con la siguiente reacción global:
es decir, por cada diez moléculas del reactivo se generan otras tantas de agua y adicionalmente cinco de oxígeno. Mediante un dispositivo experimental sencillo, Bray siguió el curso de la reacción en función del tiempo, midiendo la cantidad de yodo que se desprendía de su sistema. La figura 20 nos muestra los resultados de tal ejercicio; el eje vertical representa la concentración de yodo y el horizontal el tiempo, expresado en días. Para asombro de Bray, el proceso seguía un modelo oscilatorio en el cual el yodo aumentaba y disminuía durante la transformación, algo poco usual para una reacción química en aquella época, cuando se esperaría que el trazo que une los diferentes puntos fuese una línea continua. Bray no se amilanó ante las posibles críticas y publicó sus resultados ese mismo año en una prestigiada revista científica, sin que nadie se interesara en ellos. Un par de años después aparecieron dos o tres artículos que daban una explicación "científica" de los hechos: lo que provocaba esas artificiosas oscilaciones seguramente se debía a la falta de precaución de Bray en emplear un reactivo "obviamente" contaminado, o bien, según otros, ¡había partículas de polvo en el medio de reacción! Más de cincuenta años durmió el sueño de los justos la famosa reacción de Bray. Cuando se repitieron los experimentos, que obviamente reprodujeron el modelo oscilatorio, se consideraron como bichos raros dignos de ejecutarse en las prácticas de química en las universidades, para diversión de los estudiantes. ¿Por qué la apatía de los químicos ante los resultados de Bray? En otras áreas de la ciencia, como el caso de la biología, la astronomía o la física, por nombrar algunas, los científicos están acostumbrados a las oscilaciones; pero en la química, quien se atrevía a mencionar las oscilaciones recibía categórica respuesta: "Si eso fuese cierto se estaría violando el segundo principio de la termodinámica, más aún, mi querido colega, eso es el equivalente a diseñar una máquina de movimiento perpetuo." Antes de opinar sobre la cordura de nuestro científico, veamos primero qué nos dicen los mencionados principios termodinámicos.
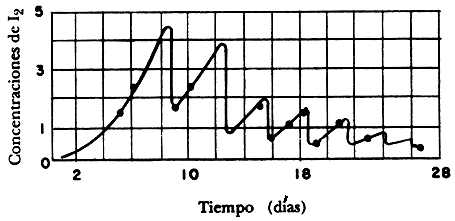
Figura 20. Los resultados de la reacción de Bray.
La primera ley de la termodinámica afirma la conservación de la energía para todos los sistemas. El incremento de energía en el seno de un sistema es igual a la cantidad de energía que ha recibido. Un sistema macroscópico puede estar constituido por gran número de componentes y separado del mundo exterior por una superficie geométrica ficticia, de manera que el número total de componentes por volumen es constante. Así, por ejemplo, una célula puede considerarse como un sistema que está compuesto por unas diez mil moléculas. En un sistema aislado no hay intercambio de materia o energía con el mundo exterior. Un sistema cerrado únicamente intercambia energía con el medio externo. Por último, un sistema abierto es aquel que intercambia energía y materia con el mundo exterior. La Tierra, en su conjunto, es un sistema cerrado que recibe energía de los rayos solares (despreciando los intercambios másicos que provienen de la caída de meteoritos, por ejemplo). Por el contrario, una célula de una bacteria es un sistema abierto.
Cuando dos objetos están en contacto y a la misma temperatura nunca sucederá que uno de ellos se caliente mientras el otro se enfría. Entonces, si bien la energía no se produce ni se destruye, parece fluir únicamente en una dirección. El segundo principio introduce una nueva función de un sistema, la entropía, que está relacionada con los intercambios de calor con el mundo exterior. Contrariamente a lo que sucede con la energía, la entropía no se conserva.
Siempre que algún proceso natural genera energía, parte de ella no se convierte en formas utilizables. Está ahí, pero no puede ser empleada, es inalcanzable. La cantidad de energía no utilizable es equivalente al aumento de entropía, que es función creciente de la temperatura. Por ejemplo, considérese que a baja temperatura el estado sólido está constituido por un sistema que tiene una estructura ordenada, mientras que si la temperatura es lo suficientemente elevada se presenta el estado gaseoso, de entropía mayor y estructura desordenada.
Para un sistema cerrado homogéneo que se encuentra a temperatura y presión constantes, un cambio químico espontáneo debe, sin duda, estar acompañado de una disminución en la energía disponible o, si se quiere ver de otra manera, por un aumento en la entropía. Por lo tanto, el conjunto tiende hacia un estado permanente e inequívoco, que es el equilibrio termodinámico. Por el contrario, cuando el sistema es abierto puede tender hacia un régimen constante, que no es el del equilibrio, llamado estado estacionario. El escepticismo de los químicos de la época ante los resultados de Bray se debía en parte a que pensaban que si la energía libre del sistema disminuía en forma continua, esto debía reflejarse en un aumento o disminución correspondientes de las concentraciones de las especies químicas presentes durante la transformación, es decir, la conversión de A en B debería ser continua, sin que en un momento B regresara para formar A nuevamente. A partir de los años cincuenta se realizó una revisión de los conceptos termodinámicos y entre el grupo de científicos que trabajaron en ello destaca la labor de Ilya Prigogine, químico ruso emigrado a Bélgica. Prigogine aportó las bases teóricas para describir el comportamiento de los sistemas físicos que se encuentran alejados del equilibrio termodinámico, trabajo que le valió ser galardonado con el premio Nobel de Química en 1967. Lo que podemos resumir de estos estudios es que en un sistema bajo esas condiciones se pierde la homogeneidad espacial y temporal que prevalece cerca del equilibrio. Ante esas circunstancias es posible que se presenten oscilaciones en una reacción química, aunque los productos al inicio y al final no estén sujetos a ellas. Un sistema alejado del equilibrio tiene, como veremos, un comportamiento impredecible, caótico para ser claros, pero en esas condiciones el desorden máximo deja de ser la regla y nada prohibe también la emergencia de un orden temporal o espacial. Las células de Bénard son un ejemplo del orden espacial en el cual el sistema, de estar en el equilibrio, debería presentar una temperatura uniforme en el recipiente, pero sucede que cuando la diferencia de temperatura alcanza cierto valor, aparecen continuamente pequeñas corrientes de convección, como pulsos que regresan a su estado inicial, y a partir de un punto crítico ciertas pulsaciones se amplifican y dan lugar al movimiento macroscópico que origina la estructura ordenada en forma de células hexagonales.
EL MOVIMIENTO DE LAS REACCIONES
¿Cómo se representa la evolución temporal de una reacción química? En un principio,
la química estudió las propiedades de las sustancias, luego las de su composición,
pasó después a las leyes que determinan las propiedades y estructuras, hasta
finalmente llegar al estudio de las leyes de la transformación química. Podemos
decir, en términos generales, que primero existió la química descriptiva,
luego la estructural seguida de la termodinámica, para llegar
por último a la química cinética, es decir, el estudio de las velocidades
de reacción. La química descriptiva y la estructural se especializan en el estado
de la materia, la "fotografían"; mientras la termodinámica considera los cambios
de la materia, estado a estado, o sea, "compara las fotografías", la cinética
estudia el paso de un estado al otro, "filma" el evento. La cinética toma en
consideración el camino que sigue la transformación, y la velocidad de una reacción
depende obviamente del camino que sigue. La interpretación cuantitativa de los
resultados de una reacción química se basa en la construcción y análisis subsecuente
de un modelo por el cual los reactivos llegan a los productos finales, y especifica,
si es posible, todas las especies intermediarias que intervienen. Así, por ejemplo,
en el caso de la reacción de Bray la velocidad de la desaparición del agua oxigenada
se puede definir como:
| |
(ecuación 4) |
en donde v representa la velocidad de desaparición del reactivo, expresada
por ejemplo en número de gramos por unidad de tiempo, k es una constante
que depende de la temperatura y (A) representa la concentración del reactivo
en un tiempo dado. Suele suceder que el mecanismo o modelo por el cual la reacción
pasa del reactivo inicial a los productos sea más complejo que como lo describimos
con anterioridad. Por lo común, la molécula de agua oxigenada no genera directamente
en un solo paso los productos de reacción, sino que en el curso de la transformación
aparecen y desaparecen especies intermedias de vida muy corta que pueden ser
detectadas con los dispositivos de medición que utilicemos. La ecuación anterior
sólo nos describe la velocidad de transformación global que se deriva de combinar
todas las reacciones intermedias que son teóricamente posibles. Si analizamos
un poco más a fondo la reacción de Bray, encontraremos que suceden estas transformaciones
intermedias:
| a) 5 H2O2 + I2 | ® | 2 HIO3+ 4 H2O |
| b) 5H2O2+ 2 HIO3 | ® | 5 O2 + I2 + 6 H2O |
Sumemos todos los componentes que están a la derecha de las flechas y hagamos otro tanto con los que están a la izquierda:
Al hacer la resta entre los componentes comunes a ambos lados de la ecuación, llegamos a la ecuación original que habíamos descrito anteriormente. En nuestro conocido diagrama de fases podemos describir la dinámica de un sistema mediante un esquema el que se representa en la figura 21 para una reacción teórica en la que un compuesto A reacciona con otro B para dar un producto final. En el diagrama se grafica cada una de las masas de los dos reactivos y el tercer eje representa el tiempo. Los reactivos parten de cierta concentración inicial y evolucionan hasta alcanzar un equilibrio en el cual su concentración ya no cambia en el tiempo. Como podemos observar, en este esquema sencillo existe un atractor de punto fijo.
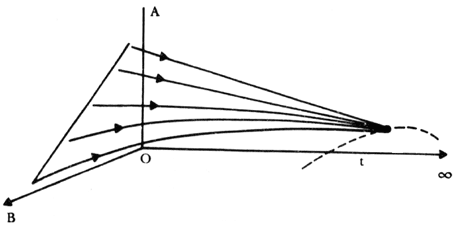
Figura 21. Evolución de las concentraciones de reactivos en el tiempo hacia un punto de equilibrio.
¿Cómo explicar desde el punto de vista cinético una reacción oscilatoria? Existía
un modelo teórico que daba cuenta de este tipo de comportamiento y había sido
descrito por Alfred Lotka en 1920 para explicar las oscilaciones que suceden
en problemas de tipo ecológico. El mecanismo propuesto consiste en tres "reacciones",
de las cuales dos de ellas son autocatalíticas:
| (P) + C |
® |
2C |
| C + L |
® |
2L |
| L |
® |
Aquí (P) representa el pasto del cual se alimentan los conejos, es decir, C. Dado que el pasto está en una concentración muy elevada podemos tomarlo como un valor constante que no interviene en el mecanismo. Al alimentarse de pasto los conejos se reproducen, lo cual representa la primera reacción autocatalítica dado que los conejos aceleran su propia creación. La segunda reacción autocatalítica la representan los lobos, L, que crecen y se reproducen a expensas de los conejos, con lo cual la población de conejos disminuye. Eventualmente los lobos mueren, y los conejos vuelven a elevar su población. En la figura 22 se presenta una solución a este ciclo, utilizando un conjunto de tres ecuaciones diferenciales que se realizaron en computadora. En la figura 22 (a) se grafica la concentración de C o de L en función del tiempo y en la figura 22 (b), la concentración de uno en función del otro. En este último caso lo que se obtiene es una curva cerrada, casi una elipse; por tanto, conforme el sistema sigue la curva, las concentraciones de C o L varían de una manera periódica. Hasta principios de los años sesenta los químicos no conocían un sistema real que se comportara de acuerdo con el esquema de Lotka; obviamente la reacción de Bray había sido olvidada pero los estudios de Prigogine demostraban que dicho tipo de oscilaciones eran posibles. La evidencia experimental que faltaba la había realizado B. P. Belousov en 1958, un químico ruso.
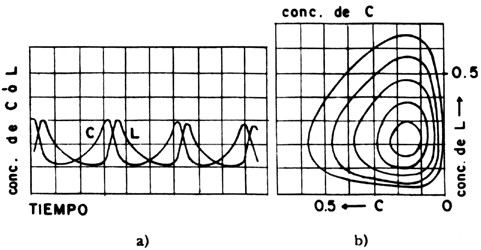
Figura 22. Simulación del mecanismo de Lotka: a) cinética típica; b) trayectoria de fases.
LA EXTRAÑA REACCIÓN QUE DESCUBRIÓ BELOUSOV
En 1959 B. P. Belousov; biofísico que trabajaba en el Ministerio de Salud de su país, en un congreso de medicina informó de un dato peculiar que había observado en el curso de una reacción química que estaba estudiando. Como en el caso de la reacción de Bray, este dato fue olvidado durante algún tiempo hasta que los trabajos de Prigogine se dieron a conocer.
La historia es sencilla: el científico estudiaba en su laboratorio una reacción de oxidación de un compuesto orgánico, el ácido cítrico, el cual se trata con una sal de bromo y la conversión se cataliza por acción de una sal de cerio que sirve para aumentar la velocidad de la transformación. El cerio en solución acuosa inicialmente tiñe el líquido de color amarillo y una vez que cataliza la reacción se vuelve incoloro. Como es de esperarse en una reacción clásica, una vez que se lleva a cabo la transformación, la solución originalmente amarilla debía quedar incolora. Para asombro de Belousov, la solución perdía la coloración amarilla, mas para recobrarla al poco rato, y dichas oscilaciones se observaban por mucho tiempo; o sea que el cerio que se había transformado volvía al punto de partida. Años más tarde, otro biofisico ruso, A. M. Shabotinsky se interesó en esta curiosa reacción y la estudió más sistemáticamente, realizando varias modificaciones al sistema: cambió el ácido cítrico por el ácido malónico y añadió un compuesto de hierro que permitía observar en forma más clara las etapas de oxidación y reducción que se llevaban a cabo.
Resumamos los ingredientes de la reacción, ahora conocida como reacción de Belousov-Shabotinsky:
| ácido malónico, |
| ácido inorgánico, que puede ser el sulfúrico, |
| una sal que aporte iones bromato (BrO3-), |
| una sal que aporte iones bromuro (Br- |
| una sal de hierro (Fe ++), |
| una solución acuosa. |
Precisemos que un ion es un átomo o grupo de átomos cargados eléctricamente
y que sus cargas son el resultado de la ganancia o pérdida de uno o más electrones.
Cuando un ion se oxida pierde electrones y cuando se reduce los gana. Así, los
iones de hierro en el estado reducido (Fe ++) dan una coloración
roja, y al oxidarse se convierten en Fe +++, de coloración
azul. Obviamente, una sustancia que se reduce trae aparejado el hecho de que
otra se oxide. Las modificaciones que hizo Shabotinsky en la reacción permitieron
observar que además de las oscilaciones temporales se presentaban estructuras
espaciales en el seno de la reacción inicialmente homogénea, las cuales se prolongaban
durante mucho tiempo. Obviamente, si uno espera el tiempo suficiente para que
se alcance el equilibrio dictado por las leyes de la termodinámica, lo que encontrará
en el recipiente es bióxido de carbono, agua y el ion bromuro:
|
|
|||
|
ac. malónico |
|||
pero las curiosas oscilaciones no son el producto de la reacción global, sino de las transformaciones intermedias que ocurren. Cuando la reacción se realiza en una caja cilíndrica a temperatura ambiente, en el inicio es roja; súbitamente, parte de esta solución se vuelve azul y comienza a diseminarse por toda la caja, formando un disco. Dado que la reacción es oscilatoria, el centro del disco azul vuelve a ser rojo otra vez y éste se convierte en un anillo. Conforme las oscilaciones continúan, el centro del anillo torna otra vez al color azul, lo cual formará otra vez un disco que se convertirá en anillo. Se tiene por lo tanto un modelo de anillos concéntricos que se propagan. Las ondas de color representan las variaciones en la concentración de especies químicas que se propagan en un sistema inicialmente homogéneo. Es decir, estamos en presencia de una inestabilidad como la de Bénard, salvo que en este caso las oscilaciones son espaciales y temporales a la vez. Algunos autores afirman que las ondas se propagan con velocidades de 6 mm/minuto y emergen a intervalos más o menos iguales de veinte lugares distintos de la caja cilíndrica que en su mayoría no son puntos, sino arcos de curvas de hasta 15 mm de largo.
En la figura 23 se muestra el tipo de disco que se forma en la reacción de Belousov- Shabotinsky.

Figura 23. Los anillos de la reacción B-Z.
¿QUÉ SUCEDE EN LA REACCIÓN B-Z?
¿Cuál es el mecanismo que se ha propuesto para esta reacción? Armar el rompecabezas de esta reacción no ha sido tarea fácil; para ello han intervenido cientos de investigadores en el mundo, quienes aportaron datos cuantitativos sobre las diferentes etapas elementales de la misma. De este trabajo monumental hoy en día se ha establecido una secuencia ni más ni menos que de 18 reacciones elementales, en las que intervienen 21 especies químicas diferentes, las cuales se presentan en la figura 24. Tratemos de dar una descripción cualitativa de este fenómeno, para esto nos apoyaremos en la figura 25, en la cual sólo se describe parte de las reacciones que intervienen utilizando en este caso al cerio (Ce) como catalizador en lugar del hierro.
Si recordamos el diagrama de Lotka, una característica del sistema era que existía una reacción autocatalítica, es decir, que una sustancia acelera su propia creación. En la reacción de B-Z existe tal tipo de fenómeno: la especie HBrO2 se genera en R5 y aumenta su cantidad en R6.
El HBrO2 se consume en la R2 y en la R5 y cuando la primera reacción domina sobre la segunda, la producción autocatalítica se apaga y las reacciones que predominan son R1, R2, R3, R8a y R8b, que consumen la especie Br- que hacía que R2 fuese predominante sobre R5. Al dejar de predominar se "enciende" el sistema R5 y el R6, que oxidan al catalizador Ce+3 a Ce+4 y se produce el cambio de coloración de la solución.
Cuando las reacciones R5 y R6 están funcionando promueven las reacciones R9 y R10; esta última dará los productos finales de la reacción, pero a su vez genera nuevamente Br-, que vuelve a hacer que R2 domine a R5 y recomience el ciclo.
Es obvio que en un sistema cerrado en el cual no se alimentan reactivos la reacción tenderá a un equilibrio al irse consumiendo el ácido malónico y el ácido bromomalónico, que se convierten en bióxido de carbono. Por lo tanto, el siguiente paso era alejar la reacción del equilibrio termodinámico y estudiar en forma más cuantitativa la evolución de las especies intermedias, dejando a un lado los cambios de coloración.
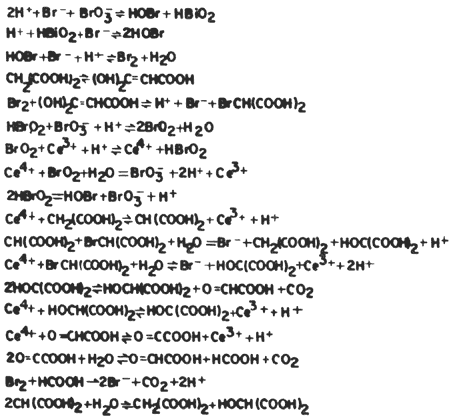
Figura 24. Mecanismo de la reacción B-Z.
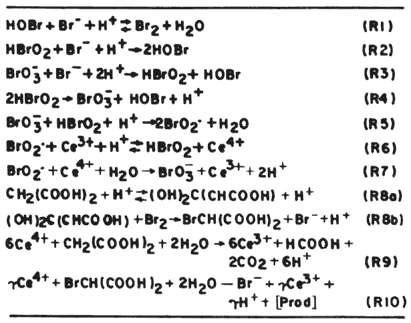
Figura 25. Mecanismo simplificado de la reacción B -Z
La estrategia para alejar la reacción del equilibrio consiste en realizarla en un sistema abierto, es decir, en el que se intercambia materia y energía con el medio circundante. Para ello es necesario modificar el sistema de reacción, para lo cual se alimentará en forma independiente y controlada los reactivos, que llegan a un dispositivo en el cual se mezclan y reaccionan, mientras que paulatinamente se extraen los productos de la transformación. La alimentación continua de reactivos y la extracción simultánea de la mezcla de reacción impiden que el sistema alcance el equilibrio. Además, al alimentar los reactivos en forma independiente es posible modificar las concentraciones individuales de cada uno de los participantes y también, si se varía la velocidad de alimentación al reactor, se altera en forma controlada el tiempo en el cual los reactivos están en contacto entre sí, lo que en el argot de los químicos se suele llamar el tiempo de residencia o de contacto. El análisis cuantitativo de lo que sucede en el reactor se lleva a cabo introduciendo diminutos electrodos sensibles a la variación de las concentraciones de las especies de cerio en sus estados oxidado y reducido, así como otros que son sensibles a la concentración del ion bromuro. Mediante esta metodología experimental, muy elaborada en su aplicación, es fácil que el lector vea que desde el punto de vista de la reacción química, es posible realizar algo equivalente a lo hecho con la ecuación logística, ya que mediante experimentos con diversas condiciones iniciales, como en el curso de reacción, se obtienen datos sobre la dinámica del sistema.
En la figura 26 presentamos algunos resultados experimentales que se obtuvieron al variar el tiempo de residencia; con un electrodo de platino se midió en forma continua el cambio en el potencial de óxido- reducción de la reacción y con ello se obtuvo una estimación de la relación de iones cerio (III) / (IV). Por lo tanto, en la figura se grafica en el eje horizontal el tiempo de reacción y en el vertical el valor del potencial medido con el electrodo: en el caso de la figura a), el flujo total de reactivos es de un mililitro por minuto, en el caso b) es de 4.0.
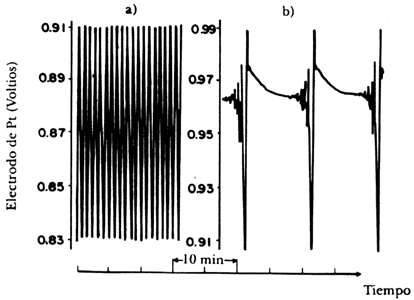
Figura 26. Oscilaciones de la reacción B- Z en función del flujo de reactivos, a) 1 ml/minuto; b) 4.0.
De los resultados experimentales es evidente que para unas condiciones se presentan oscilaciones regulares, mientras que en otras las oscilaciones son mucho más complejas. Los autores de este trabajo, K Graziani, J. Hudson y R. Schmitz de la Universidad de Illinois, EUA, no dudaron de calificarlos como estados caóticos en una publicación aparecida en 1977. Todavía en 1985 muchos científicos dudaban de los resultados experimentales que se habían acumulado en diversos laboratorios en el mundo: "el hecho de que existan sistemas experimentales que exhiban un comportamiento caótico no prueba que el caos es inherente al mecanismo de la reacción, lo más probable es que se deba a fluctuaciones estocásticas, imposibles de evitar", decían algunos, mientras que otros apuntaban que "todavía es una incógnita la demostración experimental del caos en un sistema químico homogéneo, más bien lo que ha sucedido es que los resultados son el producto de un control imperfecto de los fenómenos externos". Para vencer el escepticismo de muchos científicos fue necesario realizar exhaustivas pruebas experimentales en las que se amplió el espectro de valores obtenidos modificando tanto los tiempos de residencia como las concentraciones iniciales de reactivos, datos que fueron alimentados a programas computacionales que utilizaban herramientas matemáticas cada vez más complejas. Al mismo tiempo aparecieron informes de otros sistemas que presentaban dinámicas oscilatorias, por lo que se llegó a un punto en que era innegable la existencia de oscilaciones en sistemas aparentemente muy sencillos. ¿El aparente caos en la reacción no sería consecuencia, por ejemplo, de la suma de periodos oscilatorios diferentes en el sistema? La experimentación y simulación computacional demostró que el caos determinista estaba presente en la reacción de Belousov-Shabotinsky, los argumentos fueron los siguientes:
Se había demostrado la extrema sensibilidad del comportamiento de la reacción a las condiciones iniciales. Pequeñas modificaciones en las mismas hacían oscilar la reacción con periodos diferentes. Se demostró, por otra parte, la presencia de duplicaciones periódicas, así como de intermitencia del tipo I que, como recordamos en la ecuación logística, son rutas hacia el caos. Además, Graziani y colaboradores demostraron más adelante que bajo ciertas condiciones de reacción, las oscilaciones se ven interrumpidas abruptamente y la reacción entra en un estado no oscilatorio.
Por último, una prueba adicional de la presencia del caos resultó cuando se comprobó la existencia de un atractor extraño. En la figura 27 se muestra la simulación que se obtuvo por computadora a partir de datos experimentales, empleando el esquema reaccional antes mencionado. La figura no es otra cosa que nuestro conocido diagrama de fases y en él se grafican los valores en escala logarítmica de tres de los componentes del sistema: el ácido bromomalónico (g) el ion cerio-IV (b) y el ion bromuro (m). Si el sistema tuviese un comportamiento periódico, sería de esperarse que el atractor generado fuese de ciclo limitado, pero éste no es el caso.
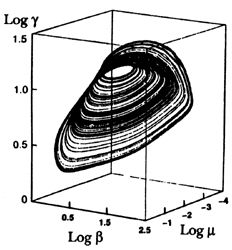
Figura 27. El atractor extraño de la reacción B- Z
LAS REACCIONES EN FASE GASEOSA
La existencia de oscilaciones y la potencial presencia del caos en las reacciones que se llevan a cabo entre gases no ha sido tan estudiada como la contraparte de las reacciones en solución. Una de las que se ha visto con más detalle es la producción del agua a partir de sus precursores, que se puede representar de la siguiente manera:
La reacción es exotérmica, es decir, en el proceso se genera calor; para ser más precisos diremos que por cada 36 gramos de agua que se forman al estado líquido se liberan 136.6 kilocalorías. Al realizar la conversión en un sistema cerrado uno puede esperar dos tipos de comportamiento: que el proceso se lleve a cabo muy lentamente o bien que se realice en forma explosiva. Es decir que bajo ciertas circunstancias, al mezclarse los reactivos se lleva a cabo una aceleración muy rápida de la velocidad de la reacción que conduce a la instantánea conversión de ellos en el producto final. Estos procesos que se llevan a cabo en fase gaseosa suelen presentar dificultades en el control de la transformación a temperatura constante, ya que fácilmente suelen apartarse de esa condición y para este caso la temperatura desempeña el papel de "autocatalizador". En un reactor cerrado el comportamiento de una mezcla de hidrógeno y oxígeno puede ser de dos tipos: la reacción se lleva a cabo lentamente, o la conversión es prácticamente explosiva.
En la figura 28 presentamos un diagrama típico en el que se delinean las dos zonas que hemos mencionado. En el eje horizontal se grafica la temperatura a la cual se lleva a cabo el proceso y en el vertical la presión del sistema. En la figura se han marcado tres límites, los cuales separan, en la reacción, la forma lenta de la manera explosiva; en este último caso los reactivos se convierten en agua en milésimas de segundo. La localización exacta de los límites está determinada por varios factores, entre los cuales destaca el tamaño del reactor, que influye notablemente en la región del primer límite, y también la composición inicial de los gases, que afecta sobre todo el segundo límite. Cuando se cambia la forma de realizar la combustión empiezan a suceder fenómenos más interesantes. Para poder medirlos se usa generalmente un reactor como el que describimos para la reacción de B- Z, en el cual se alimentan en forma separada el hidrógeno y el oxígeno, y se cuenta con el equipo necesario para controlar la presión y la temperatura, además de los aparatos necesarios que detectan en forma cuantitativa la cantidad de reactivos y productos presentes en cada momento. Al añadirse al reactor las cantidades apropiadas de hidrógeno y oxígeno en proporción H2: O2 = 2: 1, el diagrama presión-temperatura se modifica, como se ve en la figura 29, en donde se muestran exclusivamente las regiones que rodean al segundo límite de la reacción.
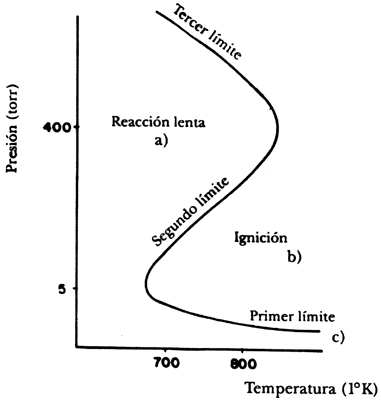
Figura 28. Diagrama de la reacción espontánea para la formación del agua.
Como se nota en la figura han aparecido en la zona de ignición tres tipos diferentes de comportamiento: en la zona de reacción lenta a) la ignición es constante, pero en ignición controlada las variaciones en la temperatura y la concentración de los componentes de la reacción oscilan en forma sencilla. En la región de oscilaciones a la que se llega aumentando la temperatura, las oscilaciones son mayores, lo que indica que una nueva fase de reacción se está llevando a cabo. Todo esto hace pensar que la reacción de generación de agua sigue un mecanismo tan complejo como el que vimos para la reacción de Belousov- Shabotinsky, aunque hasta ahora el sistema parece ser exclusivamente periódico. Los estudios del mecanismo de esta reacción nos demuestran que éste no es tan sencillo como se podría pensar, ya que se llevan a cabo entre 44 y 62 tipos de reacciones en las que intervienen ocho o más especies inestables. Aún no todo está dicho de esta compleja reacción y más estudios son necesarios para revelar los misterios que encierra.
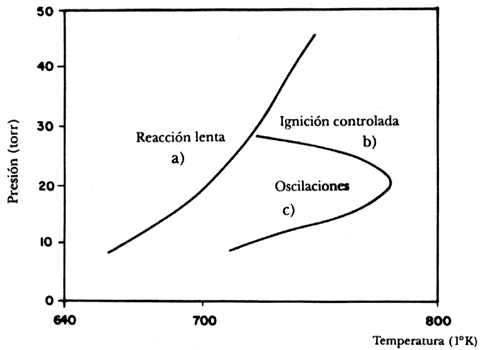
Figura 29. Segunda zona de ignición en la formación del agua.
La disolución de un metal en un medio ácido es otro ejemplo de los intrincados mecanismos que se suceden en la química. Se había informado de ciertos comportamientos anómalos a finales del siglo pasado, a los que no se les hizo mucho caso. En aquella época, los instrumentos con los que contaba el investigador no eran lo suficientemente precisos como para determinar si efectivamente se trataba de una variación oscilatoria de la concentración de una especie o si era una falla en la señal emitida por el aparato de medición. Hoy en día, la sensibilidad y precisión para controlar y medir la corriente eléctrica ha permitido revisar los datos que se tenían de la reacción de disolución de un metal por un ácido. Por ejemplo, la reacción de disolución del cobre en el ácido clorhídrico (HC1) va acompañada de la formación del cloruro de cobre (CuC1) y la liberación de hidrógeno, de acuerdo con el Siguiente esquema:
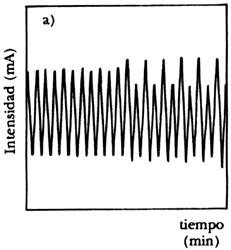
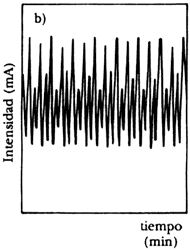
Para realizar este experimento se construye un electrodo con el metal que se emplee, que se sumerge en el ácido. J. Ávila y J. Genescá en su libro Más allá de la herrumbre (La Ciencia desde México, núm. 9) nos explican con claridad cómo se puede seguir la cinética de esta reacción. Para ello se emplea un potenciostato, que es un instrumento electrónico que impone a la muestra un potencial constante o variable, positivo o negativo, con respecto a un electrodo de referencia por el cual no pasa corriente. Para cerrar el circuito de electrólisis se utiliza un tercer electrodo, que no es atacado por el ácido. Nos dicen los autores que cuando el ácido disuelve el metal libera iones cargados positivamente a la solución y con la ayuda de una fuente externa de corriente será posible acelerar o frenar esta emisión, y por tanto aumentar o detener el ataque del metal. Nótese que el valor de corriente administrada externamente desempeña el papel de la constante K de la ecuación logística.M. Basset y J. Hudson, investigadores estadounidenses, informaron en 1987 de una serie de experiencias que realizaron sobre la disolución de un electrodo de cobre en presencia de ácido. Cuando los investigadores variaron sistemáticamente el voltaje aplicado al sistema y midieron la densidad de corriente del mismo, obtuvieron un diagrama como el que se muestra en la figura 30. Se puede observar claramente que existen dos regiones de oscilación para este sistema. Con el fin de precisar la localización exacta y la naturaleza de las bifurcaciones, los autores realizaron experimentos con voltajes precisos, midiendo la intensidad de corriente generada en función del tiempo. Para ser precisos, al aplicarse 306 milivoltios y medir la intensidad de corriente en miliamperios, empiezan a suceder fenómenos curiosos que se pueden observar en la figura 31, donde ilustramos tres periodos que ocurren secuencialmente conforme avanza el experimento. En la figura a) se nota la transición a la bifurcación entre dos valores constantes; en b) el sistema pasa a oscilar entre cuatro valores, para posteriormente en c) entrar en caos. Si se prosigue el experimento, nos dicen los autores, aparece un periodo de oscilación entre tres valores que también sufre bifurcaciones para volver a la dinámica caótica que se ve interrumpida por una etapa en la que se obtiene un solo valor, ¡antes de que cesen totalmente las oscilaciones!
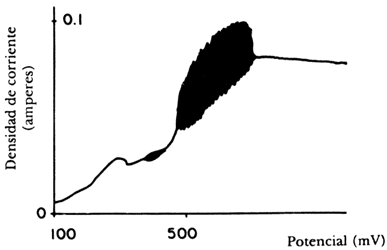
Figura 30. Diagrama potenciostático de la disolución del cobre.
|
|
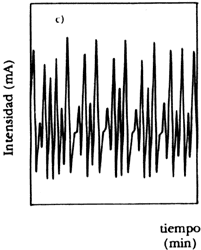
|
Figura 31. Oscilaciones durante la disolución del cobre. a) transición del periodo 1 a 2; b) periodo 4; c) transición de 3 a 6.
Las reacciones oscilatorias presentan al investigador un aliciente adicional para su estudio, ya que constituyen modelos sencillos de lo que sucede en sistemas más complejos, como son, por ejemplo, las reacciones en un organismo viviente, tema que abordaremos más adelante. También son útiles para entender lo que acontece en las reacciones catalíticas de interés industrial. ¿Qué sucede cuando una reacción oscilatoria se acopia con otra? Puede haber dos tipos de acoplamiento: químico o físico. En el sistema químico existen dos o más subsistemas, cada uno de ellos capaz de oscilar en forma independiente y con una o más especies químicas en común. Piense el lector en dos reacciones, A + B y A + C, que oscilan individualmente y se realizan en un reactor que contiene A, B y C. Para el caso del acoplamiento físico se tienen dos o más subsistemas que están conectados por difusión; en términos sencillos, se trata, por ejemplo, de la misma reacción acoplada en la que cada uno de los subsistemas tiene concentraciones iniciales diferentes de reactivos, como el caso de la reacción de Belousov- Shabotinsky.
Vale la pena mencionar los resultados que se han obtenido de numerosos estudios realizados con osciladores químicos. En el primer caso los osciladores acoplados coordinan su movimiento de manera tal que el primero realiza un número de ciclos n en exactamente el mismo tiempo en que el segundo realiza m ciclos. También puede suceder que la frecuencia de las oscilaciones sea totalmente diferente o que el sistema llegue a una dinámica caótica. M. Crowley e I. Epstein, investigadores estadounidenses, encontraron en la reacción de Belousov-Shabotinsky un comportamiento sorprendente: acoplaron dos sistemas a concentraciones iniciales diferentes en un reactor y midieron con un electrodo de platino la variación en el potencial eléctrico; los resultados se ven en la figura 32. Como podemos observar, en los primeros cinco minutos de la reacción cada oscilador funciona en forma independiente, pero inmediatamente después "se apaga" la oscilación y cada subsistema muestra un potencial constante. A los 11 minutos, gracias a los dispositivos experimentales utilizados se desconectan los dos sistemas durante 40 segundos y se vuelve a restituir el acoplamiento, siguiéndose el curso de la reacción. Se observa la existencia de dos fases complementarias estables en cada sistema y a los 19.5 minutos las reacciones vuelven a oscilar con frecuencias independientes, como en el inicio.
Otra importante propiedad de los osciladores acoplados es la forma en que se encienden. Epstein y colaboradores han demostrado su existencia empleando una reacción pariente de la de B-Z, llamado sistema arsenito-yodato-clorito. El asunto es sencillo, la reacción entre el arsenito y el yodato produce el arseniato y el yoduro:
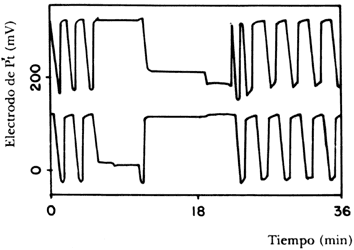
Figura 32. Oscilaciones en la reacción B-Z de un sistema acoplado.
En este caso, el yoduro es autocatalizador. La reacción se ha estudiado a fondo, demostrándose que en un amplio rango de condiciones iniciales solamente presenta dos estados estacionarios estables. Pero por otra parte, resulta que el yoduro reacciona con el clorito para generar el ion cloruro y el yodo:
En esta segunda reacción el yodo también es un autocatalizador. Al acoplar los dos sistemas y medir el potencial de óxido-reducción las reacciones empiezan a oscilar, fenómeno que se ha bautizado con el nombre de ritmogénesis.
Estos resultados son muy significativos pues ayudan a comprender la dinámica de sistemas químicos y biológicos; así, por ejemplo, en el caso del acoplamiento fisico sugiere que la formación de estructuras espaciales o temporales es resultado de las oscilaciones que se producen como consecuencia de heterogeneidades en la concentración del medio reactivo.
Veamos por último una peculiaridad adicional de las reacciones oscilatorias, la influencia de lo que se llama el retardo en la reacción. Volvamos por un momento a la reacción de Belousov-Shabotinsky y empleemos un modelo desarrollado en la Universidad de Oregon, Estados Unidos, que sirve para simular su comportamiento en la computadora. Las reacciones son las siguientes:
| A + Y ® X | (M1) |
| X + Y ® P | (M2) |
| B + X ® 2X + Z | (M3) |
| 2X ® Q | (M4) |
| Z ® Y | (M5) |
X, Y y Z están en concentraciones variables, mientras que las otras están fijas. Los investigadores trataron de reducir el sistema a dos variables, para lo cual combinaron los pasos (M3) y (M5) en uno solo, añadiendo B, X y Z desde el inicio de la reacción:
| B + X |
® |
2X + Z |
| Z |
® |
Y |
| |
||
| B + X |
® |
2X + Y |
Los resultados experimentales demostraron que la reacción no oscila bajo esas condiciones sino que se alcanza un estado estacionario. Lo anterior ha conducido a pensar que la sustancia Z tiene como función crear una pausa en el curso de la reacción que permite regenerar al reactivo Y en el paso 5 seamos aún más claros: las reacciones M1 y M2 dependen de una concentración de Y precisa, que es ajustada por el sistema mediante la reacción M3.
Piense el lector en las transformaciones industriales que llevamos a cabo para proveernos de energéticos, fertilizantes, medicamentos, plásticos, etc. La catálisis industrial representa aproximadamente 85% de todas las transformaciones químicas que realizamos. Millones de litros de gasolina se producen día a día, combustóleos son quemados en diversos procesos industriales para generar la energía necesaria, amén de los convertidores catalíticos que funcionan en los automóviles para combatir la contaminación, sólo por nombrar algunos ejemplos. En la gran mayoría de los casos estas reacciones se realizan empleando catalizadores heterogéneos, es decir, la conversión se realiza en la interface existente entre un metal, óxido metálico u otro sólido, y uno o varios reactivos que se presentan en el estado gaseoso o líquido. Los mecanismos por los cuales una transformación química se lleva a cabo en la superficie de un sólido han sido materia de investigación constante y se sabe hoy en día que son un campo fértil para que el comportamiento no lineal se presente. Como es fácil de comprender, el trabajo en este campo reviste una importancia capital pues el conocimiento profundo de lo que sucede en un proceso catalítico tiene consecuencias sobre la eficiencia y operación de los reactores comerciales. Una de las reacciones más estudiadas en este campo ha sido la oxidación del monóxido de carbono, utilizando como catalizador alguno de los metales nobles, como por ejemplo el platino. La reacción presenta oscilaciones al llevarse a cabo en diversas condiciones de reacción que van del alto vacío hasta la presión atmosférica, además, las oscilaciones en la concentración del producto varían también con la temperatura y la cantidad de monóxido empleado al inicio. Lo interesante de la reacción no reside en la obtención de un producto de alto valor económico (lo que se genera no es más que bióxido de carbono), sino en dos aspectos: desde el punto de vista científico es una reacción en que la cinética no presenta muchos posibles intermediarios, lo que facilita el análisis; desde la perspectiva de las aplicaciones es de vital importancia pues este tipo de catalizador se emplea para eliminar el monóxido generado por la combustión de la gasolina en los automóviles. Para que se lleve a cabo el fenómeno catalítico, tanto el oxígeno como el monóxido no reaccionan entre sí al estado gaseoso sino que previamente deben alojarse en un sitio activo de metal. Este fenómeno de retención del gas (y de manera general, de cualquier fluido) en la superficie del sólido se llama adsorción química; en él, las uniones que atan ambas partes son de naturaleza semejante a la de los enlaces químicos habituales, por lo tanto es en esencia una reacción de superficie. Hay que hacer notar que, una vez que se ha adsorbido el gas, las propiedades de la superficie del catalizador, no son las mismas que tenía antes de la reacción. La reacción de oxidación del monóxido se realiza cuando éste se adsorbe en un sitio de la superficie metálica, el oxígeno hace otro tanto, con la salvedad de que no queda anclado como molécula, sino como átomo. Por tanto, podemos esquematizar el mecanismo de la siguiente manera:
| CO + sitio |
®
|
COads |
| O2 + sitio |
®
|
2 Oads |
| COads +
Oads |
®
|
CO2 + sitios |
Las "reglas del juego" que impone el sistema para llevar a cabo la transformación nos permiten entender el porqué de las oscilaciones; éstas son:
1) Existen en el metal sitios activos para el CO, que llamaremos para simplificar de tipo A.
2) Para que se lleve a cabo la adsorción del oxígeno se requiere de sitios tipo B, los cuales deben ser contiguos y libres, a fin de que cada átomo se pueda adsober.
3) Un sitio B libre puede ser ocupado por el CO y se convierte en tipo A.
4) Una molécula de COS anclada en su sitio reacciona con un oxígeno atómico vecino y forma el bióxido de carbono, con lo cual se liberan dos sitios, que al estar juntos y libres se convierten en sitios B (A + B ®B + B). Por tanto, tenemos aquí el clásico sistema autocatalítico en el cual B acelera su propia creación.
El mecanismo de las oscilaciones se explica de la siguiente manera: al inicio de la reacción la superficie del metal tiene capacidad para adsorber el monóxido en mucho mayor cantidad que el oxígeno, así, la superficie se llena de CO. Esta superficie con CO ahora sí, cataliza la adsorción del oxígeno; éste reacciona con el CO y genera el bióxido de carbono, lo cual ocasiona que la superficie ya no tenga capacidad de fijar el oxígeno, volviendo por lo tanto al inicio del ciclo. El sutil balance de la cantidad de reactivos adsorbidos en la superficie del catalizador es el responsable de que éste funcione o no; cuando en los experimentos de laboratorio se varía la cantidad de monóxido que se alimenta al sólido se presentan duplicaciones periódicas en cascada que llevan al sistema al caos.