III. ENSAMBLE DE LAS PARTES: DE LAS PROTEÍNAS A LA ORGANIZACIÓN SUPRAMOLECULAR
UNA vez formada una cadena de aminoácidos o polipéptidos ésta puede adquirir diversas conformaciones tridimensionales. Un péptido puede asociarse también a otras proteínas de la misma o diferente secuencia de aminoácidos y adoptar diferentes configuraciones. Igualmente, a nivel tridimensional las proteínas tienen que ordenarse con precisión. La interacción entre sus diferentes dominios resulta en asociaciones específicas tanto con moléculas diferentes como con moléculas del mismo tipo. Cuando esto último sucede, la interacción no covalente de subunidades trae como resultado la formación de una estructura polimérica.
Este fenómeno de ensamble o polimerización tiene las siguientes ventajas: 1) se construye una estructura a partir de subunidades iguales de modo que la información para hacer una sola de ellas es suficiente, 2) se puede controlar tanto el ensamble como el desensamble, y para esto se requiere relativamente poca energía, y 3) el ensamble permite corregir más fácilmente errores que se darían si cada vez se tuviera que sintetizar toda la estructura.
Para que se realice el ensamble se requiere solamente que una proteína tenga
un sitio de unión que sea complementario a otra región de su propia superficie.
Así se pueden formar dímeros, que es el caso más simple, trímeros y hasta
polímeros, en los cuales hay miles de subunidades o monómeros asociados. En
el caso del citoesqueleto las estructuras subcelulares que lo componen, tanto
los diferentes tipos de filamentos como los microtúbulos, se forman por polimerización
de sus subunidades proteicas (Figura III.1). La forma alargada de estas estructuras
les da las características esenciales para formar las partes de una maquinaria
de la que se requiere fuerza mecánica.
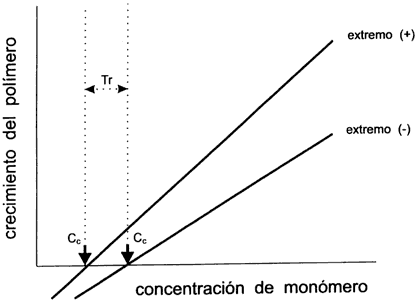
Figura III.1. Curva de polimerización de una proteína del citoesqueleto.
Se puede apreciar que el polímero que se esta formando crece mas rápidamente
en el extremo (+). La concentración crítica (Cc) es aquella por debajo de la
cual no hay polimerización. Tr = treadmilling, se refiere al rango de
concentración en el polímero se polimeriza en el extremo (+) y se despolimeriza
en el (-).
Los monómeros de actina pueden ser polimerizados aumentando la concentración
de sales a nivel fisiológico (Figura III.2).
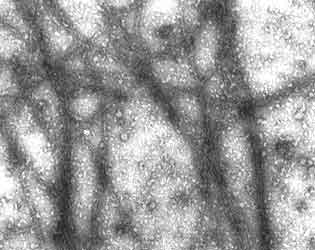
Figura III.2. Micrografía de filamentos de actina polimerizados in vitro.
La actina se extrajo de músculo esquelético de conejo y se introdujo a polimerizar
en presencia de Mg2+.
Durante la polimerización el fosfato terminal de una molécula de ATP, que está regularmente asociada con los monómeros, se hidroliza proveyendo la energía necesaria para el ensamble. La actina despolimerizada, llamada también soluble, forma una solución poco viscosa, pero al polimerizarse hay un rápido aumento de viscosidad que al medirse nos dará una indicación de la velocidad con que se asocian los monómeros de actina para formar un filamento (Figura II.9).
Cada microfilamento tiene dos cadenas de monómeros de actina enrollados en
espiral, la cual crece siempre en un extremo (extremo +), puesto que sus extremos
son estructuralmente diferentes por la molécula deATP o ADP
que se halla asociada a los monómeros ensamblados. Esta polaridad de la molécula
es muy importante en la asociación de los filamentos con otras proteínas y en
la forma como se desensambla un filamento. Este desensamble se puede producir
aumentando los niveles de Ca2+ y también por la acción de algunas
drogas, como la citocalasina. El desensamble siempre ocurre a partir del extremo
(-) de los filamentos.
Los filamentos de actina interaccionan con otras moléculas para poder funcionar.
Su interacción va a depender del tipo de célula en la que se encuentren y de
las funciones que ésta lleve a cabo. En los diferentes tipos de músculos la
actina interacciona con la miosina para producir la contracción muscular. En
otros tipos de células los filamentos de actina forman redes y haces (Figura
III.3) que dan más resistencia al citoplasma y permiten desplazamiento de las
células. Las proteínas que facilitan la formación de haces se llaman, en forma
genérica, hacinadoras, aunque dos de ellas se han caracterizado mejor y se conocen
como fascina y fimbrina. Otras proteínas favorecen el entrecruzamiento de los
filamentos para formar redes y entre ellas están la ABP, la filamina
y la alfa-actinina. Otras rompen los filamentos, como la gelsolina y la severina,
facilitando la despolimerización y la repolimerización. En los sitios de contacto
de filamentos con la membrana celular se encuentran proteínas como la ankirina,
la espectrina y la fodrina. En áreas de contacto de las células con el substrato
se encuentran los filamentos de actina asociados a proteínas como vinculina
y talina. Asimismo, proteínas como la profilina se asocian a los monómeros de
atina inhibiendo su polimerización y manteniendo la actina en la célula en forma
soluble. Toda esta gama de proteínas regula de manera precisa la forma en que
la actina participa en los movimientos celulares y determina cuándo y cómo se
debe inducir la polimerización, así como la despolimerización de los microfilamentos
(Figura III.4).

Figura III.3. Red de filamentos de actina vistos por microscopía de inmunofluoresencia
dentro de una célula en cultivo. Los filamentos de actina se decoraron con un
anticuerpo específico contra la actina que, una vez unido a está, se revela
con un segundo anticuerpo acoplado a un reactivo fluoresente.
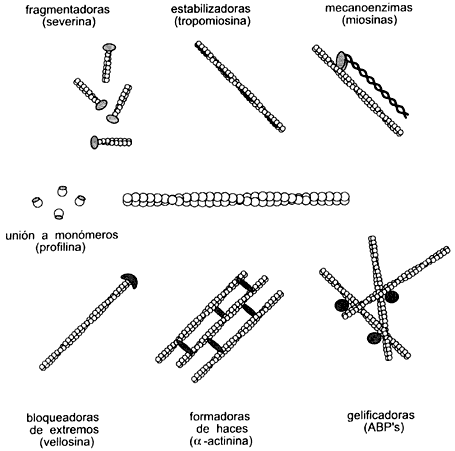
Figura III. 4. Representación de algunas de las proteínas que se unen específicamente
a filamentos y monómeros de actina para darles diferentes organizaciones dentro
de la célula.
Las moléculas de miosina también se polimerizan en forma espontánea para formar
filamentos gruesos (Figura III.5). El número de cadenas que se ensamblan para
formar una fibra depende del tipo de la miosina, pero básicamente la estructura
es similar. Las cadenas pesadas se enredan una sobre la otra formando una espiral,
manteniendo la misma dirección y dejando libre una parte de la molécula en donde
se asocian las cadenas ligeras, constituyendo con ello una especie de cabeza.
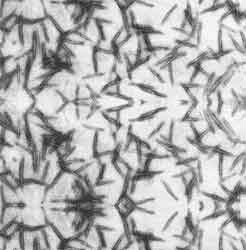
Figura III. 5. Micrografía de filamentos de miosina obtenidos de una célula
no muscular. (Foto cortesia de J. Kendrick Jones.)
Para formar un filamento grueso las colas de moléculas individuales se asocian
por uniones hidrofóbicas y así se dejan las cabezas sueltas. Esta asociación
se va haciendo fuera de fase, de modo que un filamento tendrá cabezas a todo
lo largo con ciertos intervalos (Figura V.1). En el músculo esquelético se asocian
cientos de cabezas para formar un filamento grueso. En otras células los filamentos
de miosina pueden estar formados por fibras individuales. Las cabezas de las
fibras son la parte de la molécula de miosina que interacciona con la actina.
Estas moléculas tienen una actividad enzimática de ATPasa, es decir,
son capaces de hidrolizar ATP, con lo que se deriva la energía
necesaria para la interacción con la actina y los movimientos que se llevan
a cabo con esta interacción. Además de la actina hay varias proteínas que se
asocian a la miosina, y las mejor definidas hasta ahora son aquellas que se
asocian a los filamentos en el músculo y regulan el deslizamiento. La tropomiosina
se une como una varilla a lo largo del filamento de la actina, la troponina
se une a intervalos regulares a los filamentos de la actina y regula los niveles
de Ca2+, y la alfa actinina ayuda a unir los filamentos de actina
a la línea Z del sarcómero. Cuando una de las dos cadenas ligeras de la miosina
se fosforila o uno de sus aminoácidos (serina) adquiere un grupo fosfato, la
cabeza de la miosina puede interaccionar con la actina y entonces el filamento
se desplaza sobre la actina. Esta fosforilación, así como la activación subsecuente
de otras moléculas, depende de los niveles de Ca2+ en la célula.
En células no musculares la miosina forma filamentos menos organizados que los
del músculo y para ensamblarse debe ser fosforilada, si esto no sucede, la molécula
se agrega sobre sí misma y no forma filamentos. La asociación de la miosina
y la actina en células no musculares forma estructuras contráctiles o pequeñas
maquinarias para llevar a cabo ciertos movimientos. Un ejemplo es el anillo
contráctil que divide el citoplasma de una célula para formar dos células hijas
(véase figura 7.VII). Otro ejemplo son las fibras de tensión que se forman en
células en movimiento y que se insertan en la membrana celular en los puntos
de contacto con el substrato sobre el que se desplazan. En algunas células,
como las de los epitelios, la interacción forma redes permanentes que les permite
mantener su forma y sus contactos con otras células (Figura III.5). Cuando las
estructuras no son permanentes se establece un equilibrio dinámico entre las
proteínas solubles y las polimerizadas, lo cual le permite a la célula regular
el ensamble o desensamble de estas maquinarias, según lo necesite, manteniendo
todas las partes en equilibrio y listas para su reutilización. Los filamentos
de actina pueden despolimerizarse por interrupción del equilibrio entre monómeros
y polímero. Hace algunos años se encontró que las drogas llamadas citocalasinas
se unen a los microfilamentos en el extremo (-) causando su polimerización por
el extremo (+). En esta condición los filamentos no se pueden repolimerizar,
lo cual da como resultado su desensamble total y la inhibición defunciones celulares
en las que éstos participan.
La unidad básica de los microtúbulos es el dímero, formado por tubulinas alfa
y beta en iguales proporciones. El ensamble de estos dímeros para formar un
microtúbulo requiere de la hidrólisis de GTP, un nucleótido trifosfato
que contiene la base guanina en lugar de adenina, como en el ATP,
y que se encuentra asociado a cada dímero. La energía provista por la hidrólisis
del GTP favorece la polimerización en el extremo del túbulo, que
aumenta de tamaño. El otro extremo, al no crecer, se empieza a despolimerizar.
Por esta razón los microtúbulos son muy inestables y pueden polimerizarse y
despolimerizarse con gran rapidez. Los dímeros, al polimerizar, forman filamentos
alargados (Figura III.6) que posteriormente se asocian en grupos de 13 y dejan
una luz central que le da a la estructura el carácter de túbulo en el citoplasma.
Los microtúbulos, de aproximadamente 240 nm, se forman de manera espontánea
partiendo de centros de nucleación llamados organizadores de microtúbulos (MTOC),
en donde se concentran las subunidades de tubulina. Con base en estas estructuras
se organizan los microtúbulos que radian hacia el citoplasma (Figura III.7).
Los centros organizadores de microtúbulos forman los ásteres en la mitosis y
también los cuerpos basales de los cilios y flagelos en muchas células.
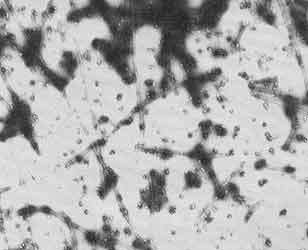
Figura III. 6. Micrografía de microtúbulos polimerizados in vitro.
La tubulina se obtuvo de cerebro de rata y se hizo polimerizar en presencia
de GTP.
Algunos dímeros de tubulina se modifican una vez ensamblados en un microtúbulo,
para participar en funciones definidas. Así vemos cómo algunas tubulinas se
acetilan y otras pierden el aminoácido tirosina. También, al asociarse a algunas
proteínas los microtúbulos, se estabilizan.
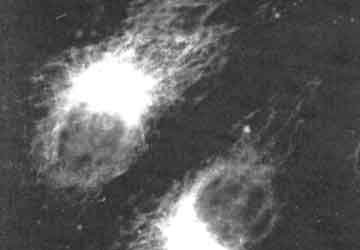
Figura III. 7. Centros organizadores de microtúbulos (MTOC).
Los microtúbulos se observan por microscopía de inmunofluoresencia dentro de
las células, ya que se decoraron con un anticuerpo contra la tubulina. La región
más brillante alrededor de los núcleos corresponde al MTOC, de
donde irradian los microtúbulos a todo el citoplasma.
Entre las proteínas que estabilizan a los microtúbulos se encuentran las llamadas
MAPs, que son de peso molecular elevado y que están formadas por
aproximadamente 2 000 a 3 000 aminoácidos, y las llamadas TAU,
con 400 a 600 aminoácidos. Ambas se asocian a todo lo largo de los microtúbulos
y contienen dos dominios, uno que une a varios dímeros y ayuda a polimerizarlos
y otro que permite que los microtúbulos se unan a otras proteínas. La estructura
microtubular más organizada es tal vez el axonema de cilios y flagelos, en el
cual nueve pares exteriores de microtúbulos se arreglan alrededor de un par
central, todos ellos conectados entre sí por un gran número de proteínas diversas
que ayudan a que este axonema lleve a cabo el movimiento de deslizamiento que
resulta en el movimiento batiente de los cilios y de látigo o tirabuzón de algunos
flagelos (Figura III.8). En el caso de cilios y flagelos los microtúbulos son
muy estables y no se despolimerizan con facilidad. Cada par exterior tiene asociada
una proteína con actividad de ATPasa, que se conoce como dinaina,
y que al hidrolizar el ATP genera la energía necesaria para permitir
el deslizamiento de los túbulos y, por consiguiente, de los flagelos o cilios.
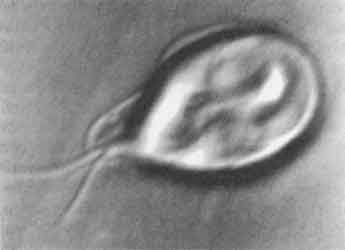
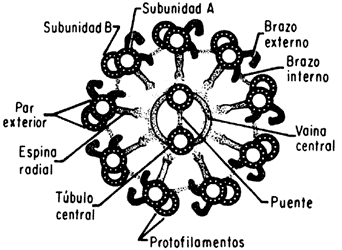
Figura III. 8. A) Videomicrografía del protozoario parásito Giardia
con sus dos flagelos en movimiento. B) Representación esquemática del axonema
de túbulos arreglados en nueve pares exteriores y un par central. El movimiento
de los microtubulos causa la flexión de los flagelos y esto permite a la célula
desplazarse en su medio ambiente.
La polimerización de los microtúbulos puede inhibirse por temperatura, presión, falta de cationes como Ca2+ y Mg2+ y por drogas, como la colchicina, que al interaccionar con los dímeros de tubulina impide que éstos se integren al microtúbulo que esta créciendo en un extremo, causando la despolimerización del otro extremo. Ya que un microtúbulo está en un equilibrio dinámico entre dímeros y polímeros, cualquier factor que interrumpa este equilibrio interferirá con su funcionamiento. Es por esto que la colchicina es un inhibidor de la mitosis, del transporte axonal y de otras funciones que requieren la participación de microtúbulos. La droga llamada taxol actúa en forma contraria a la colchicina, esto es, estabiliza al polímero de modo que los microtúbulos no pueden despolimerizarse, con la consecuente inhibición del equilibrio dinámico y de los procesos ya mencionados, en los que participan los microtúbulos.
Los filamentos intermedios se forman al ensamblarse cuatro elementos fibrosos,
compuesto cada uno de subunidades correspondientes a un mismo tipo de polipéptido.
Las cuatro cadenas pueden agruparse en diversas combinaciones, dependiendo de
las proteínas de esta familia que existan en la célula (como se vio en la figura
II.12). Se asocian lateralmente en algunas zonas, dejando espacios libres en
donde las subunidades proteicas adquieren diferentes configuraciones. Los filamentos
intermedios son de longitud variable y posiblemente se extienden hasta el citoplasma
de la célula para interaccionar con otras estructuras, como los llamados desmosomas
en las membranas, dándoles rigidez y ayudando a su función de mantener a las
células unidas entre sí (Figura III.9). Generalmente se piensa que tienen una
función mecánica dentro de las células, puesto que existen siempre en forma
polimerizada. La presencia de clases específicas de filamentos intermedios,
en diferentes tipos celulares, ha permitido tipificar a una célula e identificar
de dónde proviene, lo cual ha resultado muy útil en los casos de cánceres en
que el origen de las células en una metástasis puede determinarse por el tipo
de proteínas que constituyen a los filamentos intermedios que contiene, y así
localizar el punto de origen de la metástasis.
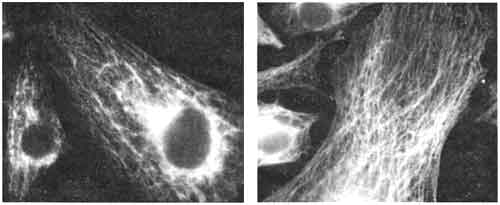
Figura III. 9. Micrografía por inmunofluoresencia de células en cultivo
que han sido decoradas con un anticuerpo contra filamentos intermedios (en este
caso vimetina). La intrincada red de estos filamentos se extiende por toda la
célula hasta su periferia.
Hay también proteínas asociadas a filamentos intermedios; dos bien conocidas son la filagrina y la sinemina. Sin embargo, su función específica es poco clara todavía, ya que los filamentos intermedios son muy estables. En algunas enfermedades, como la de Alzheímer, se ha demostrado que las proteínas de los filamentos intermedios están alteradas. La fosforilación de las proteínas que forman a los filamentos intermedios está relacionada con algunas de sus funciones, es reversible y se observa cuando las células cambian de forma o se reestructura un componente celular, como sucede con la envoltura nuclear. No se conocen drogas que los despolimericen, aunque en células tratadas con colchicina estos filamentos se colapsan sobre el núcleo sin desensamblarse, por lo que se ha observado que la organización de los microtúbulos controla la organización de los filamentos intermedios y entonces la colchicina, al desensamblar los microtúbulos, produce un colapso de la red de filamentos intermedios. Este proceso es reversible y tanto los filamentos como los microtúbulos se reorganizan al quitarse la colchicina. Sin embargo, no se han hallado los cofactores que participan en la reorganización de filamentos intermedios.