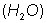 y dos �tomos de hidr�geno se combinan con dos de oxigeno para formar el per�xido de hidr�geno (
y dos �tomos de hidr�geno se combinan con dos de oxigeno para formar el per�xido de hidr�geno (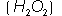 ) com�nmente llamado agua oxigenada.
) com�nmente llamado agua oxigenada.
Corresponde a la sesi�n de GA 8.6 LOS INVISIBLES
A trav�s de la historia de la humanidad, el hombre se ha esforzado por explicar y organizar la estructura de la materia; en seguida se describir� su estructura.
La materia est� constituida por �tomos que son la m�nima cantidad de materia que conserva sus propiedades. Una forma f�cil de entender la estructura del �tomo es suponiendo que tiene una estructura comparable a la del Sistema Solar - un n�cleo al centro y electrones girando en �rbitas alrededor.
Los �tomos se unen para formar mol�culas que a su vez pueden unirse para formar compuestos.
Ya los griegos en el siglo V a.n.e., hablaban del �tomo, posteriormente muchos investigadores han propuesto teor�as para su estudio entre los que se cuentan: John Dalton (S. XVIII), J. J. Thompson (S. XIX), los esposos Curie (S. XIX y XX), Rutherford y Bohr (S. XX), y muchos m�s que han colaborado para tener un concepto m�s claro de su comportamiento y manejo.
Hoy se conocen aproximadamente 24 part�culas subat�micas. Sin embargo, para formar un modelo del �tomo, se utilizar�n com�nmente tres part�culas: los electrones - con carga negativa y que est�n ubicados fuera del n�cleo girando en �rbitas u orbitales -; los protones (con carga positiva) y los neutrones (sin carga) que se encuentran en el n�cleo de los �tomos.
La carga de los �tomos es neutra debido a que tienen el mismo n�mero de electrones con carga negativa que de protones con carga positiva.
Los �tomos y las mol�culas son tan peque�os que es imposible verlos a simple vista, por lo tanto algunas teor�as explican su comportamiento.
Hip�tesis at�mica de Dalton y sus postulados
John Dalton (1767-1844) cient�fico ingl�s propuso una primera teor�a at�mica cuyos postulados siguen teniendo vigencia con algunas modificaciones l�gicas debidas a continuos descubrimientos.
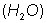 y dos �tomos de hidr�geno se combinan con dos de oxigeno para formar el per�xido de hidr�geno (
y dos �tomos de hidr�geno se combinan con dos de oxigeno para formar el per�xido de hidr�geno (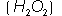 ) com�nmente llamado agua oxigenada.
) com�nmente llamado agua oxigenada.
Las leyes ponderales son dos, la Ley de las proporciones definidas de Proust y la Ley de proporciones m�ltiples:
"Siempre que dos sustancias se combinan para formar un nuevo producto, lo hacen en proporci�n ponderal, fija, y definida", ley que se denomina Ley de las proporciones definidas del cient�fico franc�s J. L. Proust (1775-1826).
Ley de proporciones m�ltiples del cient�fico ingl�s John Dalton en 1804 que dice: "Si dos sustancias (elementos o compuestos) se combinan para formar m�s de un compuesto, los pesos de uno de ellos, que se combinan con un peso fijo del otro, est�n relacionados entre s� como los n�meros enteros (generalmente sencillos)".
La mol�cula se forma por la uni�n de �tomos, aunque una mol�cula puede estar formada por un solo �tomo.
Mol�cula monoat�mica. Cuando la mol�cula est� formada por un solo �tomo, como por ejemplo el ne�n (Ne), aluminio (Al), oro (Au), cobre (Cu), etc�tera.
Mol�cula diat�mica. Cuando la mol�cula est� formada por la uni�n de dos �tomos, como en los casos del cloruro de sodio (NaCl) o del �xido de carbono (CO).
Mol�cula triat�mica. Cuando est� formada por tres �tomos, como la del agua 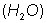 .
.
Mol�cula poliat�mica. Cuando en la composici�n de la mol�cula participan m�s de tres elementos como en el �cido sulf�rico ( ).
).
Masa molecular. Es la suma de las masas at�micas de cada uno de los �tomos que componen una mol�cula o un compuesto.
En 1808 el cient�fico franc�s Joseph Gay Lussac concluy� que en una reacci�n qu�mica: "Los vol�menes de los gases reaccionantes y los productos gaseosos est�n en relaci�n sencilla de n�meros enteros y peque�os", lo que se denomina Ley de las combinaciones en volumen.
Los gases como el hidr�geno, nitr�geno y cloro, deb�an existir como mol�culas diat�micas, es decir: 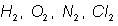
En 1811 el f�sico italiano Amadeo Avogadro propuso una hip�tesis que vino a resolver muchos problemas que a�n se ten�an para entender la formaci�n y estructura de los compuestos, sobre todo en el caso de los gases; y dice as� "Vol�menes iguales de gases diferentes, bajo las mismas condiciones de temperatura y presi�n, contienen el mismo n�mero de mol�culas,".
![[ Índice Conceptos Básicos ]](toc.gif)
![[ Previo ]](prevsec.gif)
![[ Nivel Superior ]](parntsec.gif)
![[ Siguiente ]](nextsec.gif)