2. Agua, disoluciones y pH
Corresponde a la sesi�n de GA 5.2 LA SOLUCI�N EST� EN EL AGUA
El agua, responsable del color azul del planeta Tierra, constituye el 30% de su masa y entre el 30 y 90% de la de los seres vivos; participa en la mayor�a de las reacciones qu�micas que se dan en los organismos y, por supuesto, en la naturaleza.
Se calcula que la Tierra contiene aproximadamente 1 386 millones de km� de agua (L�pez, 1985), cantidad que se mantiene pr�cticamente inalterada y en constante equilibrio din�mico entre sus tres estados (s�lido, l�quido y gaseoso); todo esto desde el origen de la vida hasta nuestros d�as, recicl�ndose constantemente por medio del ciclo hidrol�gico.
De los 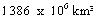 de agua que hay en la Tierra, el 97.3% es oce�nica (agua salada) y el 3.7% corresponde al agua dulce (L�pez, 1985). De este 3.7%, una buena parte se encuentra congelada en los casquetes polares; por ello mismo, la cantidad de agua utilizable por el hombre es realmente peque�a, de tal manera que el ahorro en su consumo es indispensable.
de agua que hay en la Tierra, el 97.3% es oce�nica (agua salada) y el 3.7% corresponde al agua dulce (L�pez, 1985). De este 3.7%, una buena parte se encuentra congelada en los casquetes polares; por ello mismo, la cantidad de agua utilizable por el hombre es realmente peque�a, de tal manera que el ahorro en su consumo es indispensable.
Ciclo hidrol�gico
El complicado fen�meno del ciclo hidrol�gico se puede explicar en cinco, aparentemente sencillos pasos que a continuaci�n se listan.
- 1. Parte del agua de los oc�anos, de las aguas continentales y de la transpiraci�n de los vegetales se evapora mediante la acci�n de la energ�a solar para formar, posteriormente, las nubes.
- 2. Las nubes, as� formadas, se desplazan por la fuerza de los vientos hacia los continentes.
- 3. Cuando llega a las masas continentales, el vapor de agua de las nubes se enfr�a, se condensa y se precipita en forma de lluvia, granizo o nieve.
- 4. Al llegar al suelo, el agua de la lluvia, la nieve o el granizo, al derretirse, escurre o se absorbe dando lugar a los llamados cuerpos de agua dulce: r�os, lagos, lagunas, r�os subterr�neos o mantos fre�ticos (que posteriormente pueden llegar a la superficie en forma de manantiales, y que se descargan tambi�n en lagos, lagunas y mar).
- 5. Por �ltimo, la mayor cantidad de agua regresa a los oc�anos y se cierra el ciclo.
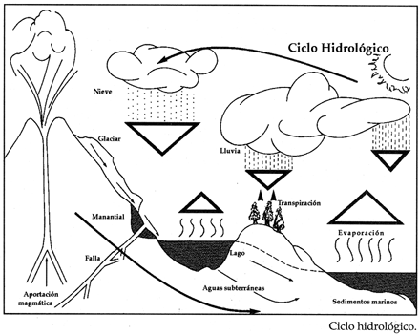
Como se puede apreciar, directa o indirectamente, el agua dulce o salada, a trav�s del ciclo hidrol�gico, es el sustento de la vida y de la estabilidad del planeta.
Propiedades f�sicas
 El agua es inodora, incolora e ins�pida.
El agua es inodora, incolora e ins�pida.
 El agua, a los 0 �C y a 760 mm Hg (1 atm�sfera de presi�n), pasa del estado l�quido al s�lido; a esto se le llama punto de congelaci�n del agua o punto de fusi�n del hielo.
El agua, a los 0 �C y a 760 mm Hg (1 atm�sfera de presi�n), pasa del estado l�quido al s�lido; a esto se le llama punto de congelaci�n del agua o punto de fusi�n del hielo.
 El agua, a los 100 �C y 760 mm Hg (1 atm�sfera de presi�n), pasa del estado l�quido al gaseoso; a esto se le denomina punto de ebullici�n. En la ciudad de M�xico, en donde la presi�n atmosf�rica es menor, el agua hierve a 92.8 �C.
El agua, a los 100 �C y 760 mm Hg (1 atm�sfera de presi�n), pasa del estado l�quido al gaseoso; a esto se le denomina punto de ebullici�n. En la ciudad de M�xico, en donde la presi�n atmosf�rica es menor, el agua hierve a 92.8 �C.
 El agua, a diferencia de otros l�quidos, al aumentar su temperatura (de los 0 �C a los 4 �C) se contrae, alcanzando su mayor densidad a los 4 �C; sin embargo, al bajar la temperatura a 0 �C tambi�n se dilata, por esta raz�n la densidad del agua l�quida a 4 �C es de 1 g/ml y la densidad del hielo a 0 �C es de 1 g/1 .09 ml = 0.917 g/ml, y como el agua es menos densa en estado s�lido que en l�quido, el hielo flota en el agua.
El agua, a diferencia de otros l�quidos, al aumentar su temperatura (de los 0 �C a los 4 �C) se contrae, alcanzando su mayor densidad a los 4 �C; sin embargo, al bajar la temperatura a 0 �C tambi�n se dilata, por esta raz�n la densidad del agua l�quida a 4 �C es de 1 g/ml y la densidad del hielo a 0 �C es de 1 g/1 .09 ml = 0.917 g/ml, y como el agua es menos densa en estado s�lido que en l�quido, el hielo flota en el agua.
 El agua tiene una alta capacidad calor�fica, es decir, se necesita gran cantidad de calor para elevar su temperatura. Por ejemplo, se necesita la misma cantidad de calor para elevar 10 �C la temperatura de 1 kg de agua que para elevar 93 �C la de 1 kg de hierro, o 53 �C la de 1 kg de arena, y de igual manera tarda mucho en enfriarse. Por las propiedades anteriores, el agua se utiliza para enfriar motores y regular la temperatura ambiental en la naturaleza.
El agua tiene una alta capacidad calor�fica, es decir, se necesita gran cantidad de calor para elevar su temperatura. Por ejemplo, se necesita la misma cantidad de calor para elevar 10 �C la temperatura de 1 kg de agua que para elevar 93 �C la de 1 kg de hierro, o 53 �C la de 1 kg de arena, y de igual manera tarda mucho en enfriarse. Por las propiedades anteriores, el agua se utiliza para enfriar motores y regular la temperatura ambiental en la naturaleza.
 El agua disuelve una gran parte de las sustancias existentes, por eso se le denomina solvente universal.
El agua disuelve una gran parte de las sustancias existentes, por eso se le denomina solvente universal.
Propiedades qu�micas
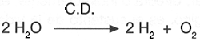
 El agua no se descompone f�cilmente debido a la fuerza de los enlaces covalentes que forman la uni�n de los hidr�genos y el ox�geno; para romperlos se requiere de 2 200 �C, o bien, del paso de una corriente el�ctrica directa y continua (C.D.).
El agua no se descompone f�cilmente debido a la fuerza de los enlaces covalentes que forman la uni�n de los hidr�genos y el ox�geno; para romperlos se requiere de 2 200 �C, o bien, del paso de una corriente el�ctrica directa y continua (C.D.).
 El agua produce una reacci�n violenta al entrar en contacto con metales como el sodio (Na), el potasio (K) el calcio (Ca) y el litio (Li), formando hidr�xidos y desprendiendo hidr�geno y energ�a.
El agua produce una reacci�n violenta al entrar en contacto con metales como el sodio (Na), el potasio (K) el calcio (Ca) y el litio (Li), formando hidr�xidos y desprendiendo hidr�geno y energ�a.
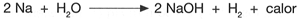
Lo anterior es un bosquejo de las innumerables cualidades y usos de uno de los m�s importantes compuestos que existen en la Tierra: el agua.
�cidos y bases
El vocablo �cido viene del lat�n acidus que quiere decir "agrio" y, el vocablo base, del griego basis que significa "fundamento del compuesto salino". El nombre de base proviene de los primeros experimentos en los cuales se calentaban las sales.
Los �cidos cambian el color de algunos colorantes vegetales de azul a rojo, y las bases los cambian de rojo a azul; por medio de esta propiedad se pueden identificar unas y otras.
Los �cidos reaccionan con las bases en lo que se denomina reacci�n de neutralizaci�n, produciendo una sal y agua. Adem�s, algunos �cidos disuelven ciertos metales.
Las bases (o hidr�xidos) son resbalosas al tacto y su sabor es amargo (parecidas al jab�n).
TABLA DE �CIDOS Y BASES

Actualmente se define a los �cidos y a las bases, de acuerdo con la teor�a de Br�nsted-Lowry, de la siguiente manera:
 �cido es una especie qu�mica que dona iones hidr�geno o protones (H+), en una reacci�n qu�mica y se le conoce como donador de protones.
�cido es una especie qu�mica que dona iones hidr�geno o protones (H+), en una reacci�n qu�mica y se le conoce como donador de protones.
 Base es una especie qu�mica que acepta iones hidr�geno o protones (H+), en una reacci�n qu�mica y se le conoce como aceptor de protones.
Base es una especie qu�mica que acepta iones hidr�geno o protones (H+), en una reacci�n qu�mica y se le conoce como aceptor de protones.
Los �cidos y bases que est�n totalmente ionizados en una soluci�n se denominan �cidos y bases fuertes; los que se ionizan parcialmente se conocen como �cidos y bases d�biles. El concepto de �cido y base d�bil o fuerte no tiene nada que ver con su reactividad; existen �cidos d�biles como el HF (�cido fluorh�drico al 0.1 M, que est� ionizado en 8%) que reacciona en forma muy vigorosa con cualquier sustancia, incluyendo el vidrio.
El agua, que tiene por f�rmula 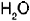 , no es ni �cida ni b�sica sino neutra, es decir, tiene un pH de 7 y sirve c�mo punto de referencia para definir a los �cidos, que tienen un pH que va de 1 a 7, o a las bases, que tienen un pH que va de 7 a 14.
, no es ni �cida ni b�sica sino neutra, es decir, tiene un pH de 7 y sirve c�mo punto de referencia para definir a los �cidos, que tienen un pH que va de 1 a 7, o a las bases, que tienen un pH que va de 7 a 14.
Los �cidos fuertes reaccionan completamente con el agua y forman los llamados iones hidronio 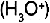 y la base (OH-); los �cidos d�biles no reaccionan completamente con el agua.
y la base (OH-); los �cidos d�biles no reaccionan completamente con el agua.
En el laboratorio, es importante no mezclar soluciones concentradas de �cidos y bases sin las medidas de seguridad convenientes y sin el material adecuado; su reacci�n es sumamente violenta (exot�rmica) y, por lo tanto, quema. De igual manera, al diluir un �cido o una base fuerte con agua, lo adecuado es verter el �cido o la base al agua y no al contrario, porque la reacci�n tambi�n es muy violenta y exot�rmica.
Las sustancias que en ocasiones act�an como �cido y en otras como base se denominan anf�teros; una de ellas es el agua.
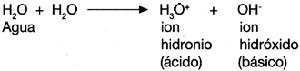
La neutralizaci�n se utiliza para determinar la concentraci�n de los �cidos y las bases en una soluci�n por medio de la acid�metr�a, en el caso de los �cidos; y la alcalimetr�a, en el caso de los bases. El procedimiento se llama titulaci�n y en �l se utiliza una soluci�n problema de concentraci�n desconocida y una soluci�n reactivo de concentraci�n conocida; a �stas se agrega un indicador que determine el punto de neutralizaci�n. Posteriormente, se calcula el n�mero de mililitros de soluci�n de concentraci�n conocida que se usaron para neutralizar la soluci�n problema y se calcula, estequiom�tricamente, a qu� cantidad de sustancia equivale.
Por ejemplo, �cu�ntos ml de Na OH 1 M se necesitan para neutralizar 75 ml de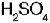 1M , de acuerdo con la siguiente reacci�n?
1M , de acuerdo con la siguiente reacci�n?

Primer paso: determinar el problema
x ml de NaOH = 75 ml de 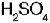
Segundo paso: obtener la relaci�n estequiom�trica de los reactivos en la ecuaci�n
2 moles de NaOH = 1 mol de 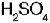
Tercer paso: determinar y realizar la ecuaci�n para solucionar el problema
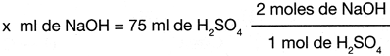
por lo tanto, se necesitan 150 ml de NaOH para neutralizar 75 ml 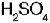 1M
1M
![[ Índice Conceptos Básicos ]](toc.gif)
![[ Previo ]](prevsec.gif)
![[ Nivel Superior ]](parntsec.gif)
![[ Siguiente ]](nextsec.gif)
Conceptos Básicos
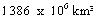 de agua que hay en la Tierra, el 97.3% es oce�nica (agua salada) y el 3.7% corresponde al agua dulce (L�pez, 1985). De este 3.7%, una buena parte se encuentra congelada en los casquetes polares; por ello mismo, la cantidad de agua utilizable por el hombre es realmente peque�a, de tal manera que el ahorro en su consumo es indispensable.
de agua que hay en la Tierra, el 97.3% es oce�nica (agua salada) y el 3.7% corresponde al agua dulce (L�pez, 1985). De este 3.7%, una buena parte se encuentra congelada en los casquetes polares; por ello mismo, la cantidad de agua utilizable por el hombre es realmente peque�a, de tal manera que el ahorro en su consumo es indispensable.

 El agua es inodora, incolora e ins�pida.
El agua es inodora, incolora e ins�pida.

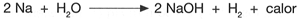

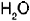 , no es ni �cida ni b�sica sino neutra, es decir, tiene un pH de 7 y sirve c�mo punto de referencia para definir a los �cidos, que tienen un pH que va de 1 a 7, o a las bases, que tienen un pH que va de 7 a 14.
, no es ni �cida ni b�sica sino neutra, es decir, tiene un pH de 7 y sirve c�mo punto de referencia para definir a los �cidos, que tienen un pH que va de 1 a 7, o a las bases, que tienen un pH que va de 7 a 14.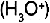 y la base (OH-); los �cidos d�biles no reaccionan completamente con el agua.
y la base (OH-); los �cidos d�biles no reaccionan completamente con el agua.
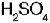 1M , de acuerdo con la siguiente reacci�n?
1M , de acuerdo con la siguiente reacci�n?
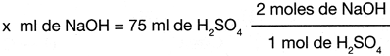
![[ Índice Conceptos Básicos ]](toc.gif)
![[ Previo ]](prevsec.gif)
![[ Nivel Superior ]](parntsec.gif)
![[ Siguiente ]](nextsec.gif)