II. ASPECTOS FUNDAMENTALES DE LA CATÁLISIS Y LOS CATALIZADORES
EL CATALIZADOR, ANIMADOR DE LA FIESTA
EL TÉRMINO catálisis agrupa al conjunto de procedimientos y conocimientos que permiten que la velocidad con la que trascurre una reacción se incremente in-situ. Bajo tal condición la catálisis es una rama de la cinética química.
La cinética química se ocupa del estudio dinámico de las reacciones químicas tomando en cuenta el mecanismo en el nivel molecular de tales transformaciones. El concepto de velocidad de reacción traduce la rapidez con la que en un sistema se produce una transformación química. La reacción química global se lleva a cabo a través de etapas las cuales en su conjunto constituyen el mecanismo de reacción. La velocidad se define en términos de parámetros que pueden ser medidos durante la transformación; así, podemos definirla como la variación de la concentración de uno de los reactivos que desaparece, o de uno de los productos que aparece, en el sistema respecto del tiempo.
Para una reacción química del tipo
la velocidad de la reacción puede representarse como
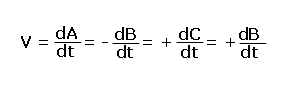
donde ![]() presentan
la variación de la concentración de A, B, C o D respecto del tiempo y
el signo (-) representa la desaparición de reactivos (A o B) y el signo
(+) la aparición de productos (C o D).
presentan
la variación de la concentración de A, B, C o D respecto del tiempo y
el signo (-) representa la desaparición de reactivos (A o B) y el signo
(+) la aparición de productos (C o D).
De manera general, las características de una reacción pueden ser determinadas
si se conoce a cada instante la composición química del sistema. En la mayoría
de las reacciones, la velocidad de transformación es proporcional a la concentración
de reactivos elevados a una potencia; por ejemplo para la reacción
V a [A]p[B]q
, o V = k[A]p[B]q
k = constante de proporcionalidad
p y q = órdenes parciales de reacción
p + q = n = orden global de reacción
Los órdenes de velocidad pueden ser enteros, fraccionarios, positivos, negativos, o aun cero. En general este orden no está relacionado con la estequiometría de la reacción, sino más bien con el mecanismo de la misma.
Para que una reacción química se lleve a cabo, es necesario suministrar una
cierta cantidad de energía a las moléculas de reactivo. Esto puede ser representado
de la manera siguiente para la reacción anterior (Figura 1).
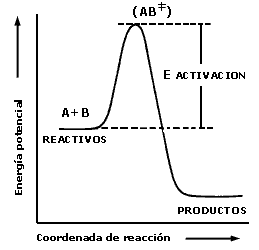
Figura 1. Diagrama de energía potencial para una reacción exotérmica.
Las moléculas de A y B son "activadas" de manera que se favorezca su combinación
para llegar a un cierto "estado de transición" o "complejo activado" (AB
en el diagrama), el cual al descomponerse puede dar lugar a los productos. La
barrera energética que separa los reactivos de los productos se denomina energía
de activación. La velocidad de reacción depende de esa energía de activación
a través de la constante de velocidad (k). Esta constante de velocidad
depende también de la temperatura y la forma matemática de representarla es
a través de la llamada ley de Arrhenius.
|
donde:
|
k
|
= constante de velocidad
|
|
k0
|
= factor preexponencial
|
|
|
Ea
|
= energía de activación
|
|
|
R
|
= constante de los gases ideales
|
|
|
T
|
= Temperatura en grados K
|
De la ecuación de Arrhenius podemos observar que la dependencia de la velocidad de reacción con respecto a la barrera energética (Ea) es inversamente exponencial.
El término k0 o factor preexponencial comprende el número de choques efectivos entre las moléculas de reactivo encontrando su origen en la teoría cinética de los gases. El término exponencial que incluye la energía de activación en la ecuación anterior es mayor que el término preexponencial (k0) siendo por tanto generalmente el factor determinante de la velocidad de una reacción química. En la figura anterior se observa que los productos se encuentran en un nivel energético menor que los reactivos, lo que significa que durante la reacción se ha producido un desprendimiento de energía (generalmente en forma de calor). La reacción en cuestión se denomina entonces exotérmica. Si se hubiera producido el fenómeno inverso la reacción sería endotérmica.
W. Ostwald fue el primero en señalar que la presencia de un catalizador en el sistema de reacción se limita a modificar la velocidad de la transformación. El catalizador no se considera ni reactivo ni producto en la reacción.
Otras definiciones de catalizador son:
- Un catalizador es una sustancia que sin estar permanentemente involucrada en la reacción, incrementa la velocidad con la que una transformación química se aproxima al equilibrio.
- Un catalizador es una sustancia que químicamente altera un mecanismo de reacción así como la velocidad total de la misma, regenerándose en el último paso de la reacción.
Una reacción puede llevarse a cabo en una, dos o tres etapas denominadas elementales,
durante las cuales participan las moléculas de los reactivos. En general, existirá
una etapa más lenta que las otras y será ésta la que determine la velocidad
global de la transformación. Catalizar una reacción implica reemplazar
este paso por varias etapas más rápidas que se llevan a cabo sólo en
presencia del catalizador. Esto significa que la intervención del catalizador
abre un camino nuevo a la reacción, compuesto de reacciones elementales con
energía de activación menor (Figura 2).
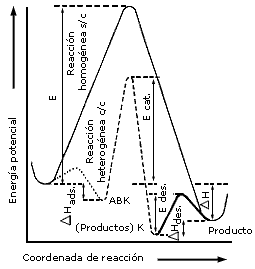
Figura 2. Curva de la energía potencial a lo largo de la coordenada de la reacción para un proceso catalítico heterogeneo.
Podemos analizar el efecto del catalizador utilizando la teoría de colisiones (aunque no es la única forma):
En la figura 2 la reacción sin catalizador entre una molécula gaseosa de A
y una de B se lleva a cabo por el camino marcado con una línea continua de manera
similar a lo ilustrado en la figura 1. Al introducir el catalizador (K),
A y B interaccionan con él, si el catalizador es heterogéneo (sólido),
se dice que A y B se adsorben en la superficie, formando un complejo
superficial ABK inestable (línea punteada). Este complejo superficial
reaccionará al suministrarle energía de manera que formará los productos que
aún quedan fijos (línea de guiones) sobre la superficie. Para sacar los productos
adsorbidos, es necesario otra pequeña energía que nos conduce al estado final
productos +K (doble línea). El proceso homogéneo en una sola etapa ha
sido substituido por tres etapas que son:
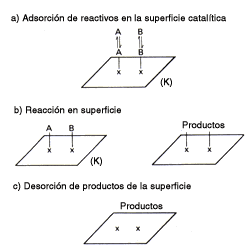
En estos esquemas los signos x representan los "sitios activos" del catalizador.
En el esquema de la figura 2 el aumento en la velocidad de la reacción (número
de moléculas de A o B transformadas por unidad de tiempo) es proporcional
a la diferencia entre E-Ecat.
La teoría de las colisiones explica que la velocidad de una reacción química es función del número de choques que se efectúan entre las moléculas de reactivos con determinada energía. Imaginemos un recipiente cerrado en el cual introducimos dos gases, A y B, a temperaturas bajas las moléculas se mezclan homogéneamente en función de sus densidades; así si los dos gases son ligeros, como N2 y O2 la composición será la misma en cualquier punto. Si calentamos este recipiente las moléculas aumentan su energía y en consecuencia se llevarán a cabo un mayor número de choques dentro del recipiente. A una temperatura determinada la fuerza y el número de choques es tal que las moléculas de A y B tenderán a disminuir y a la vez un nuevo tipo de moléculas aparecerán (los productos). El número de moléculas de A y B o las nuevas que aparecen por combinación de A y B están ligadas a través de la estequiometría y el mecanismo de la reacción. Si llamamos a la velocidadde la reacción:
rA = rB , a [A] [B]
entonces la velocidad de aparición (o desaparición de A o B) de las nuevas moléculas es función del número de choques entre A y B, los cuales a su vez dependen de la concentración de A y B.
La estequiometría de reacción es el mecanismo de reacción, la secuencia de pasos que determina la reacción.
Si consideramos por simplicidad una reacción catalítica heterogénea, el número de colisiones (Z) en cuestión será el número de colisiones en la unidad de tiempo entre el reactivo y el sitio catalítico o especie catalítica. El número de estas colisiones será mucho menor, aproximadamente 1012 veces, que el número de colisiones entre moléculas de reactivo. Este último tiene gran importancia para la reacción no catalizada pero es irrelevante para la transformación catalítica. Así pues, para que la reacción catalítica compita efectivamente con la reacción no catalizada, su término preexponencial deberá ser 1012 veces más grande, lo cual se compensa con una disminución en la energía de activación de al menos 65 KJ/mol. Esta diferencia de 65 KJ/mol en la energía de activación sólo permite igualar las velocidades de la reacción no catalizada; sin embargo, las diferencias típicas observadas exceden los 100 KJ/mol lo que permite imaginar que el aumento de velocidad es realmente sustancial.
Las principales características que distinguen a un catalizador son:
a) Un catalizador no puede actuar en reacciones termodinámicamente imposibles (DGo>0). Esto literalmente significa que un catalizador no hace milagros. De la misma forma que la termodinámica establece que no puede existir la máquina de movimiento perpetuo, también delimita el campo de acción de los catalizadores.
b) Para una reacción en equilibrio,
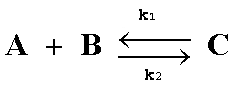
el catalizador no modifica el valor de la constante de equilibrio Ke=![]() .
Como consecuencia de lo anterior, un aumento de la velocidad en una dirección
es acompañado por un aumento similar en la constante de velocidad de la reacción
inversa (k2). En un sentido práctico esto quiere decir que un catalizador de
una reacción lo es igualmente para la reacción inversa.
.
Como consecuencia de lo anterior, un aumento de la velocidad en una dirección
es acompañado por un aumento similar en la constante de velocidad de la reacción
inversa (k2). En un sentido práctico esto quiere decir que un catalizador de
una reacción lo es igualmente para la reacción inversa.
Esta condición se aplica igualmente al mecanismo catalítico bajo el principio de microrreversibilidad que dice que la reacción debe seguir los mismos pasos en un sentido o en el otro.
c) El catalizador puede tener uno o dos efectos sobre un sistema, un
efecto acelerador o un efecto orientador. En el segundo caso, la función catalítica
se observa en la variación de los valores de selectividad de un proceso cuando
varias direcciones son termodinámicamente posibles. Así por ejemplo, el alcohol
etílico puede descomponerse según las reacciones siguientes
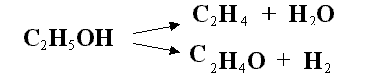 |
I
II |
La utilización de óxido de zinc como catalizador conduce casi exclusivamente a la reacción I. Si se emplea cobre como catalizador, la reacción II se produce en mayor extensión.
¡El hecho de que el catalizador abra una nueva ruta de reacción también se puede traducir en que la reacción llegue a otro lugar diferente del que deseábamos!
En general esto se corrige estudiando muchos catalizadores de los cuales escogemos el que mejor nos rinde el producto deseado.
d) El catalizador tiene una vida limitada, sin embargo, en lapsos cortos, se puede decir que permanece inalterado; esta característica es de suma importancia para estudios cinéticos.
El número de moléculas que transforma un catalizador por cada sitio catalítico (número de rotación) generalmente es muy elevado (10-2 a 10 moléculas por sitio y por segundo), lo cual hace que al cabo de algunas horas el sitio catalítico haya sido usado miles de veces. En algunos procesos industriales la vida útil del catalizador puede ser de varios años para transformar una molécula de reactivo. Algunas veces esas moléculas que reaccionaron no salen de la superficie, cubriéndola y provocando una disminución del número de sitios activos.
Existen algunas sustancias que tienden a "frenar" las reacciones a través de un efecto llamado "inhibición", sin embargo, estas especies cinéticamente activas no son especies catalíticas, no se trata de un fenómeno catalítico en sí, ya que no se ponen en juego el mismo tipo de factores energéticos. Esto significa que no existe una catálisis negativa.
Un ejemplo experimental sencillo de la acción de un catalizador en fase homogénea gaseosa es el de la descomposición del éter etílico (comúnmente éter).
La reacción sin catalizador a 700ºK da lugar a los siguientes productos:
se midió para esta reacción una energía de activación (barrera de energía para pasar de reactivos a productos) de 51.8 kcal/mol.
Posteriormente bajo las mismas condiciones se introdujo iodo como catalizador,
observándose que la desaparición del éter etílico fue 10 000 veces más rápida,
generando productos diferentes a los obtenidos en la reacción sin catalizador.
La reacción con el catalizador fue:
|
C2H5OC2H5
à |
|
| Etano | |
con una energía de activación de 34.0 kcal/mol de manera que la presencia de
iodo cambió la velocidad y la selectividad (orientación) de la reacción. El
aumento en la velocidad debe relacionarse con la disminución en la barrera de
energía que separa los reactivos de los productos y que bajó a 34 kcal/mol en
presencia del Catalizador: como las dos reacciones se efectuaron en condiciones
similares se pueden relacionar sus velocidades a partir de las ecuaciones de
Arrhenius:
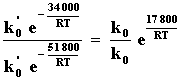
de donde se observa que el aumento en velocidad depende de k0 y k'0 y es exponencialmente proporcional a la diferencia en energías de activación. Si se asume que k0 y k0' son iguales, entonces el aumento que debería observarse es de 345 000 veces. Este no es el caso, ya que sólo se observó un aumento de 10 000 veces, por lo tanto hay un factor 34.5 menor que debe ser atribuido a la diferencia en las constantes k y k'0. De acuerdo a la teoría cinética de los gases esas constantes dependen del número de choques entre las moléculas de reactivo en el momento de la reacción; en el caso de la reacción sin catalizar es el número de choques entre moléculas de éter etílico, y en el caso de la reacción catalizada es el número de choques de las moléculas de éter etílico con el iodo.
Como la concentración de catalizador es muy baja (aproximadamente 1%)
el número de choques es menor para la reacción catalizada, y por eso es que
se presenta el factor 34.5 favorable a la reacción sin catalizador:
Sin embargo esta disminución en el número de choques efectivos se ve ampliamente compensada por el abatimiento en la energía de activación que al encontrarse en el término exponencial conduce a un aumento de 345 000 veces en la velocidad. Así el aumento neto observado por la presencia del catalizador es de 10 000 veces.
En la práctica este aumento de velocidad en presencia del catalizador es aprovechado para obtener la misma velocidad, o ligeramente superior, pero a temperaturas mucho más bajas que las utilizadas en el caso de la reacción sin catalizador.
Adicionalmente, lo que resulta en ocasiones mucho más valioso, es que por acción del catalizador se obtienen productos que no pueden obtenerse de otra forma.
Clasificación: De acuerdo con las condiciones en las que se llevan a cabo las reacciones es posible separar el fenómeno catalítico en tres dominios independientes.
a) Catálisis homogénea: Donde todas las especies cinéticamente activas, comprendido el catalizador, constituyen una misma fase, con una velocidad de reacción similar en todos los puntos. Se considera también en esta rama el caso en que uno de los reactivos es un gas y que los otros, con el catalizador, pertenecen a una misma fase líquida. Debido a la solubilidad del gas la transformación se produce en todo el líquido y no en la interfase gas-líquido. La naturaleza de los productos tampoco influye. En este tipo de catálisis las velocidades son generalmente elevadas, los venenos inofensivos y la posibilidad de estudio de mecanismos de reacción más fácil para poder aislar las especies intermedias.
b) Catálisis heterogénea: El catalizador es insoluble en los sistemas químicos en los cuales provoca la transformación y forma una fase distinta muy a menudo sólida. Existen dos fases y una superficie de contacto. La reacción se lleva a cabo en esta superficie de contacto y el fluido es una reserva de moléculas por transformar o que ya reaccionaron.
Como la reacción química se pasa en dos dimensiones, al menos uno de los reactivos debe ser adsorbido químicamente. La catálisis heterogénea está limitada al estudio de reacciones provocadas en las moléculas por el campo de fuerza del sólido y se limita a algunos angstroms. Debe hacerse notar que la mayor parte de catalizadores sólidos son metales, óxidos, sulfuros metálicos o sales (sulfatos silicatos, fosfatos) con alta energía reticular.
c) Catálisis enzimática: Que recibe su nombre del catalizador, que es una mezcla o molécula orgánica que generalmente contiene una proteína que forma un coloide liofílico. Dada la naturaleza particular del catalizador, la catálisis enzimática no pertenece clara y definitivamente al dominio de la catálisis homogénea. Está caracterizada por selectividades muy elevadas y bajas temperaturas.
Se puede afirmar con base, que sin la catálisis enzimática no sería posible la vida. Es suficiente decir que el proceso base de la actividad vital, la asimilación del CO2 por la clorofila de las plantas es un proceso fotoquímico y catalítico. La transformación por las células, de albúminas, grasas carbohidratos así como la síntesis de otras moléculas son catalíticas. La formación de las cadenas de RNA, que es la base del código genético depende de la presencia de ciertas enzimas.
La actividad catalítica de las enzimas es muchísimo mayor que los catalizadores inorgánicos:
1 mol de alcohol hidrogenasa transforma por segundo 720 moles de alcohol en ácido acético a 25°C mientras que a 200°C los catalizadores industriales (Pt, platino) transforman 0.l - l mol de alcohol por mol de catalizador.
A 0°C la catalasa descompone 200 000 moles de H202
por mol de enzima y por segundo en tanto que el inorgánico más activo (Pt, platino)
descompone a 20°C, 10-80 moles de H202
por mol de catalizador por segundo.