III. CATÁLISIS HOMOGÉNEA
EN EL sentido más amplio del término, la catálisis homogénea tiene lugar cuando los reactivos y el catalizador se encuentran en la misma fase, sea líquida o gaseosa. En la catálisis homogénea se tiene un acceso más fácil al mecanismo de reacción y por consecuencia se puede dominar mejor el proceso catalítico correspondiente. Otra ventaja no menos despreciable de este tipo de catálisis es la ausencia de efectos de envenenamiento tan frecuentes en el caso de la catálisis heterogénea, y que obliga a tratamientos costosos de eliminación de impurezas. Finalmente, el último impulso que han dado los complejos organometálicos a la catálisis homogénea ha sido decisivo en su aplicación industrial a gran escala.
Tanto en el estudio como en la aplicación de una catálisis homogénea en solución no se debe perder de vista que la velocidad no depende directamente de sus concentraciones sino de sus actividades, ya que la presencia de especies ajenas al acto catalítico puede influenciarlas. Así por ejemplo se observa a menudo que al cambiar el solvente la velocidad de reacción se ve afectada esto se explica muy a menudo por un efecto de solvatación o interacciones electroéstáticas.
La catálisis homogénea por complejos mononucleares de metales de transición ha tenido un impulso industrial importante en los últimos 20 años debido a que al emplear estos procesos es posible obtener altos rendimientos, así como productos de alta pureza. Algunos de los procesos más importantes en su aplicación industrial que utilizan complejos organometálicos son:
1) Proceso oxo o reppe de carbonilación de olefinas: ácido acético.
2) Polimerización de olefinas: polietileno
3) Adición de olefinas: polibutadieno
4) Oxidación de olefinas: óxido de propileno
5) Oxidación de alcanos y arenos: ácido tereftálico, adípico
6) Polimerización-condensación: fibra de poliéster.
Estas reacciones catalíticas presentan la particularidad de proceder a bajas temperaturas con selectividades elevadas, esto se logra mediante la selección adecuada del metal de transición, de los ligandos, del disolvente y de las condiciones de reacción. Esto es reflejo nuevamente del conocimiento mecanístico que caracteriza a la catálisis homogénea y que permite optimizar el proceso conociendo los ciclos catalíticos completos.
Uno de los inconvenientes de la catálisis homogénea es la dificultad de separar el catalizador del medio reaccionante, lo que presenta un mayor costo que el de los procesos heterogéneos convencionales.
Con base en esta inconveniencia se han intentado diseñar "catalizadores homogéneos soportados", en los cuales se desea inmovilizar el complejo metálico activo sobre un soporte como sílice, alúmina o carbón. Sin embargo en muchos casos esto no es posible, ya que la entidad catalítica activa no es el complejo inicialmente introducido a la reacción, sino una especie derivada de él. La catálisis homogénea en solución (fase líquida) ha sido objeto de numerosos estudios y dentro de ella la catálisis ácido-base tiene un lugar muy importante.
La catálisis ácido-base fue de los primeros fenómenos catalíticos observados por investigadores como Ostwald, Arrhenius, Brönsted, Euler, etc. La constatación de que la presencia de un ácido aceleraba u orientaba ciertas reacciones químicas fue el inicio para una serie de investigaciones realizadas a fines del siglo pasado e inicios de éste, que se tradujeron en una serie de numerosas aplicaciones industriales como la esterificación, la saponificación, la hidrólisis, la halogenación, la condensación, etc.
En la catálisis ácido-base se agrupan todas las observaciones relacionadas con la presencia en el medio acuoso de algunas especies como protones (H+), oxhidrilos (OH-), moléculas de ácido, etcétera.
Cuando se disuelve un ácido como el clorhídrico (que es la base del muriático)
en agua, se produce una disociación como la siguiente:
en la cual la molécula de agua atrapa el átomo de hidrógeno del ácido (al cual llamamos protón por haber perdido un electrón a favor del cloro) produciéndose iones. Una situación equivalente se produce cuando ponemos en solución una base como hidróxido de sodio (sosa):
produciéndose iones sodio y oxhidrilos.
Cuando los ácidos o las bases se disocian completamente se les llama fuertes; al contrario, cuando sólo se disocian poco se les llama débiles. En este último caso el número de moléculas de ácido o base es mayor al número de especies disociadas.
Algunos ácidos fuertes son el HCl o ácido clorhídrico, el H2S04 o ácido sulfúrico, el HF o ácido fluorhídrico etc. Como bases fuertes tenemos la sosa o hidróxido de sodio (NaOH), la potasa o hidróxido de potasio (KOH) y la solución de amoniaco o hidróxido de amonio (NH4OH). Recordemos que una medida de la acidez o la basicidad se puede dar en función del pH (potencia de hidrógeno). Valores de pH elevados (10 a 14) son para bases fuertes, el valor de 7 corresponde a la neutralidad (agua destilada y deionizada), y valores bajos (1 a 4) son para los ácidos fuertes.
En una reacción en solución algunas de estas especies pueden estar presentes y jugar un papel como catalizadores, dependiendo del tipo de reacción. Cuando alguna reacción es catalizada por el ion (H- o H3O-) se le llama una catálisis ácida, por el contrario cuando el ion (OH-) es el catalizador se le llama catálisis básica. Para poner en evidencia esta dependencia es suficiente llevar a cabo experimentos en los cuales se trabaje con cantidades crecientes de ácido o de base, y la reacción debe seguir un aumento de velocidad lineal con la concentración de ácido o de base. En términos cinéticos esto se escribe:
velocidad observada = ko +k
[H30+]
+ [H30+],
para el ácido,
[OH-] [OH-], para la base En estas dos ecuaciones ko representa la velocidad de la reacción en ausencia de especies catalíticas.
Cuando la ley de velocidad de una reacción catalizada en solución acuosa depende únicamente de las concentraciones de iones hidronio y oxhidrilo representados por [H3O+] y [OH-] respectivamente, se dice que las reacciones son ejemplos de catálisis específica.
En la actualidad, sin embargo, ha sido reconocido a la luz de las teorías modernas sobre electrolitos que las moléculas no disociadas contribuyen también al efecto catalítico. Tales reacciones se rigen por la teoría de la catálisis ácido-base general. De la misma forma en que se escribieron las ecuaciones de velocidad para el H+ o el OH- se pueden escribir ecuaciones para la molécula de ácido (AH) y la de base (BOH):
'velocidad observada = ko + KAH
[AH] para el ácido, y
'velocidad observada = k'o
+ KBOH [BOH] para la base.
Si tenemos una reacción en la cual no sabemos cual es la especie catalítica, podemos llevar a cabo experiencias para determinar la contribución de cada especie en solución, esto corresponde en la práctica a cambiar el pH de la reacción.
Se puede proponer que tenemos una ecuación general de velocidad que agrupa
a todas las especies:
velocidad = ko + kH3O+
[H30+] + k0H-
[OH-] + k AH
BOH
[BOH] y de la cual iremos evaluando los términos separadamente.
El valor de ko se determina frecuentemente por la habilidad que el solvente (agua) tiene para catalizar la reacción. Para evaluar las constantes de velocidad de la ecuación II, se hacen experimentos en condiciones tales que algunos de los términos de la ecuación II sean despreciables. De esta manera variaciones sistemáticas de [HA], [A-], [H3O-], [OH-], etc., conducen a la evaluación de cada constante de velocidad.
Por ejemplo, si trabajamos en condiciones ácidas (pH<7) utilizando un ácido fuerte (totalmente disociado) y cuyo anión no interfiera apreciablemente, la ecuación II toma la forma:
|
kobs
= ko + k
H3O+
[H30+] |
III
|
Cuando la reacción es catalizada únicamente por una base (PH>7), la ecuación
II se transforma en
|
k
obs
= ko + k0H-
[OH-] |
IV
|
El comportamiento de estos experimentos puede ser representado en forma gráfica
en un diagrama de pH contra log de la velocidad, como se muestra en la figura
3:
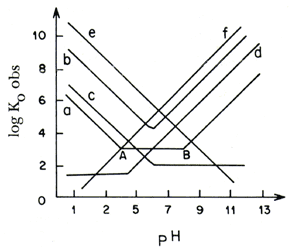
Figura 3. Dependencias típicas de constantes de velocidad de reacciones catalizadas por ácidos o bases, en función de la concentración de protones.
a) Caso general, donde la reacción es catalizada tanto por ácidos como por bases. La horizontal AB corresponde a la reacción no catalizada o bien catalizada por el solvente. Ejemplo de este caso son la mutorrotación de la glucosa y la hidrólisis de los ésteres.
b) En este caso el segmento AB no existe, lo que implica que la reacción no catalítica (ko) no existe, es decir, no hay efecto del solvente. Como ejemplos podemos citar la hidrólisis de amidas, y la halogenación de cetonas.
c y d) Reacciones catalizadas únicamente por ácidos (c) o bases (d). Ejemplos para (c): la hidrólisis de orto-sales y (d) hidrólisis de B-lactonas.
e y f) El mismo caso de (c) y (d) sólo que en ausencia de la influencia del solvente, ejemplos: la hidrólisis del éster diazoacético y la pólimerización de nitrosoacetonamina.
En los casos en que existe catálisis específica por el protón o el oxhidrilo, se ha propuesto que el mecanismo catalítico comprende la transferencia de esos iones a las moléculas de reactivo, de forma similar a como se transfieren en presencia de agua.
Por ejemplo, para un ácido su ecuación de disociación sería:
|
KA
|
|
|
AH + H2O
|
|
En esta ecuación la constante de equilibrio KA,
también llamada de disociación, es una medida de la facilidad de ceder el protón;
esta constante está definida por la ley de acción de masas o de equilibrio dinámico
como:
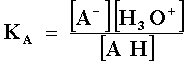
de manera que mientras más se disocia el ácido AH, mayor es la constante, y mayor la fuerza ácida.
De forma similar para el caso de una base tendremos una constante de equilibrio
KB que nos
representará la fuerza básica.
La confirmación del mecanismo catalítico como una transferencia iónica de especies H+- o OH- del catalizador a los reactivos fue dada por los experimentos de Brönsted que demostraron para diferentes reacciones una sola ecuación que relaciona la velocidad con la fuerza ácida o básica.
La ecuación de Brönsted tiene la forma
KHA = GAkaA
donde Ga y a son constantes, a pudiendo tomar valores de 0 a 1. De manera similar para una reacción catalizada por una base tenemos,
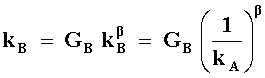
donde kB,
GB
y b son constantes que dependen
del sustrato, es decir, del reactivo y del solvente. Muchos experimentos han
mostrado que las relaciones de Brönsted, sin ser completamente generales, dan
cuenta de gran número de hechos experimentales que abarcan un gran intervalo
de valores constantes de disociación en diferentes solventes.
En años más recientes el término catálisis homogénea se ha aplicado más específicamente al uso en solución de ciertos compuestos organometálicos en los cuales un átomo central está rodeado por átomos o moléculas dispuestas en un patrón regular.
Estos átomos o moléculas se denominan Ligandos, y en función de su naturaleza química, el átomo central al que rodean puede estar en un estado de valencia positivo, negativo o cero. En solución, estos compuestos pueden presentar diferentes estructuras en equilibrio, las cuales pueden tener reactividades diferentes, pero dado que todas las especies se encuentran disueltas en el medio de reacción, es difícil poder establecer por separado su influencia catalítica.
Las reacciones que tienen interés industrial son principalmente la hidroformilación, la carbonilación y la polimerización. Los catalizadores homogéneos son también efectivos para hidrogenaciones e isomerizaciones. Un proceso desarrollado recientemente sintetiza ácido acético (CH3COOH) a partir del metanol (CH3OH) y CO utilizando un complejo de rodio activado por HI, que cataliza la reacción llamada de inserción
Al utilizar este complejo de rodio las condiciones de reacción son más suaves, 150 a 200°C de temperatura y presiones de 1 a 4 MPa. Anteriormente se usaba un catalizador de cobalto que operaba a presiones más elevadas de 20 a 30 MPa y temperaturas de 230°C.
Otro ejemplo de reacciones catalizadas en fase homogénea involucra sistemas Redox (reducción-oxidación). El proceso llamado Wacker para oxidar etileno a acetaldehído es un buen ejemplo. La reacción se lleva a cabo en una solución acuosa que contiene cloruro de paladio y cloruro cúprico. La especie catalítica es el ión Pd2*: Las reacciones que llevan a cabo son las siguientes:
|
C2H4
+ PdCl2 + H2O
|
I
|
|
Etileno +cloruro de
paladio11111 acetaldehído1111111
+ paladio
|
Esta reacción es el paso catalítico de oxidación en el cual el cloruro de paladio
oxida al etileno, pero se reduce el mismo a paladio cero. Por lo tanto se requiere
regenerar el Pd2* por lo cual se introduce la siguiente etapa:
|
1H2O11
|
II
|
|
2CuCl2
+ Pd°
|
|
|
cloruro cúprico111111111cloruro
cuproso11
|
cloruro cúprico cloruro cruposo
En esta reacción el mayor potencial de oxidación del paladio (Pd°) hace
que tome cloro del cloruro cúprico, generando cloruro cuproso. Sin embargo,
la presencia de cloruro cúprico también tiene un efecto catalítico sobre el
etileno dando lugar a la etapa:
|
PdCl2111111111111
|
III
|
|
C2H4
+ 2CuCl2 + H2O
|
|
|
|
Finalmente se debe regenerar el cloruro cúprico en presencia del HCl:
|
2CuCl + 2HCl + 1/2O2
|
IV
|
La reacción global se representa
C2H4 + ½O2
La reacción I involucra la formación de un complejo de paladio intermediario con el etileno.
A priori no existen lineamientos para indicar cuando un proceso catalítico
homogéneo en fase líquida será más económico que un proceso catalítico heterogéneo
en fase gas para un mismo producto de reacción. Algunos factores como la selectividad,
el control mismo de la reacción y la separación de productos y catalizador son
tomados en cuenta para decidirse por uno u otro proceso.