IV. CATÁLISIS ENZIMÁTICA
LAS reacciones químicas que ocurren en los sistemas vivientes son tan variadas como complejas. Sin embargo, la naturaleza provee velocidades de reacción en condiciones por demás suaves, que harían avergonzar al mejor químico. La mayoría de las reacciones que ocurren en los sistemas vivos son catalizadas por proteínas conocidas con el nombre de enzimas. Cientos de enzimas han sido aisladas y probablemente existen cientos de miles en la naturaleza. Su estructura es muy compleja, y puede ser representada como se muestra en la figura 4.
Las enzimas reciben su nombre en función de su actividad específica, así, por
ejemplo, la enzima "ureasa" cataliza con eficiencia la hidrólisis de la urea,
las proteasas actúan sobre las proteínas, las amidasas sobre las amidas, etc.
Todas las enzimas desde el punto de vista químico son proteínas, pero pueden
asociarse con substancias no proteínicas, llamadas coenzimas o grupos prostéticos,
que son esenciales para la acción de la enzima. A veces las enzimas son inactivas
catalíticamente, si no se encuentran en presencia de ciertos iones metálicos.
A la luz de muchos estudios se ha logrado establecer que no toda la molécula
de proteína presenta actividad catalítica, sino únicamente una región relativamente
pequeña, la cual se denomina centro activo. Los mecanismos de reacción
de las enzimas son muy complejos, implicando un número de etapas elementales
cada una de las cuales puede incluir interacciones complejas entre varios grupos
de las moléculas de la enzima y el sustrato. En las reacciones catalizadas por
enzimas las velocidades de reacción, así como los mecanismos se ven afectados
por cambios en la concentración, el pH y la temperatura.
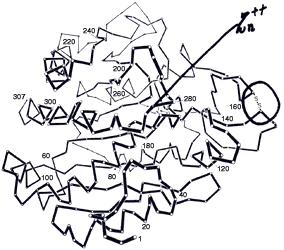
Figura 4. Estructura cristalina de la carboxipeptidasa A.
En la elucidación de los mecanismos de reacción de las enzimas, y principalmente aquellas que involucran un ion-metálico o metaloenzimas, se requiere conocer: 1) La afinidad de los reactantes, las coenzimas y los cofactores; 2) Las constantes de velocidad para cada paso; 3) Las relaciones geométricas tridimensionales entre los reactantes, las coenzimas en relación a los sitios catalíticamente importantes de la enzima; y 4) el mecanismo de cada paso, es decir los arreglos atómicos y electrónicos. El mecanismo químico está determinado por el tipo de rompimiento y formación de enlaces que lleva a cabo la enzima.
Se ha propuesto que las enzimas contienen en sus "centros activos" ácidos (AH) o bases (B) de manera que se puede calcular su fuerza ácida o básica. Así la pepsina, enzima que cataliza la hidrólisis de ciertos enlaces pépticos en el estómago, tiene un valor de fuerza ácida (pK) de 2.2. El único grupo orgánico que puede dar este valor es el COOH-. También hay enzimas con caracter básico como la quimotripsina y la colinesterosa con un pK=7.2.
El hecho de que puedan existir esos dos tipos de grupos ácidos y básicos al mismo tiempo es posiblemente la explicación química del efecto tan selectivo observado en la catálisis por enzimas, ya que el ataque simultáneo por las dos especies ácida y básica debe traducirse en una mejoría muy notable de la velocidad y la selectividad, con un mecanismo que podría llamarse de "estira y afloja". El equivalente en catálisis heterogénea podría ser un mecanismo bifuncional (que comprende dos funciones con dos tipos de sitios diferentes), con la salvedad de que en la enzima los dos activos pueden actuar sobre la misma molécula al mismo tiempo y en la heterogénea esto no es posible.
La complejidad de la estructura de las enzimas se puede comprender al observar la estructura básica de la carboxipeptidosa A, que es una molécula relativamente simple con un peso molecular de 36 400 (existen enzimas de peso molecular de 600 000), su estructura obtenida por microscopía electrónica se muestra en la figura 4.
La enzima es ligeramente elipsoidal de dimensiones 50 X 42 X 38 Angstroms. En esta estructura se pueden ver un enlace azufre-azufre en el extremo derecho, y un átomo de zinc (Zn2+) en el centro, alrededor del cual se sitúa el "sitio activo". El ion Zn2+es absolutamente esencial para la actividad enzimática de la carboxipeptidosa A. Sin embargo se puede cambiar ese ion por otros iones metálicos como Mn2+, Fe2+, Co2+, Ni2+, etc., cambiándose tanto la actividad como la selectividad de la enzima.
Las velocidades de las reacciones catalizadas por enzimas son en general proporcionales a la primera potencia de la concentración de la enzima (son de primer orden respecto a la enzima). Sin embargo, es frecuente encontrar una dependencia de la concentración del sustrato (sobre el que actúa la enzima), como se muestra en la figura 5. La velocidad varía linealmente con la concentración de sustrato a concentraciones bajas (primer orden respecto al sustrato) y se hace independiente de la concentración de éste (orden cero) a concentraciones elevadas. Este tipo de comportamiento fue explicado por Michaelis y Menten en función del mecanismo siguiente:
1. Interacción de la enzima con el substrato (reactivo), para formar un complejo
intermediario
|
11 k1
|
|
E1+1S1
|
|
xxxk-1
|
2. Descomposición del complejo intermediario para dar los productos y regenerar
la enzima
|
k2111
|
|
E1S
|
E es la enzima, S el sustrato, ES un complejo y P es el producto. Aplicando
el tratamiento cinético denominado del estado estacionario, en el que se asume
que la concentración del complejo intermediario es constante obtenemos
|
K1[E] S - k_1
[ES] - K2[ES] = 0
|
I
|
Si la concentración total de la enzima [E]o es igual a la suma de la concentración en enzima libre [E], más la concentración de enzima que forma el complejo [ES]:
|
[E]o
= [E] + [ES]
|
II
|
Introduciendo [E] de la ecuación II en la ecuación I, tenemos:
K1 ([E]o - [ES]) [S] - (K_1 + K2)[ES] = 0
de donde podemos obtener la concentración de enzima que está formando el complejo
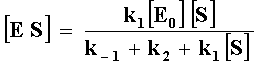
Se asume que la etapa determinante de la reacción es la descomposición del
complejo, entonces la velocidad de la reacción es v=k2[ES]
en donde se substituye [ES]
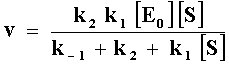
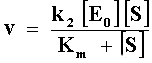 |
III
|
donde km =
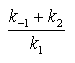 se denomina
constante de Michaelis.
se denomina
constante de Michaelis.
De la ecuación III se deduce que cuando [S] es suficientemente pequeña,
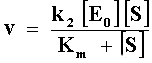
lo que indica primer orden respecto a la concentración de sustrato. Por el
contrario, cuando [S] es mucho mayor que Km,
y la cinética es orden cero respecto al sustrato. En ambos casos el orden es b>1 para la concentración de enzima. La ecuación III da cuenta entonces del comportamiento observado en la figura 5.
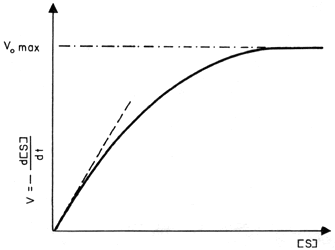
Figura 5. Dependencia típica de la velocidad de una reacción enzimática como función del sustrato S.
Muchas reacciones obedecen la ley de Michaelis (ecuación III), sin embargo, el mecanismo queda aún en la duda ya que a través de otro mecanismo complejo es posible llegar a la misma ecuación cinética.
El efecto del cambio de pH en las velocidades de las reacciones catalizadas
por enzimas se puede observar en la figura 6. Se tiene un máximo y la primera
explicación de este hecho fue dada por Michaelis. La idea básica es que el centro
activo de la enzima puede existir en tres estados de ionización dependiendo
de la fuerza ácida,
|
zzzKb ka
|
|
EH2
|
Las constantes de disociación se representan por kb y ka. Cada una de las tres
formas de la enzima puede interaccionar con el sustrato,
|
zzzKb
ka
|
|
EH2
|
Si se postula que sólo EHS puede dar productos, el esquema de reacción queda
entonces
|
EH2
|
||||
|
|
|
|||
|
EH2S
|
EHS
|
|
ES | |
|
|
K2
|
|||
|
EH
|
+ P
|
|||
Así, en solución ácida, la enzima estará en la forma EH2 y formará con el reactivo el complejo EH2; este complejo se descompone para dar otro complejo EHS, el cual a su vez se descompone para dar los productos y luego entonces la velocidad será pequeña (lado izquierdo de la figura 6). Si la solución es básica predominan las formas E y ES y la velocidad será también pequeña. A cierto pH intermedio, llamado pH óptimo, se observará la concentración máxima de EHS y será por lo tanto el máximo de la velocidad.
Los estudios sobre velocidades de reacciones catalizadas por enzimas a diversos
valores de concentraciones y pH han permitido obtener los valores de las constantes
de disociación ka, kb, k'a y k'b. Las dos primeras corresponden a información
sobre la naturaleza del centro activo. Por ejemplo, la pepsina, enzima que cataliza
la hidrólisis de ciertos enlaces peptídicos en el estómago tiene un pK = 2.2,
siendo el único grupo orgánico conocido que puede dar este valor el grupo carboxilo
(-COOH), concluyéndose que esta enzima trabaja en condiciones muy ácidas equivalentes
a las de un ácido acético (principal constituyente del vinagre).
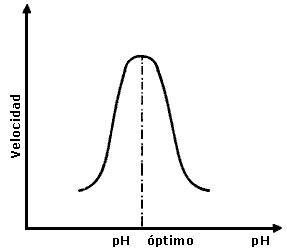
Figura 6. Variación de la velocidad en función del pH, para una reacción enzimática.
Los valores de k'a y k'b proporcionan información respecto de la forma en que los grupos ionizantes del centro activo tienen interacción con el sustrato.
La influencia de la temperatura en la velocidad ha suministrado información
valiosa acerca de los mecanismos enzimáticos. Sin embargo, una complicación
surge del hecho de que las enzimas por sí mismas experimentan un proceso de
desactivación que tiene una energía de desactivación muy alta, por lo que a
35°C o más (dependiendo de la enzima) se puede observar una desactivación muy
rápida. Por ello es frecuente encontrar que las velocidades catalizadas por
enzimas pasan por un máximo al ir subiendo la temperatura. A 60°C por ejemplo,
muchas propiedades de la enzima se alteran, algunas de ellas irreversiblemente.
Estos cambios se conocen con el nombre de desnaturalización y son los
responsables del decrecimiento de la actividad de la enzima.
TABLA 1. Efecto catalítico de algunas enzimas para diferentes reacciones.
|
|
|||||
|
Reacción
|
Catalizador
|
T° C
|
k
|
k0
|
E Kcal/mol |
|
|
|||||
| Hidrólisis de la urea | H3O+ | 62.0 | 7.4X10-7 | 1.8X1010 |
24.6
|
|
"
|
ureasa | 20.8 | 5.0x106 | 1.7x1013 |
06.8
|
| Hidrólisis de trifosfato de adenosina | H3O+ | 40.0 | 4.7x10-6 | 2.4x109 |
21.2
|
|
"
|
miosina | 25.0 | 8.2x106 | 1.6x1022 |
21.1
|
| Descomposición del H2O2 | Fe++ | 22.0 | 56 | 1.8x109 |
10.1
|
|
"
|
catalasa | 22.0 | 3.5x107 | 6.4x108 |
01.7
|
|
|
|||||
En la tabla 1 se dan los valores de las constantes de velocidad, energías de
activación y factores preexponenciales de tres reacciones catalizadas por enzimas
y se incluyen a título de comparación los valores de otros catalizadores.