II. LA HISTORIA DEL ÁTOMO: DE LOS GRIEGOS A FARADAY Y MAXWELL
EN EL siglo V a. C., los griegos sugirieron que la
materia está compuesta de partículas elementales indivisibles. Su intención
era explicar las propiedades de la inmensa variedad de sustancias encontradas
hasta entonces con base en las de un número reducido de materiales elementales.
La esencia de estas sustancias, pensaban ellos, se encontraba presente aun en
la cantidad más pequeña que se pudiese obtener: los átomos (atomo=
indivisible).
Los antiguos griegos también intentaron entender la naturaleza de la luz y de la electricidad, sin sospechar su conexión con la estructura de la materia. Discutían sobre si la luz se transmite instantáneamente de su fuente al observador, o se transporta a una velocidad finita. En cuanto a la electricidad, Platón, en uno de sus Diálogos, habla de "las maravillas de la atracción del ámbar", refiriéndose a una resina amarillenta que al ser frotada con piel atrae a objetos ligeros como el pelo (la palabra hlektron es la voz griega que significa ámbar). Otra fenomenología conocida desde entonces era el magnetismo, bautizada así en honor al material que presenta esta propiedad en forma natural: la magnetita.
En este capítulo se revisará por separado la evolución independiente de los
conceptos de luz, electricidad y magnetismo hasta su fusión hacia fines del
siglo XIX. Simultáneamente seguiremos el camino de la hipótesis
atómica, con base en el progreso de la química durante el mismo periodo.
II.2. LA ELECTRICIDAD Y EL MAGNETISMO
La capacidad de la magnetita para orientarse con respecto a la tierra fascinó
a los antiguos, quienes pronto pudieron aplicarla a la navegación. Hacia fines
del siglo XVI el inglés William Gilbert fue el primero en utilizar
métodos científicos al estudio de la atracción que ejerce la magnetita sobre
algunos metales y la repulsión que ejerce sobre sí misma en cierta orientación.
Gilbert mismo fue el primero en sugerir que la tierra posee un campo magnético.
En cuanto a la electricidad, aunque era un fenómeno menos útil, en la Edad Media ya se sabía que, además del ámbar, otros materiales como el vidrio y el copal mostraban propiedades eléctricas. La variedad de estos materiales sugirió que la electricidad no era una propiedad intrínseca de las sustancias sino una especie de fluido que se producía o transfería al frotar o tocar unos materiales con otros. Sin embargo, también se observó que la electrificación no sólo causaba la atracción sino la repulsión entre algunos objetos.
En 1773 el químico francés Charles-François de Cisternay Du Fay observó que las limaduras de hierro, luego de estar en contacto con vidrio electrificado, se repelían entre sí, aunque eran atraídas por otras que habían estado en contacto con resina electrificada. De ahí surgió la idea de electricidad vítrea y electricidad resinosa como dos versiones diferentes del mismo fenómeno. Hacia 1745 el norteamericano Benjamín Franklin llegó a la conclusión de que se trataba de un solo tipo de fluido constituido por partículas extremadamente pequeñas.
En el modelo de electricidad de Franklin la materia se comportaba como una esponja capaz de absorber, contener y ceder partículas de electricidad. Así, al frotar ámbar con piel, las partículas pasaban del primer material al segundo y en forma opuesta cuando se frotaba vidrio con seda. Franklin se refería al exceso de electricidad como carga positiva, y carga negativa en el caso contrario. Un concepto implícito en estos razonamientos es el de la conservación de la carga. Pronto se complementaron las ideas de Franklin con el postulado de que cuerpos cargados de un mismo signo se repelen entre sí y aquellos cargados de signos opuestos se atraen.
En lo que se refiere a la luz, la antigua polémica sobre su velocidad permaneció como un tema abierto durante muchos siglos. Una de las primeras evidencias sobre su magnitud finita fue presentada ante la Academia Francesa en 1666 por Ole Roemer, un danés radicado en París que llegó a ser tutor del delfín. Roemer basaba su teoría en la observación astronómica de los eclipses de una de las lunas de Júpiter. Al igual que con los otros planetas, la Tierra se acerca y se aleja de Júpiter en la medida en que recorre su órbita. Las lunas de Júpiter, en sus propias órbitas, se ocultan (eclipsan) tras el planeta con una frecuencia constante. Luego de repetir varias veces las medidas del periodo de los eclipses de la primera luna de Júpiter, Roemer observó que se daban periodos más cortos cuando la Tierra se acercaba a Júpiter que cuando se alejaba. Roemer atribuyó este efecto a la velocidad de la luz y estimó que ésta tardaría 22 minutos en cruzar la órbita terrestre. Desgraciadamente, dado que el diámetro de la órbita terrestre era desconocido en ese entonces, Roemer no pudo dar un valor a la velocidad de la luz.
No sólo la velocidad sino la naturaleza misma de la luz intrigó también a científicos
de todos los tiempos. A finales del siglo XVII, el inglés Isaac
Newton consideraba que la luz consistía en un haz de corpúsculos, mientras que
otros como el holandés Christian Huygens aseguraban que se trataba de un fenómeno
ondulatorio. El principal argumento de la hipótesis corpuscular era que la luz
viaja en línea recta y proyecta sombras bien definidas, contrariamente al comportamiento
de ondas como las de sonido que pueden rodear obstáculos. El principio
de Huygens establece que, al igual que el sonido, la luz se propaga por frentes
de onda. Las partículas de este frente actúan como nuevas fuentes, con lo que
causan que sus vecinas vibren con la misma frecuencia. Este modelo explica satisfactoriamente
fenómenos como la refracción.
La refracción ocurre cuando la luz pasa de un medio a otro de diferentes propiedades
ópticas y su manifestación más común es la impresión de que los objetos rectos,
como un lápiz, se doblan al ser sumergidos parcialmente en el agua. El ángulo
al que parecen doblarse los objetos se conoce como ángulo de refracción.
Este fenómeno había interesado ya a Ptolomeo, quien en el siglo II notó que
el ángulo de refracción dependía de los materiales sobre los cuales se hacía
incidir la luz, y al árabe Al Hazen, quien, a fines del siglo X,
dedujo varias relaciones geométricas importantes entre el ángulo de la luz incidente,
el de refracción y el plano de la superficie de contacto entre los medios. El
tratado de óptica de Al Hazen fue posteriormente traducido al latín y era un
texto conocido cuando en 1621 el holandés Willebord van Roijen Snell encontró
que el cociente entre el seno del ángulo de incidencia y el seno del ángulo
de refracción es una constante característica del medio, que se denomina índice
de refracción. Posteriormente el abogado y gran matemático francés Pierre
Fermat dedujo la ley, hasta entonces empírica de Snell, suponiendo que existía
una diferencia en la velocidad de propagación de la luz en cada medio.
El argumento de Fermat considera la trayectoria que seguiría la luz para viajar
de un punto (A) en un medio en que su velocidad (V) es mayor, a otro punto (B)
en un medio en el que la velocidad de la luz (V') es menor (véase figura 1).
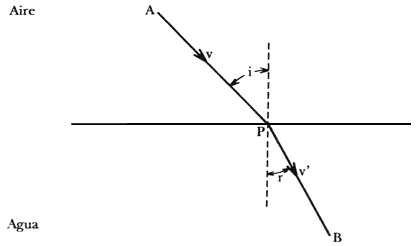
Figura 1. Principio de Fermat. La luz viaja de A a B siguiendo la trayectoria
que minimiza el tiempo.
La hipótesis de Fermat es que la trayectoria preferida sería aquella en que la luz tardase menos en llegar de A a B. Tómese como ejemplo el paso de la luz del aire al agua. Si denotamos como P al punto intermedio en que la trayectoria corta la superficie del agua, es claro que V = V' implica que A, P y B están alineados. Sin embargo, si V es mayor que V', para hacer más corto el tiempo de recorrido conviene aumentar la longitud de la trayectoria en el aire y disminuirla en el agua donde viaja más despacio. Es decir, el segmento AP sería mayor que en el caso V = V' y el PB menor. Por lo anterior, A, P y B no estarán alineados y el cociente entre el seno de los ángulos que forman AP y PB con la perpendicular a la superficie del agua en el punto P resulta ser igual al cociente V/V' que es el índice de refracción de Snell.
La hipótesis corpuscular fue sostenida en 1644 por el filósofo francés René Descartes, y posteriormente por Newton, quienes explicaban el fenómeno de la refracción como el efecto de una fuerza, de atracción en el caso del paso de aire a agua, que sólo actuaba sobre las partículas de luz durante el instante en que éstas cambiaban de medio. Esta fuerza, perpendicular a la superficie que separa a los medios, provocaba una aceleración en las partículas. Es decir, según el modelo corpuscular descrito por Newton en su trabajo Optiks, publicado en 1704, la velocidad de la luz debería ser mayor en el agua que en el aire. Por otra parte, la explicación que da Huygens en su Traitè de la Lumière, publicado en 1690, implica que las ondas luminosas viajan a mayor velocidad en el aire que en el agua. Bastaría entonces con medir la velocidad de la luz en ambos medios para resolver el problema. Sin embargo, pasó mucho tiempo antes de que esto ocurriera. Mientras tanto, la química dio un paso enorme en el entendimiento de la estructura de la materia.
II.4. DALTON Y LOS PESOS ATÓMICOS
Hacia 1802 el inglés John Dalton encontró ciertas relaciones entre las masas
de una gran variedad de elementos. Nacido en 1766, hijo de un tejedor, a principios
del siglo XIX encontró que las cantidades relativas de elementos
necesarias para formar un compuesto químico son siempre las mismas. Por ejemplo,
para formar agua son necesarios ocho gramos de oxígeno por cada gramo de hidrógeno.
Cualquier excedente de alguno de los componentes queda sin reaccionar. Según
Dalton, estas proporciones constantes indicaban que, si el agua estaba compuesta
de partículas —que ahora llamamos moléculas— cada una de las cuales
consistía en un átomo de hidrógeno y uno de oxígeno, entonces la relación ocho
a uno indicaría que el átomo de oxígeno pasaba ocho veces más que el de hidrógeno.
Dalton llamó a este número (ocho) el peso atómico del oxígeno, como una
medida relativa al hidrógeno1![]() Dalton hizo notar también que las masas de los elementos eran muy cercanas a
múltiplos enteros de la del hidrógeno, lo que indujo al médico inglés William
Prout a proponer, en 1815, que todos los elementos químicos estaban constituidos
por números enteros de átomos de hidrógeno.
Dalton hizo notar también que las masas de los elementos eran muy cercanas a
múltiplos enteros de la del hidrógeno, lo que indujo al médico inglés William
Prout a proponer, en 1815, que todos los elementos químicos estaban constituidos
por números enteros de átomos de hidrógeno.
En 1808 el francés Joseph Luis Gay-Lussac descubrió que, además de la proporción en los pesos encontrada por Dalton, los gases se combinan de acuerdo con una relación de volúmenes fija. Por volumen Gay-Lussac se refería al gas contenido en un mismo recipiente en idénticas condiciones de presión y temperatura. Siguiendo con nuestro ejemplo, dos volúmenes de hidrógeno se combinan con uno de oxígeno para formar dos volúmenes de vapor de agua.
II.5. AVOGADRO Y LAS MOLÉCULAS
Amadeo Avogadro, profesor de la Universidad de Turín, interpretó en 1811 los resultados de Gay-Lussac diciendo que dos volúmenes de gas en idénticas condiciones de presión y temperatura contenían el mismo número de partículas del gas, a las que bautizó como moléculas. Entonces, el hecho de que dos volúmenes de hidrógeno se combinen con uno de oxígeno para formar agua indica que la molécula de agua contiene el doble de átomos de hidrógeno que de oxígeno, pero ¿por qué el resultado son dos volúmenes de vapor de agua y no uno? Avogadro encontró que esto se debía a que, en condiciones normales, el gas de hidrógeno y el de oxígeno están compuestos de moléculas que contienen dos átomos (que él denominó moléculas elementales). De esta manera se introdujo el concepto de peso molecular, como la suma de los pesos atómicos de los elementos que componen la molécula.
Avogadro utilizó su idea de un número constante de partículas en un mismo volumen
de cualquier gas, a temperatura y presión fija, para deducir la fórmula química
de una serie de compuestos químicos. En esta labor fue conveniente utilizar
como unidad de medida el mol, que es el número de gramos de un compuesto,
igual a su peso molecular. Por ejemplo, un mol de agua pesa 18 gramos
(2 de los dos átomos de hidrógeno y 16 del átomo de oxígeno). El número de moléculas
por mol, de acuerdo con Avogadro, debe ser siempre el mismo, independientemente
de la complejidad de la molécula. A este número se le conoce como número
de Avogadro, a pesar de que él nunca supo su magnitud. Pasó más de medio
siglo antes que alguien lograra tener una idea exacta del enorme valor de la
fórmula: 6.02 X 1023 moléculas/mol2![]()
Siguiendo la receta de Avogadro fue posible deducir la fórmula química de un
gran número de compuestos. Durante el resto del siglo XIX, estas
fórmulas sirvieron para deducir relaciones entre los pesos atómicos (relativos
al hidrógeno) de los elementos que forman los compuestos, tal como Dalton pretendió
hacer en un principio. Como confirmación de las ideas de Avogadro, se encontró
que el peso atómico de un mismo elemento contenido en diferentes compuestos
químicos es siempre el mismo. Si la hipótesis de Avogadro fuera errónea, las
fórmulas químicas que de ella se derivaron difícilmente darían resultados consistentes
respecto a los pesos atómicos. El éxito del método para predecir las proporciones
necesarias en la preparación de compuestos químicos sirvió de apoyo a los pocos
físicos y químicos que, hacia finales del siglo, aceptaban la existencia de
los átomos.
II.6. MENDELEV Y LA TABLA PERIÓDICA
La idea de que las moléculas son combinaciones de números enteros de átomos
originó el concepto de valencia. La valencia de un elemento se define como el
número de pesos atómicos de hidrógeno, o de cualquier otro elemento de valencia
unitaria, que se combinan con ese elemento para formar un compuesto. Por ejemplo,
la valencia del oxígeno es dos. Luego de determinar la valencia de todos los
elementos conocidos, los químicos del siglo XIX empezaron a encontrar
que las propiedades químicas de los elementos estaban relacionadas con esa valencia.
Por ejemplo, una de las familias de elementos de valencia unitaria incluye al
flúor, al cloro, al bromo y al yodo, que son gases corrosivos, que reaccionan
con metales para formar sales cristalinas. Otra familia de elementos de valencia
unitaria incluye el litio, sodio y potasio, que son metales que reaccionan violentamente
al contacto con el agua.
Los esfuerzos por clasificar elementos en familias de acuerdo con sus propiedades se intensificaron hacia la segunda mitad del siglo pasado. Por ejemplo, en 1863 el inglés J. A. R. Newlands hizo una tabla cíclica en la que acomodaba los elementos de acuerdo con su peso, utilizando el hecho, por entonces ya establecido, de que los elementos cuyos pesos atómicos difieren en ocho unidades muestran propiedades químicas muy parecidas entre sí.
En 1869 el químico ruso Dmitri Ivanovich Mendeleev propuso una tabla en la
que agrupaba a los elementos de acuerdo con sus propiedades físicas y químicas,
su valencia y su peso atómico. La tabla de Mendeleev agrupaba a los elementos
en 17 columnas, cada una con una familia que poseía propiedades químicas muy
parecidas. En 1871, Mendeleev modificó su tabla periódica reduciéndola a sólo
ocho columnas. Un detalle interesante en este trabajo fue que al acomodar los
elementos en la nueva tabla quedaban seis espacios vacíos. Si tenían validez
los arreglos de Mendeleev, se podía considerar como una predicción la existencia
de elementos aún no descubiertos que debían llenar los espacios en blanco. Tres
de esos elementos (escandio, galio y germanio) fueron descubiertos poco tiempo
después y mostraban propiedades muy parecidas a las predichas por Mendeleev.
De los otros tres, el renio y el polonio fueron descubiertos hacia fines del
siglo XIX y el tecnecio sólo fue descubierto en reacciones nucleares
a mediados de nuestro siglo. La capacidad predictiva de la tabla periódica reforzó
la confianza en la teoría atómica. Mendeleev, nacido en Siberia en 1834, además
de su aportación a la química, tenía ideas revolucionarias en agronomía y en
política, al punto de que se ganó enemigos importantes en el gobierno ruso de
aquel entonces.
Una propiedad que liga claramente a la materia con la electricidad, también
descubierta a principios del siglo XIX, se refiere a la disociación
de compuestos químicos por corrientes eléctricas en un proceso conocido como
electrólisis. Este proceso fue descubierto accidentalmente en 1800 por
William Nicholson y Antony Carlisle mientras estudiaban la operación de baterías
eléctricas. Utilizando gotas de agua para mejorar el contacto eléctrico de una
batería, notaron que se producían burbujas. Luego, al estudiar con más cuidado
el fenómeno, se dieron cuenta de que cerca de la terminal negativa de la batería
el gas liberado era hidrógeno, mientras que en el lado positivo se producía
oxígeno. Pronto se estudió la disociación de otros compuestos utilizando este
método. Uno de los trabajos más extensos realizados en este campo fue el de
sir Humphrey Davy, quien con la ayuda de la electrólisis descubrió los elementos
sodio y potasio al someter ciertas soluciones salinas a la acción de corrientes
eléctricas.
La primera interpretación aceptable de esta fenomenología fue desarrollada por el célebre Michael Faraday en la década de 1830. Nacido en 1791, el joven Faraday trabajó como encuadernador de libros, mismos que aprovechaba para educarse. En 1812, lleno de inquietudes, Faraday concursó por una plaza de ayudante en el laboratorio de Davy, quien quedó tan impresionado que lo contrató inmediatamente. Diecinueve años más tarde, Faraday lo sustituyó como director del laboratorio.
En sus experimentos, Faraday encontró que los productos de la electrólisis siempre aparecían en una proporción fija. Por ejemplo, al pasar una corriente eléctrica por una muestra de agua, se obtienen ocho partes de oxígeno por una de hidrógeno. También observó que una carga eléctrica fija cedida en la electrólisis producía cantidades constantes de elementos disociados. Faraday denominó iones a los productos de la disociación y, más específicamente, aniones y cationes según si éstos eran colectados en la vecindad del ánodo —la terminal positiva— o del cátodo —terminal negativa—. Esta nomenclatura se utiliza hoy todavía.
Faraday, de acuerdo con la teoría atómica, dedujo que debería existir una cantidad irreducible de carga necesaria para disociar un compuesto. La carga utilizada en producir las cantidades observadas de hidrógeno u oxígeno a partir de agua, por ejemplo, era un múltiplo de la unidad electrolítica de carga básica.
Dada la poca precisión de los aparatos desarrollados hasta entonces, a Faraday
le era imposible deducir el valor de la carga necesaria para ionizar una sola
molécula a través de la electrólisis, es decir, de la unidad electrolítica
de carga. Esta situación era similar a la que había enfrentado Dalton con
la masa de los átomos. Por lo tanto, Faraday, al igual que Dalton, se concretó
a establecer relaciones entre las cantidades de elementos producidos por electrólisis
con una carga fija. De esta manera determinó que la carga eléctrica para producir
un mol de cualquier material es 96 850 coulombs,3![[Nota 3]](../imgs/mcommnt.gif) unidad ahora conocida como constante de Faraday o simplemente Faraday.
Si el número de Avogadro nos indica la cantidad de moléculas contenidas
en un mol, su conocimiento habría permitido obtener directamente la masa y la
carga de una molécula a partir de los hallazgos de Dalton y Faraday, respectivamente.
Sin embargo, incluso sin esa información, el cociente entre el faraday y la
masa de un mol de hidrógeno permitió entonces saber la relación entre la carga
más elemental y la masa más elemental, que resultó ser 1.044 X 10-8
kg/coulomb.
unidad ahora conocida como constante de Faraday o simplemente Faraday.
Si el número de Avogadro nos indica la cantidad de moléculas contenidas
en un mol, su conocimiento habría permitido obtener directamente la masa y la
carga de una molécula a partir de los hallazgos de Dalton y Faraday, respectivamente.
Sin embargo, incluso sin esa información, el cociente entre el faraday y la
masa de un mol de hidrógeno permitió entonces saber la relación entre la carga
más elemental y la masa más elemental, que resultó ser 1.044 X 10-8
kg/coulomb.
Otro tema que interesó a Faraday —en el que hizo una de sus más grandes
aportaciones— fue la naturaleza de la luz. Como se recordará, a principios
del siglo XVIII dos grandes de la física, Newton y Huygens, basados
en concepciones diferentes, habían llegado a predicciones que se contradecían
en cuanto a la velocidad de la luz en diferentes medios. Esta discrepancia tan
clara daba una oportunidad para discernir entre las concepciones corpuscular
y ondulatoria de la luz.
Pasaron más de cien años hasta que el físico francés Armand Fizeau hizo la primera medida precisa de la velocidad de la luz en el aire. Utilizando un espejo semitransparente, desde su casa en el barrio de Suresnes en París, Fizeau dirigió un haz de luz hacia un espejo colocado a más de ocho kilómetros en la punta del cerro Montmartre.Observando el reflejo distante a través del mismo espejo semitransparente, Fizeau interrumpió el haz por medio de un engrane giratorio, con cuyos dientes se producía un haz intermitente. Cuando el tiempo que tardaba la luz en ir y volver a Montmartre era igual al tiempo de giro necesario para el avance de un diente, los destellos desaparecían por completo. Una simple relación geométrica le permitió, en 1849, deducir que la velocidad de la luz era de 313 000 km/seg. Posteriormente, en 1862, ayudado ahora por su asistente Jean B. L. Foucault, el cual sustituyó el engrane por un espejo rotatorio, obtuvo un valor un poco menor de 298 000 km/seg, que es apenas un 1% diferente del más preciso obtenido en nuestros días. El propio Foucault determinó que la velocidad de la luz en el agua es menor que en el aire, de acuerdo con la predicción de la teoría ondulatoria apoyada por Huygens, con lo que se dio un duro golpe a la concepción corpuscular de la luz.
Otros fenómenos que ilustraban el comportamiento ondulatorio de la luz son
la difracción y la interferencia. Los efectos de difracción fueron observados
en el siglo XVII por Grimaldi, profesor de matemáticas en la Universidad
de Bolonia. Sin embargo, el primer estudio sistemático de este fenómeno se debió
al francés Augustin Jean Fresnel a principios del siglo XIX. Un
patrón de difracción se puede obtener al observar luz a través del espacio entre
los dedos de nuestra mano. Cuando éstos están casi juntos, aparece en la imagen
una serie de franjas obscuras. Fresnel explicó este fenómeno utilizando la formulación
de Huygens. En 1803, Thomas Young mostró el fenómeno de interferencia de la
luz, utilizando una fuente de luz puntual y una pantalla entre las que interponía
una lámina con dos pequeños orificios. La imagen proyectada mostraba claramente
un patrón de interferencia formado por franjas iluminadas. Tanto Young como
Fresnel consideraban a la luz como una onda transversal, igual que las oscilaciones
de una cuerda de guitarra. Esto permitió también explicar ciertos fenómenos
debidos a la polarización de la luz.
Hacia principios del siglo XIX la idea de que la luz es producto
de un fenómeno ondulatorio prevalecía sobre la concepción corpuscular. Sin embargo,
poco se sabía acerca de su naturaleza y nadie sospechaba su estrecha relación
con los fenómenos electromagnéticos. Tanto la electricidad como el magnetismo
reflejan su acción en fenómenos como la atracción o repulsión de cuerpos cargados
o imanes. En 1785, el francés Charles-Augustin Coulomb demostró que la fuerza
entre cargas y entre imanes es inversamente proporcional al cuadrado de la distancia
que los separa. En 1820 el danés Hans Christian Oersted, profesor de física
en la Universidad de Copenhague, durante una de sus clases se percató de que
la dirección que indica una brújula se ve afectada al hacer pasar una corriente
eléctrica por un alambre cercano. Por aquellas fechas varios investigadores
buscaban alguna relación entre la electricidad y el magnetismo, pero a nadie
se le había ocurrido acercar un imán tan ligero a un alambre o a una bobina.
Oersted, intrigado, estudió más a fondo el fenómeno. La fuerza entre el imán
y el alambre aumentaba con la corriente eléctrica, y se invertía al cambiar
el sentido de la corriente. También observó que la fuerza se sentía en el alambre,
como si se tratara de dos imanes. Oersted publicó sus resultados en julio de
1820, y en septiembre dio una plática en París ante una audiencia que incluía
a André Marie Ampère, profesor de matemáticas de la Ècole Polytéchnique. Una
semana después, el propio Ampère anunciaba que las fuerzas de Oersted también
actuaban entre dos alambres que acarrearan corriente eléctrica.
Volviendo a Faraday, en 1831 él buscaba demostrar que si una corriente eléctrica afecta a un imán, entonces el imán debería afectar a la corriente. Con este propósito, primero rodeó imanes con alambres, sin encontrar ningún efecto. Posteriormente utilizó dos bobinas, una conectada a una batería y otra a un medidor de corriente. Con este arreglo Faraday notó que mientras que la corriente fluía uniformemente por la primera bobina, no se registraba ninguna corriente en la segunda, la cual sólo indicaba alguna reacción al conectar o desconectar el circuito de la primera. Pronto se dio cuenta de que el mismo efecto era válido para un imán permanente y un alambre. Al mover el imán, el alambre registraba una corriente. Observaciones similares y aparentemente independientes fueron reportadas por el norteamericano Joseph Henry en 1832.
En 1846 Faraday observó que el plano de oscilación (polarización) de un haz de luz podía ser modificado por campos magnéticos intensos. Esto mostraba por primera vez alguna relación entre la luz y el electromagnetismo. Faraday mismo sugirió, con base en lo anterior, que la luz podría consistir en oscilaciones transversales a las líneas de fuerza eléctrica o magnética. Según esto, el origen de la luz debería consistir en algún tipo de vibración eléctrica dentro del cuerpo que emite la luz. En uno de sus últimos experimentos, Faraday expuso una flama de sodio a la acción de un campo magnético para buscar algún efecto sobre el espectro luminoso, pero no logró observar cambio alguno. Como veremos más adelante, un experimento similar dio a Zeeman el Premio Nobel años más tarde.
Por estas épocas aparece en escena uno de los físicos teóricos más notables de todos los tiempos: James Clerk Maxwell. Nacido en 1831 en el seno de una familia acomodada, Maxwell recibió una educación esmerada; tuvo como maestros a los mejores matemáticos ingleses de su época. Su posición económica le permitió renunciar a los 34 años a su cargo de profesor en el King's College de Londres para dedicar mayor tiempo a la investigación. Su obra expresa, en términos matemáticos de gran elegancia, teorías sobre temas como la termodinámica y la teoría cinética de los gases. Poco antes de dejar el King's College publicó su trabajo Teoría dinámica del campo electromagnético y, años después, su Tratado de electricidad y magnetismo, en el que reduce a cuatro ecuaciones fundamentales su teoría, la cual describe precisamente la fenomenología de Faraday y otros. Las ecuaciones de Maxwell representan el conjunto de condiciones que determinan el campo electromagnético.
Probablemente motivado por la sugerencia de Faraday sobre la naturaleza de la luz, Maxwell consideró la propagación de un campo eléctrico que oscila senosoidalmente y en forma perpendicular a un campo magnético que varía en la misma forma. Sus ecuaciones predicen que ambas ondas se propagan simultáneamente, en fase y a una velocidad, en el vacío, de 3 X 108 m/seg. Este resultado, que sólo depende de propiedades eléctricas asociadas al vacío, coincidía con el valor obtenido por Foucault para la velocidad de la luz en el vacío. Con base en esto, Maxwell propuso que la luz es una onda electromagnética.
La producción de ondas electromagnéticas a partir de cargas oscilantes fue comprobada en 1887 por el físico alemán Heinrich Hertz al producir descargas entre esferas cargadas. Hertz obtuvo ondas con longitudes de hasta 60 cm, que reflejaba, afocaba y hacía interferir utilizando espejos metálicos. Pronto sus estudios encontraron aplicación al permitir enviar señales a distancia. Este es el origen del telégrafo inalámbrico, de la radio, la televisión, y las comunicaciones modernas en general.
Hasta el siglo XVIII, los hallazgos más importantes en la búsqueda
de respuestas a las interrogantes de los griegos fueron principalmente en el
entendimiento de los fenómenos eléctricos y magnéticos (sección II.2) por una
parte, y de la luz (sección II.3) por la otra. En cuanto a la constitución de
la materia, durante más de dos mil años la alquimia permaneció dominada por
brujos y charlatanes, con lo que se obscureció la labor de unos pocos que lograron
sistematizar algunas reacciones químicas simples. El trabajo de John Dalton
sobre los pesos atómicos (sección II.4), a principios del siglo XIX
cambió ese panorama y sentó las bases para el establecimiento de la química
como una ciencia (secciones II.5-7), con el consiguiente fortalecimiento de
la teoría atómica. Otro paso fundamental ocurrido durante el siglo XIX
fue la unificación de los fenómenos eléctricos y magnéticos, en una descripción
que acabó de explicar la naturaleza misma de la luz (secciones II.8-10).