III. EL ELECTRÓN: THOMSON Y MILLIKAN
EN EL capítulo anterior vimos cómo, hacia fines del siglo XIX,
se logró una descripción unificada de los fenómenos electromagnéticos. Si la
luz resulta de la vibración de cargas, la siguiente pregunta a responder es,
¿por qué los átomos emiten luz?, ¿hay algo que vibre dentro de ellos? Como veremos
a continuación, la respuesta de la última pregunta es: sí, el electrón. Las
primeras evidencias de la existencia de esa partícula son muy antiguas y están
asociadas con la electricidad, es decir, con los fenómenos relacionados con
el movimiento, acumulación o deficiencia de electrones en la materia.
III.2. DESCARGAS A TRAVÉS DE GASES
El fenómeno eléctrico más espectacular es el de las descargas entre nubes (los rayos), que originalmente era asociado al estado de ánimo de algunas deidades; fue Benjamín Franklin el primero en demostrar su naturaleza eléctrica en su famoso experimento con cometas de papel. Sin embargo, los rayos resultaron demasiado esporádicos e incontrolables como para permitir su estudio sistemático.
Las descargas eléctricas a través de gases habían sido observadas en el laboratorio por Francis Hauskbee quien, en 1709, reportó la aparición de una luz extraña cuando electrificaba un recipiente de vidrio que contenía aire a baja presión. Otros estudiosos del fenómeno fueron William Watson, quien en 1748 notó la aparición de flamas en la zona de vacío de sus barómetros de mercurio, y Michael Faraday, quien en 1838 realizó experimentos con descargas eléctricas a través de gases enrarecidos. La conducción eléctrica a través de gases intrigó a Faraday, ya que incluso los gases que eran considerados como aislantes, cuando eran enrarecidos, propiciaban fácilmente ese tipo de descargas. ¿Sería posible la conducción eléctrica en el vacío? En tal caso, se podría estudiar directamente la naturaleza del fluido eléctrico.
Antes de que se lograra dar respuesta a esta pregunta, debieron desarrollarse tres técnicas experimentales fundamentales: una bomba de vacío eficiente, un sello metal-vidrio que permitiera transmitir el potencial eléctrico a los electrodos dentro de la zona evacuada y la bobina de inducción para obtener las enormes diferencias de potencial requeridas. La necesidad de este tipo de cambios se aprecia mejor si se considera que Faraday utilizaba un tubo de vidrio tapado en ambos extremos por corchos a través de los cuales hacía pasar alambres para conectar los electrodos internos a una batería.
Las primeras bombas de vacío funcionaban con pistones ajustados a sus respectivos cilindros a través de empaques que sellaban muy mal. No fue sino hasta 1855 que Johann Heinrich Geissler inventó en Bonn, Alemania, una bomba que utilizaba columnas de mercurio como pistones, y que eliminaba así los empaques. De este modo, se lograron obtener presiones de una diezmilésima de atmósfera. Simultáneamente, el mismo Geissler desarrolló nuevos tipos de vidrio cuyos coeficientes de dilatación eran iguales a los de algunos metales, con lo que permitió pasar alambres a través de vidrio fundido sin peligro de que se formaran fracturas por las que se perdiera el vacío.
Otra mejora indispensable fue la obtención de grandes diferencias de potencial
eléctrico. En este sentido, la contribución de otro alemán, Heinrich Daniel
Ruhmkorff, fue importante. Como ya se mencionó, los primeros experimentos con
tubos de descarga obtenían sus voltajes de baterías enormes conectadas en serie.
Ruhmkorff modificó la bobina de inducción para obtener algo parecido a las bobinas
de los automóviles actuales, con las que se producen descargas de miles de voltios
a partir de una batería de menos de diez voltios.4![[Nota 4]](../imgs/mcommnt.gif)
Con estos avances, en 1858 el profesor alemán Julius Plucker estudió la conducción de electricidad a través de gases a muy baja presión utilizando un tubo de vidrio en el que colocó dos placas metálicas en la parte interior de los extremos. Tal como se había observado antes para un vacío pobre, Plucker vio cómo se iluminaba todo el tubo al aplicar electricidad a las placas. Sin embargo, cuando casi todo el gas era evacuado notó que esa luz desaparecía quedando tan sólo un resplandor verdoso en el vidrio cercano a la zona de la placa conectada a la terminal positiva de su fuente de electricidad (el ánodo); la imagen luminosa no dependía mucho de la posición de ese electrodo. Más bien, parecía como si la luminosidad en esa zona fuera producida por algún tipo de rayos emitidos por la placa conectada al cátodo, y que viajaban de una placa a la otra a través del vacío. Plucker también observó que la posición de la imagen luminosa podía ser modificada si se acercaba un imán a la zona del ánodo. Un alumno de Plucker, J. W. Hittorf, encontró que al interponer objetos entre el cátodo y el ánodo se producían sombras en la imagen luminosa, con lo que reforzó la idea del origen catódico para esos rayos. El nombre de rayos catódicos fue introducido años después por el investigador alemán Eugen Goldstein, quien además demostró que las propiedades de esos rayos no dependían del material de que estuviera hecho el cátodo.
Una de las primeras teorías sobre la naturaleza de los rayos catódicos fue propuesta por el inglés William Crookes, quien sugirió que se podía tratar de moléculas de gas, cargadas eléctricamente en el cátodo y, posteriormente, repelidas violentamente por la acción del campo eléctrico. Goldstein puso en duda esta hipótesis basado en la gran penetrabilidad que demostraban tener los rayos catódicos, lo cual había sido interpretado por el físico alemán Heinrich Hertz como una indicación de que, en lugar de partículas, los rayos catódicos serían ondas electromagnéticas tal como él mismo había demostrado que era la luz. Sin embargo, en 1895 el físico francés Jean Baptiste Perrin encontró que los rayos catódicos depositaban carga en un electroscopio, con lo que confirmó que se trataba de partículas cargadas. Fue por aquellas fechas que el inglés Joseph John Thomson se interesó en medir la velocidad de dichas partículas.
Nacido en 1856, Thomson se ganó en 1880 una posición en el Trinity College de la Universidad de Cambridge, Inglaterra, para trabajar en el Laboratorio Cavendish. Originalmente dedicó su tiempo a estudios matemáticos poco relevantes, hasta que en 1884 fue inesperadamente designado director del laboratorio. El Cavendish había sido construido diez años antes con fondos donados por el Duque de Devon, William Cavendish, descendiente del famoso Henry Cavendish, quien midiera por primera vez la fuerza de atracción gravitacional entre dos objetos de laboratorio. El puesto de director había sido ocupado por James Clark Maxwell y, posteriormente, por John William Strutt (Lord Rayleigh), quien se retiró en 1884.
El nuevo nombramiento implicaba una orientación más experimental para su investigación y, siguiendo los consejos de Rayleigh, Thomson se dedicó a estudiar la naturaleza de los rayos catódicos. Como ya vimos, por esas fechas el tema era atacado también en otros laboratonos. La contribución de Thomson fue publicada en tres artículos aparecidos en 1897. Aun cuando no era demasiado hábil con las manos —uno de sus asistentes decía que ellos preferían que no tocara los instrumentos—, su genio consistió en saber qué hacer luego de cada nueva observación.
Para medir la velocidad de los rayos catódicos, Thomson los hacía pasar por
la combinación de un campo eléctrico y uno magnético, producidos por un par
de placas conectadas a una batería y por un par de electroimanes, respectivamente
(véase figura 2). Tanto la fuerza eléctrica como la magnética ejercidas sobre
las supuestas partículas eran directamente proporcionales a la relación entre
su carga y su masa. Sin embargo, la fuerza magnética depende, además, de la
velocidad. Con este principio, Thomson ajustaba ambos campos para compensar
con el segundo la deflección ocasionada por el primero. En estas condiciones,
conocer el cociente de los campos era medir la velocidad. Como información adicional,
el experimento permitía medir la relación entre la carga y la masa de las partículas
en cuestión.
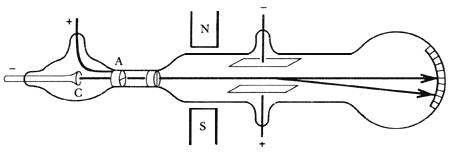
Figura 2. Tubo de rayos catódicos. Los electrones emitidos por el cátodo
(C) son acelerados por el campo eléctrico hacia el ánodo (A) que deja pasar
algunos por un orificio central. La trayectoria de este haz es afectada por
la acción de un campo magnético y uno eléctrico. J.J. Thomson buscaba cancelar
esos efectos para determinar la velocidad de los electrones.
Los resultados del trabajo de Thomson indicaban que la velocidad de los rayos
con los que él trabajaba era, aproximadamente, diez veces menor que la de la
luz. Sin embargo, lo que más llamó su atención es que la relación carga/masa
obtenida era mil veces mayor que la esperada para iones (véase II.7). Este resultado
sugería que, si los rayos catódicos tenían algún origen atómico, se trataba
de partículas (los electrones) mil veces más ligeras que el átomo de hidrógeno.
Estas partículas resultaron ser los electrones.5![[Nota 5]](../imgs/mcommnt.gif)
Estrictamente, el que la masa del electrón fuese mil veces menor que la del átomo que lo contenía era sólo una de las posibles interpretaciones, que dependía de suponer que la carga del electrón era igual a la unidad electrolítica de carga. Fue entonces necesario determinar experimentalmente, y en forma independiente, la carga y/o la masa del electrón.
III.5. CARGA Y MASA DEL ELECTRÓN
Los primeros experimentos tendientes a determinar la carga del electrón fueron motivados por el descubrimiento de un alumno de Thomson, Charles Thomson Rees Wilson, en el sentido de que los iones podían servir como semillas de condensación de gotas en las nubes. La fascinación de Wilson por los fenómenos ópticos producidos por la luz del sol al pasar por las nubes, lo motivaron a estudiar en el laboratorio la producción de atmósferas gaseosas. Antes que Wilson, Coulier y Aitken habían descubierto un método para producir nubes al expandir una cámara que contuviera una atmósfera húmeda. Siguiendo este método, en 1894 Wilson encontró que, en ausencia de polvo, se podía lograr una atmósfera supersaturada de humedad libre de gotas. La producción de gotas sólo se producía si se rebasaba cierto límite de saturación, o bien si se provocaba algún tipo de ionización de las moléculas del medio. Aparentemente, cada ion atrapaba a las moléculas libres para formar gotas. En 1895, cuando Roentgen descubrió los rayos X, J. J. Thomson propuso a Wilson estudiar el efecto de esos rayos sobre medios supersaturados con su cámara de expansión, y se encontró que esos rayos eran altamente ionizantes. Poco tiempo después, con el descubrimiento de la radiactividad, vio que ésta era capaz de producir gotas en la cámara. La cámara de Wilson fue esencial en el descubrimiento de algunas de las partículas elementales, motivo por el cual recibió el Premio Nobel de física en 1927.
Thomson y otros de sus colegas, J. S. E. Townsend y H. A. Wilson, cada uno por su cuenta, diseñaron métodos para medir la masa de las gotitas que se formaban alrededor de cada ion. Townsend, por ejemplo, separaba el líquido de las gotitas que se formaban alrededor de iones, midiendo la carga total. La masa de cada gotita era deducida de la velocidad de caída bajo la acción conjunta de la gravedad y la viscosidad del aire. La masa total del líquido dividido por la masa de cada gotita determinaba el número de gotitas acumuladas, y la carga total dividida por el número de gotitas daba la carga de cada gotita. En el supuesto de que cada gotita creció alrededor de un ion, la carga de cada gotita sería la carga del ion. Y ya que este tipo de ionización se puede asociar con la pérdida de un electrón por parte de una molécula, la carga del ion es de la misma magnitud que la del electrón perdido, puesto que la molécula no ionizada es eléctricamente neutra. El método de Thomson utilizaba medidas de conductividad eléctrica y térmica de la nube gaseosa para determinar la masa líquida, mientras que H. A. Wilson mejoró el método de Townsend al incluir un campo eléctrico variable, paralelo al gravitacional, que permitía una medida más directa de la carga de cada gotita. Sus resultados, publicados independientemente entre 1897 y 1903, indicaban que la carga iónica era del orden de l0-19 coulombs.
Las medidas del grupo de Thomson, a pesar de ser bastante cercanas al valor aceptado actualmente (1.6021 X 10-19 coulomb), fueron vistas con desconfianza y abrieron el camino para medidas más precisas. En 1906, el físico norteamericano Robert Andrews Millikan atacó el problema repitiendo las medidas de H. A. Wilson con la ayuda de Harvey Fletcher, entonces estudiante de doctorado. Pronto se dieron cuenta que la masa de las gotitas variaba rápidamente debido a la evaporación. Para minimizar este efecto empezaron a utilizar gotitas de aceite. Otro cambio importante fue que, en lugar de observar el comportamiento global, Millikan se concentró en el comportamiento de gotas individuales al ser expuestas al efecto combinado de la gravedad y el campo eléctrico a la manera de Wilson. Los resultados mostraron que, si bien la carga inicial de cada gotita observada era enorme comparada con lo reportado por Thomson y su grupo, ésta fluctuaba de una a otra (para la misma gotita) en pasos discretos. Pronto se dieron cuenta de que estas diferencias eran múltiplos pequeños de una misma carga, aparentemente debidas a la pérdida o ganancia de algunos electrones por interacción con el medio en su trayecto. Luego de un simple análisis estadístico, esto los llevó a deducir 1.592 X l0-19 coulombs como la carga del electrón, que se denota comúnmente con la letra e. Millikan recibió el Premio Nobel en 1923 por este trabajo.
Una vez determinada la carga del electrón, su masa pudo ser deducida utilizando la relación carga/masa medida por Thomson, que dio como resultado 9 X 10-31 kg. El propio Millikan dedujo el número de Avogadro, simplemente dividiendo el faraday por e, que dio como resultado: 6.06 X 1023 moléculas por gramo-mol, y la masa del ion de hidrógeno a partir de la relación carga/masa deducida en electrólisis, que dio 1.66 X 10-27 kg. Es decir, la masa del electrón es casi 1/2000 de la del átomo que lo contiene. Un cálculo aritmético simple también permitió a Thomson deducir que las dimensiones de un átomo son del orden de 10-10 metros.
Para terminar, vale la pena hacer notar que, si bien Zeeman y otros realizaron simultáneamente investigaciones cuyos resultados muestran inequívocamente la existencia del electrón, el crédito de este descubrimiento se otorga casi enteramente a Thomson. Esto puede deberse a que, desde su publicación original, Thomson hizo hincapié en el carácter elemental del electrón, al considerarlo una fracción del átomo.
Los estudios enfocados a entender la naturaleza del fluido eléctrico fueron motivados inicialmente por las descargas a través de gases (sección III.2). En tal labor se requirió el desarrollo de técnicas de vacío y de otras que dieron como resultado el tubo de rayos catódicos (sección III.3). El descubrimiento de que estos rayos están constituidos por partículas cargadas fue la labor de J. J. Thomson (sección III.4) quien, antes de deducir la naturaleza elemental, necesitó demostrar que su masa era mucho menor que la de los átomos que las contenían (sección III.5).