V. EL PROTÓN: RUTHERFORD
CON EL descubrimiento del electrón se reveló que el átomo es,
paradójicamente, divisible. Quedaba entonces por explicar la estructura del
átomo. Con el descubrimiento del núcleo atómico se inició una nueva etapa en
la búsqueda de lo elemental: las partículas nucleares. La primera de
ellas, el protón, es el núcleo del átomo de hidrógeno y, combinado con
neutrones, es constituyente básico de los núcleos del resto de los elementos.
Su nombre se deriva de la voz griega para principal o primero
(prwtoz)
Comparado con el electrón, el protón posee una carga de idéntica magnitud pero
de signo opuesto y una masa casi 2 000 veces superior. Esta relación carga/masa
refleja su poca movilidad relativa y, por lo tanto, el que los fenómenos asociados
al transporte de carga hayan podido ser entendidos tan sólo tomando en cuenta
al electrón. Por otra parte, como se vio en el capítulo II, desde principios
del siglo XX y basado en las observaciones de Dalton, Prout intuyó
el carácter elemental del protón al proponer que todos los elementos estarían
formados de números enteros de átomos de hidrógeno.
Durante los últimos años del siglo pasado, el mundo de la física se vio conmovido por una serie de descubrimientos revolucionarios que culminaron, como ya vimos, con el del electrón por Thomson en 1897. Primero fueron los rayos X, por Wilhelm Konrad Röntgen en 1895. En Wurzburg, Alemania, Röntgen encontró que los rayos catódicos, al incidir sobre el vidrio del aparato que los generaba, producían radiaciones muy penetrantes capaces de velar placas fotográficas cubiertas y de producir fluorescencia en algunos materiales, aun cuando ante éstos se interponían obstáculos delgados, como hojas de papel. Este descubrimiento sirvió de motivación para ciertos estudios de Henri Becquerel, en París, el cual estaba muy interesado en entender el fenómeno de la fluorescencia.
En febrero de 1896, Antoine Henri Becquerel, profesor de física en el Politécnico de París, y miembro de una familia de tradición académica, exploraba la posibilidad de que los rayos del Sol pudieran inducir la emisión de los rayos de Röntgen en materiales fluorescentes. El método de Becquerel era simple: colocaba trozos de material fluorescente sobre placas fotográficas cubiertas, exponiendo estos arreglos a la luz solar. Entre los materiales y las placas, además, interponía trozos de cobre que obstaculizaran parcialmente la posible producción de rayos X. Si la luz solar inducía la emisión de rayos X en los materiales, estas radiaciones velarían las placas fotográficas a través de la cubierta protectora, dejando grabada la silueta de los trozos de cobre.
Por una casualidad afortunada, entre los materiales fluorescentes utilizados por Becquerel había una sal de uranio. Los primeros experimentos con ese material dieron resultados interesantes pues, luego de un día de exposición, encontró que las placas fotográficas mostraban, tenuemente, las siluetas del cobre. Sin embargo, el clima parisino ese febrero no favorecía mucho sus experimentos, pues estuvo nublado el resto del mes, por lo que decidió guardar sus atados de placas con muestras en un cajón, esperando días más soleados.
El 3 de marzo, cuando el tiempo mejoraba, reinició sus experimentos. Al revelar las placas fotográficas de los días nublados, que habían estado en su cajón la mayor parte del tiempo, se sorprendió al encontrar que éstas se encontraban veladas intensamente con siluetas bien marcadas. A partir de ese momento, y todavía pensando que el fenómeno se debía a algún tipo de fluorescencia inducida por la luz solar recibida anteriormente, decidió repetir sus experimentos pero ahora manteniendo las sales en la obscuridad. Dos meses después, las sales seguían emitiendo radiación con igual intensidad. Además notó que esas radiaciones eran producidas por cualquier sal de uranio, fosforescente o no, con luz o sin ella, por lo que concluyó que el fenómeno estaba directamente relacionado con la presencia de uranio en los compuestos. Becquerel había descubierto la radiactividad.
Poco tiempo después, también en París, la polaca Marie Sklodowska-Curie descubrió que el torio tenía propiedades similares a las del uranio y, junto con su marido, el francés Pierre Curie, descubrió el elemento radio que es millones de veces más activo que el uranio. Por estos descubrimientos, Becquerel, Pierre y Marie Curie recibieron el Premio Nobel en 1903. No obstante, quedaba en pie la pregunta: ¿Qué es la radiactividad?
Rutherford nació en Brighwater, Nueva Zelanda, en 1871 en el seno de una familia
de emigrados ingleses. Graduado en física, dedicó sus primeras investigaciones
al electromagnetismo. Por sus resultados, obtuvo una beca que le permitió trasladarse
a Inglaterra a trabajar con J. J. Thomson en el Laboratorio Cavendish, al que
llegó en 1895. En Cambridge, Rutherford siguió la línea de investigación local
estudiando los efectos de los rayos X y de las radiaciones de Becquerel sobre
la conducción eléctrica de gases enrarecidos. En 1898 demostró que los rayos
X y la radiactividad tienen efectos similares sobre los gases y encontró que
hay al menos dos tipos diferentes de radiactividad que él bautizó como a
y b. Los rayos b
resultaban ser casi tan penetrantes como los rayos X, en contraste con
los rayos a que eran detenidos con una
hoja muy delgada de aluminio. Posteriormente se descubrió otro tipo de radiación,
mucho más penetrante que las anteriores, que se denominó rayos g
(véase figura 4). Estos rayos, capaces de penetrar placas gruesas de metal,
son radiación electromagnética de más alta energía que los rayos X.
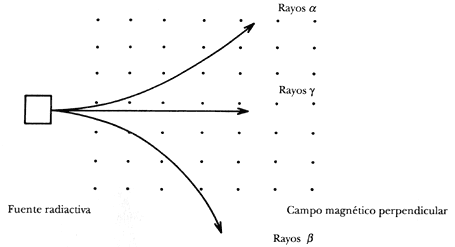
Figura 4. Tipos de radiación nuclear. Rutherford clasificó a los productos
del decaimiento de fuentes radiactivas naturales en rayos a,
b y g. Si éstas poseen carga, su
signo puede ser inferido con la ayuda de un campo magnético perpendicular (matriz
de puntos).
En 1899 el propio Becquerel descubrió que los rayos b podían ser deflectados por un campo magnético y lo hacían en la misma dirección de los electrones de Thomson. Convencido de que se trataba de las mismas partículas, usó la metodología de éste y encontró que la relación carga/masa de los rayos b era, en efecto, muy parecida a la de los electrones.
Rutherford, quien en septiembre de 1898 había aceptado un cargo en la Universidad de McGill en Montreal, recién llegado a Canadá se dedicó a estudiar la naturaleza de los rayos a. Pronto encontró que, si bien más difíciles de deflectar, éstos también eran sensibles a los campos magnéticos y eléctricos. Suponiendo entonces que se trataba de partículas cargadas, a partir de 1903, Rutherford estudió sus deflecciones para determinar la relación carga/masa de los rayos a. Finalmente, en 1906, sugirió que los rayos a no eran otra cosa que iones de helio. Esta hipótesis era apoyada por la aparente emanación de helio en materiales radiactivos, descubierta por William Ramsay (Premio Nobel de química 1904) en 1895 en el uranio y por el mismo Ramsay y Frederick Soddy (Premio Nobel de Química, 1921) en sales de radio hacia 1903. En 1908 Rutherford recibió el Premio Nobel de Química por este trabajo.
En 1906 la Universidad de Manchester ofreció a Rutherford un puesto de investigador que le permitió volver al Viejo Mundo. Por aquellas épocas Manchester y Cambridge eran los centros de la ciencia inglesa. En 1907 Rutherford aceptó como ayudantes al joven alemán Hans Wilhelm Geiger (25 años) y al todavía más joven neozelandés Ernest Mardsen (18 años). Geiger, a sugerencia de Rutherford, empezó de inmediato a estudiar la dispersión de rayos a por hojas delgadas de oro. Una muestra de radio se ponía en un contenedor con un pequeño orificio por el que escapaba un haz delgado de rayos a que se hacía incidir sobre una placa de sulfato de zinc, la cual tiene la propiedad de emitir luz cuando es alcanzada por un a. Al interponer a este arreglo una hoja delgada de oro podían estudiarse las desviaciones que inducían los átomos de oro en los a incidentes. En 1908, Geiger reportó que el número de a dispersados por el oro decrecía rápidamente con el ángulo de observación, medido respecto a la dirección incidente, y no encontró evidencia de a dispersados a ángulos mayores de 30 grados. Estos resultados no eran sorprendentes pues, por aquel entonces, el propio Thomson pensaba que el átomo era una distribución poco densa de masa con carga positiva en la que flotaban los electrones como pasas en un pastel. Materia tan dispersa, se pensaba, sería incapaz de perturbar mayormente la trayectoria de las partículas incidentes. En todo caso, para que Mardsen adquiriera experiencia en investigación, Rutherford le encargó que intentara encontrar rayos a a ángulos aun más grandes que los investigados por Geiger. La sorpresa ocurrió cuando, dos días después, Geiger le comunicó que Mardsen había observado a dispersados hacia atrás. Según el propio Rutherford, ".... era como disparar balas sobre un hoja de papel y ver que rebotan".
Geiger y Marsden se dedicaron a medir entonces la distribución de a con más cuidado y, en 1909, publicaron sus resultados. La deflección seguía una función bien definida que decrecía pronunciadamente con el ángulo, pero que indicaba que la dispersión de a a ángulos mayores de 90 grados era muy superior a la que podría atribuirse a una fluctuación estadística. En 191, Rutherford dio una explicación a los resultados de Geiger y Marsden. Según éste, la dispersión a grandes ángulos indicaba que, contrario a lo pensado hasta entonces, la mayor parte de la masa del átomo, y toda su carga positiva, se encontraba concentrada en una región muy reducida en el centro del átomo: el núcleo.
El descubrimiento del núcleo puede considerarse como un descubrimiento indirecto del protón, puesto que este último no es más que el núcleo del átomo de hidrógeno. Sin embargo, hay una diferencia, sutil pero importante, entre el núcleo del hidrógeno y el concepto de protón como partícula elemental y constituyente fundamental de la materia. Como veremos a continuación, no fue sino hasta 1919 que el propio Rutherford demostró, a través de la desintegración del núcleo de nitrógeno, que éste estaba constituido por partículas, a las que posteriormente bautizó como protones y que podían ser identificadas con los núcleos del hidrógeno.
Una vez descubierto el núcleo, la pregunta inmediata fue ¿de qué está compuesto? Ya desde los tiempos de Dalton y Faraday un siglo atrás, los pesos atómicos se referían al del hidrógeno. Dalton hizo notar que las masas de los elementos eran muy cercanas a múltiplos enteros de la del hidrógeno, lo que indujo al médico inglés William Prout a proponer, en 1815, que todos los elementos químicos estaban constituidos por números enteros de átomos de hidrógeno. Una vez descubierto el electrón y el núcleo, era razonable suponer que los núcleos de los elementos estuvieran hechos de números variables de protones. Sin embargo, los núcleos no podían estar hechos de simples conjuntos de protones ya que su carga era típicamente la mitad del número de protones que se necesitaría para explicar su masa, lo que contradecía la evidencia sobre la neutralidad eléctrica de los átomos.
La constitución del núcleo sólo podía ser revelada si se pudiera romper uno y analizar los pedazos. En 1915, Mardsen, antes de volver a Nueva Zelanda como profesor, hizo notar a Rutherford que al bombardear aire con partículas a aparecían algunas partículas que tenían un alcance extraordinariamente largo. En 1917, Rutherford decidió estudiar el problema con la hipótesis de que se trataba de átomos de alguno de los gases presentes en el aire. En junio de 1919, publicó un trabajo en el que anunciaba que estas radiaciones no eran otra cosa que núcleos de hidrógeno arrancados al nitrógeno del aire por las a. En su artículo dice que, habiendo observado por primera vez la desintegración de un núcleo, la aparición de núcleos de hidrógeno demostraba que estos últimos eran parte constitutiva del núcleo atómico.
Como ya se mencionó, Ernest Rutherford recibió el Premio Nobel en química, en 1908, por haber descubierto que las partículas a no son otra cosa que iones del helio. Sin embargo, Rutherford es más conocido por haber descubierto el núcleo.
El descubrimiento de los rayos X y de la radiactividad (sección V.2) motivó a varios científicos a investigar su naturaleza. Uno de ellos, Ernest Rutherford, encontró que los rayos a eran átomos de helio (sección V.3). Posteriormente, él mismo utilizó esas partículas para estudiar la estructura de la materia, descubriendo el núcleo atómico en 1911 (sección V.4). Tal hallazgo, sin embargo, no establecía necesariamente al núcleo del hidrógeno como componente fundamental de la materia, por lo que tuvo que probarse su presencia en otros núcleos (sección V.5).