IV. EL FOTÓN: PLANCK, EINSTEIN Y COMPTON
VOLVAMOS ahora al viejo problema de la naturaleza de la luz. En
el capítulo II vimos cómo, hasta el siglo XVIII, la luz era vista
por unos como un haz de partículas y por otros como un fenómeno ondulatorio
y cómo, durante el siglo pasado, la interpretación ondulatoria de la luz dominó,
quedando sólo un par de fenómenos sin explicar con base en ese modelo. La solución
a los problemas que revisaremos a continuación fue tan desconcertante como reveladora:
la luz está compuesta por paquetes de onda. Estas ondas-partícula se
denominan fotones, y son las mensajeras del campo electromagnético. No
poseen masa y su velocidad impone un límite al que ninguna partícula material
puede viajar. En este capítulo se describe la evolución de las ideas y los experimentos
que llevaron a tan original conclusión.
El éxito de la teoría de Maxwell reforzó la idea de que la luz, tal como lo
sospechó Faraday, es producida por vibraciones eléctricas dentro del cuerpo
emisor. En 1896 Pieter Zeeman, de la Universidad de Leyden, utilizó una finísima
malla de difracción recién desarrollada por Rowland en la Universidad Johns
Hopkins para repetir el experimento propuesto por Faraday sobre posibles efectos
ante la acción de un campo magnético en el espectro de emisión del sodio.6![[Nota 6]](../imgs/mcommnt.gif) Zeeman observó un ensanchamiento en las líneas espectrales tan pronto encendía
su electroiman Tal ensanchamiento, indicó, es proporcional a la intensidad del
campo magnético. Su profesor y colega, Hendrik Antoon Lorentz, propuso una explicación
teórica para tal efecto. Según Lorentz, la radiación es emitida por cargas que
vibran dentro de los átomos del cuerpo luminoso. Esta oscilación estaría separada
en dos componentes, una paralela y una perpendicular al campo magnético externo.
Ya que sólo la oscilación perpendicular sería sensible al campo, la frecuencia
asociada a este movimiento se vería ligeramente afectada. Lorentz concluyó que
el efecto debería implicar, no un ensanchamiento, sino la separación de cada
línea espectral en tres componentes.
Zeeman observó un ensanchamiento en las líneas espectrales tan pronto encendía
su electroiman Tal ensanchamiento, indicó, es proporcional a la intensidad del
campo magnético. Su profesor y colega, Hendrik Antoon Lorentz, propuso una explicación
teórica para tal efecto. Según Lorentz, la radiación es emitida por cargas que
vibran dentro de los átomos del cuerpo luminoso. Esta oscilación estaría separada
en dos componentes, una paralela y una perpendicular al campo magnético externo.
Ya que sólo la oscilación perpendicular sería sensible al campo, la frecuencia
asociada a este movimiento se vería ligeramente afectada. Lorentz concluyó que
el efecto debería implicar, no un ensanchamiento, sino la separación de cada
línea espectral en tres componentes.
La precisión del experimento de Zeeman no era lo suficientemente fina como
para comprobar una descomposición en tres líneas, por lo que tomó el ensanchamiento
observado como una medida de la separación entre las líneas extremas, de acuerdo
con la predicción de Lorentz. Para explicar la magnitud del efecto fue necesario
suponer que la relación entre la carga y la masa de la partícula oscilante debería
ser del orden de 1011 coul/kg. Ésta es muy parecida a la obtenida
posteriormente por J. J. Thomson, quien usó los resultados de Zeeman como evidencia
para apoyar sus argumentos sobre la existencia del electrón como un ente independiente
dentro del átomo. Además, según el modelo de Lorentz, la polarización de la
luz 7![[Nota 7]](../imgs/mcommnt.gif) asociada a cada línea espectral permitiría inferir el signo de la carga eléctrica
del cuerpo oscilante. Zeeman efectuó estas medidas y comprobó que, en efecto,
se trataba de cargas negativas.
asociada a cada línea espectral permitiría inferir el signo de la carga eléctrica
del cuerpo oscilante. Zeeman efectuó estas medidas y comprobó que, en efecto,
se trataba de cargas negativas.
Motivado por el éxito obtenido al explicar las observaciones de Zeeman, Lorentz extendió la teoría de Maxwell al caso de la emisión y absorción de luz por electrones oscilantes en la materia. Según este modelo, cuando la luz (ondas electromagnéticas) penetra la materia, los campos eléctricos oscilantes inducen oscilaciones en los electrones del medio. La oscilación de estas cargas, a su vez, produce ondas electromagnéticas secundarias en todas direcciones. Tal descripción explica elegantemente el principio de Huygens, la dispersión, reflección y otros fenómenos ondulatorios de la luz antes descritos.
IV.3. LO QUE MAXWELL NO EXPLICÓ
Hacia fines del siglo XIX era claro que la absorción y emisión
de luz por los cuerpos se debía a la interacción de la radiación electromagnética
con los electrones del medio, al hacerlos vibrar. Ya que la teoría de Maxwell
se refiere a la radiación electromagnética en general, y no sólo a la luz visible,
era importante generalizar estas ideas para entender los fenómenos de absorción
y emisión de radiación térmica por un medio.8![[Nota 8]](../imgs/mcommnt.gif) Por simplicidad, los teóricos de la época consideraban el caso más simple: un
cuerpo negro. Según el modelo ideal, un cuerpo negro es aquel que es capaz de
absorber radiación de cualquier frecuencia o color.
Por simplicidad, los teóricos de la época consideraban el caso más simple: un
cuerpo negro. Según el modelo ideal, un cuerpo negro es aquel que es capaz de
absorber radiación de cualquier frecuencia o color.
Se puede simular bien un cuerpo negro, por ejemplo, con un orificio en una
esfera. La radiación que incide en tal orificio se refleja múltiples veces en
el interior de la esfera, habiendo en cada reflexión alguna pérdida por absorción.
Si las dimensiones del hoyo son pequeñas comparadas con la superficie de la
esfera, la probabilidad de que la radiación reflejada internamente escape en
su totalidad por el orificio antes de ser absorbida es, idealmente, cero. La
radiación que emerge por el orificio refleja el espectro de emisión del propio
cuerpo, que es sólo función de su temperatura. La intensidad de esta radiación
puede ser medida como función de la frecuencia, o sea el espectro del cuerpo
negro. Mediciones de este estilo ya habían sido efectuadas por varios laboratorios
en el siglo XIX. En principio, debería ser fácil entender la relación
observada entre la frecuencia y la intensidad.
El cuerpo negro está compuesto de átomos que contienen electrones. Al calentar el cuerpo, los electrones vibran y emiten radiación electromagnética. Ya que el cuerpo negro absorbe todas las frecuencias con igual probabilidad, y la emisión es sólo el proceso inverso, uno debería esperar que todas las frecuencias fueran emitidas con igual probabilidad. Según este modelo, la energía de una vibración aumenta en una relación proporcional al cuadrado de la frecuencia de la vibración, por lo que una igual probabilidad de emisión implica una energía que aumenta geométricamente con la frecuencia. Los resultados experimentales, sin embargo, indicaban que la intensidad disminuía a partir de cierta frecuencia máxima, la cual es función de la temperatura del cuerpo.
Existía, además, otro fenómeno asociado a la luz que parecía inexplicable con
base en la teoría de Maxwell. Se trata de un efecto conocido como fotoeléctrico
(véase figura 3). En 1887, Heinrich Rudolf Hertz descubrió que podía inducir
la descarga eléctrica entre dos esferas cargadas al iluminar con luz ultravioleta
la zona de descarga. Poco después Wilhelm Hallwachs, investigando este efecto,
notó también que la luz ultravioleta era capaz de descargar placas de cinc cargadas
negativamente. Luego se dio cuenta de que este efecto persistía en otros metales,
incluso si disminuía la intensidad de la luz. Sin embargo encontró que el efecto
desaparecía si, en lugar de ultravioleta, utilizaba luz roja o infrarroja aun
cuando la intensidad fuera aumentada enormemente. Años después, al descubrirse
el electrón, quedó establecido que la descarga de las placas se debía a la pérdida
de electrones por acción del campo electromagnético de la luz incidente.
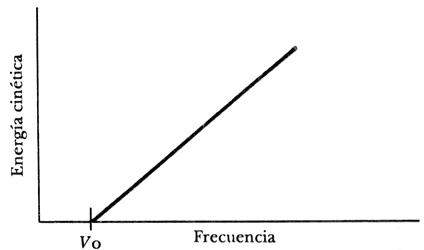
Figura 3. Efecto fotoeléctrico. Hallwachs descubrió que la luz es capaz
de arrancar electrones de una superficie siempre que su frecuencia supere un
cierto umbral (Vo) relacionado con la energía que liga a los
electrones.
Según la teoría electromagnética de Maxwell, la energía asociada a la luz incidente dependía tanto de su frecuencia como de su intensidad. De acuerdo con esto, si bien la luz roja tiene menor frecuencia, al aumentar la intensidad debería vencerse el potencial que ata a los electrones a la superficie. Inversamente, al disminuir la intensidad de la luz ultravioleta, deberían disminuir, proporcionalmente, los fotoelectrones. Ambas predicciones contradecían las evidencias experimentales de Hertz y Hallwachs.
En resumen, la teoría electromagnética de Maxwell, que había explicado con
gran éxito la fenomenología de la luz, parecía tropezar ahora con problemas
al aplicarse a los fenómenos asociados a la radiación calorífica y al efecto
fotoeléctrico. Principia el siglo XX y toca su turno a Max Planck.
Planck nació en Kiel, Alemania, en 1858, en el seno de una familia de abogados. En 1867 los Planck se fueron a vivir a Munich, donde Max inició sus estudios en física. De ahí fue a Berlín, donde tuvo como profesores a Kirchhoff y a Helmholtz. En 1879, de vuelta a Munich, recibió el doctorado con una tesis sobre termodinámica. En Kiel consiguió su primer puesto como profesor, en el que permaneció hasta 1889 cuando, a la muerte de Kirchhoff, Planck heredó su plaza en Berlín. Hacia 1897 comenzó a trabajar en el problema de la emisividad del cuerpo negro. Convencido de que la radiación del cuerpo negro no depende de la naturaleza de las paredes sino, tan sólo, de su temperatura, Planck atacó el problema imaginando que la absorción y emisión de radiación se realizaban a través de osciladores.
Años antes, en 1893, el alemán Wilhelm Wien (Premio Nobel de 1911) había logrado combinar la formulación de Maxwell con las leyes de la termodinámica para tratar de explicar la emisividad del cuerpo negro pero, como sabemos, sus predicciones no coincidieron con el experimento. Impresionado por la elegancia del trabajo de Wien, Planck intentó modificarlo y generalizarlo para ajustar los datos experimentales, usando como truco de cálculo una fragmentación de la energía transferida por los osciladores en paquetes, cuyo tamaño pensó reducir para recuperar la forma continua del flujo de energía entre los osciladores. Sin embargo, encontró que sólo se ajustaban los observables experimentales si el tamaño de sus paquetes permanecía finito. Si bien este resultado permitió resolver un problema, el de la radiación del cuerpo negro, la verdadera magnitud del significado de los paquetes, los cuantos de Planck, pasó desapercibida hasta que un modesto empleado de la oficina de patentes en Berna, como se verá en seguida, utilizó el concepto para explicar el efecto fotoeléctrico. Planck recibió el Premio Nobel en 1918 por el trabajo recién descrito.
Albert Einstein nació en Ulm, Alemania, el 14 de marzo de 1879. Seis semanas después, su familia se trasladó a Munich, donde Albert recibió la educación primaria; posteriormente estudió en Aarau, Suiza, e ingresó en 1896 al Politécnico de Zurich, para prepararse como maestro de física y matemáticas. En 1901 recibió su diploma y se nacionalizó suizo. Al no encontrar trabajo como maestro, tomó un puesto como asistente técnico en la oficina de patentes de Berna. En 1905 obtuvo su doctorado y publicó tres trabajos que pasarían a ser considerados entre los más importantes en la física de nuestro siglo.
En marzo de 1905, Einstein publicó el artículo que nos concierne aquí, y que fue considerado por el Comité Nobel como el principal motivo para otorgarle el premio en 1921. En él explica sus ideas sobre la generación y la transformación de la luz, y aplica su modelo a la descripción del efecto fotoeléctrico. La idea de Einstein utiliza el resultado de Planck sobre la aparente emisión de energía de un cuerpo negro en forma de paquetes; sin embargo, Einstein propone que la cuantización es una propiedad intrínseca de la luz y no de los osciladores como había pensado Planck. En este nuevo modelo, la luz es una onda electromagnética, tal como lo propuso Maxwell, sólo que en lugar de tratarse de una onda continua se encuentra modulada en paquetes de energía. Esto implica una dualidad de características pues, a pesar de ser una onda, al estar localizada en el espacio y poseer una energía definida, presenta características similares a las de las partículas.
El proponer que, tal como la materia, la energía también se encuentra atomizada, fue una idea genial que trajo consigo el desarrollo de la mecánica cuántica. Las predicciones de Einstein sobre el efecto fotoeléctrico fueron verificadas con precisión por Millikan en 1914-1916. Sin embargo, había una diferencia entre cuantos de energía y las partículas, pues estas últimas también se caracterizan por un ímpetu lineal. La posibilidad de asignar ímpetu a los cuantos no puede ser asociada a un solo autor o a un solo trabajo, si bien hacia 1916 el propio Einstein ya se refería a los cuantos en este sentido. Tuvieron que pasar varios años antes que esta hipótesis pudiera ser comprobada. Los primeros experimentos fueron realizados por el norteamericano Arthur Holly Compton (Premio Nobel 1927) y consistían en estudiar la dispersión de rayos X por electrones. Las observaciones de Compton confirmaron que al chocar un cuanto de luz con un electrón, éstos dividen su energía y su ímpetu de acuerdo con la cinemática que se esperaría del choque entre dos partículas. En octubre de 1926, Gibert Newton Lewis, en un artículo en la revista inglesa Nature, se refirió por primera vez a los cuantos de energía como fotones, lo que implicaba la aceptación del cuanto de luz en el campo de las partículas elementales.
Paradójicamente, al tiempo que se consolidaba el concepto del fotón como una partícula, el concepto de materia, y por tanto el de partícula, perdió el sentido determinista que hasta entonces se le asociaba. En 1924 el príncipe francés Louis Victor de Broglie propuso una teoría sobre el electrón, que posteriormente fue generalizada para el resto de las partículas, en la cual se consideraba al electrón como un paquete de onda, similar al fotón, pero con masa. La teoría de De Broglie, que le mereció el Premio Nobel en 1929, fue comprobada con éxito tres años después por Clinton Davisson y Lester Germer al observar la difracción de electrones a través de un cristal. Desde entonces, onda y partícula, energía y materia, se confunden, y el paso de una a la otra se rige por las leyes de la relatividad y la mecánica cuántica.
Una vez establecida la naturaleza ondulatoria de la luz, el descubrimiento
del electrón permitió postular que la luz se producía como consecuencia de oscilaciones
electrónicas en el átomo (sección IV.2). Sin embargo, el resultado de ciertos
experimentos tendientes a establecer la relación entre luz y radiación térmica
no pudo ser explicado con la célebre teoría de Maxwell (sección IV.3). La cuantización
de la energía fue propuesta a principios de siglo XX por Planck
como posible solución a uno de estos problemas (sección IV.4). Einstein utilizó
esta idea para explicar otros efectos (sección IV.5). La división entre ondas
y partículas desaparece en la década de 1920 cuando Compton demuestra que los
fotones no sólo son absorbidos, sino que pueden ser dispersados como partículas,
mientras que De Broglie descubre que las partículas materiales también
se comportan como ondas (sección IV.6).