VI. EL NEUTRÓN: CHANDWICK
El descubrimiento del protón puso de manifiesto que, si bien éste debía ser uno de los constituyentes fundamentales del núcleo, no era el único. Revisemos ahora los hechos que llevaron al hallazgo de la segunda partícula nuclear, el neutrón. Como su nombre lo indica, se trata de un objeto eléctricamente neutro, cuya masa resulta ser parecida a la del protón, además de que es relativamente escaso en la naturaleza pues, en libertad, decae rápidamente emitiendo un protón, un electrón y un (anti) neutrino. Neutrones y protones se mantienen unidos formando núcleos atómicos, debido a una fuerza de atracción cuya magnitud es tal que se le denomina interacción fuerte. Bajo esta influencia, el neutrón es capaz de mantenerse dentro del núcleo como un ente estable.
A la similitud entre las masas del protón y del neutrón se debe que el número
atómico de los elementos resulte cercano a un múltiplo entero de la masa del
átomo de hidrógeno, como se percató Prout el siglo pasado. Sin embargo, químicamente
todo elemento se caracteriza sólo por el número de sus electrones, que es el
mismo que el de los protones en su núcleo. Es decir que desde el punto de vista
de sus propiedades químicas el número de neutrones que posee el núcleo de un
átomo es irrelevante. Por otra parte, las fuerzas nucleares restringen la existencia
de núcleos estables a aquellos cuyo número de neutrones sea parecido al de protones.
En general, para cada elemento hay más de un número posible de neutrones en
su núcleo. Para distinguir entre cada tipo de núcleo, de un mismo elemento,
se utiliza el nombre de isótopo (idozs = igual,
topoz = lugar, o sea, los que tienen el mismo lugar
en la tabla periódica) (véase figura 5).
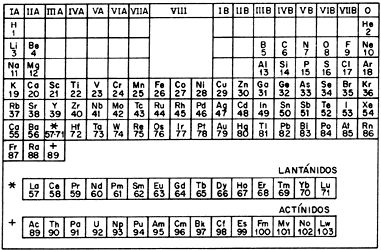
Figura 5. Tabla periódica de los elementos. En ella se agrupan los elementos
en 18 familias (columnas) según sus propiedades químicas. Al ordenar a los miembros
de cada familia según su peso atómico se encuentran hasta siete periodos
(renglones). Los isótopos de un elemento, por poseer las mismas propiedades
químicas, ocupan un mismo sitio en esta tabla. De ahí su nombre.
Poco después del descubrimiento de la radiactividad se encontró que existían ciertos elementos con propiedades químicas idénticas pero propiedades radiactivas diferentes. Tal era el caso del plomo encontrado en las muestras radiactivas del uranio. El plomo natural no presentaba una radiactividad apreciable; sin embargo, al separar el plomo contenido en las sales de uranio, resultaba ser radiactivo. Otros ejemplos hicieron ver que éste era un caso más generalizado, hasta que en 1910 Frederick Soddy, químico graduado en Oxford, que colaboró con Rutherford durante su estancia en Canadá, llamó a las diferentes variedades radiactivas de un elemento radioisótopos.
El descubrimiento de que también los elementos no radiactivos podían separarse en isótopos fue hecho por Thomson, quien, al observar la deflexión de haces atómicos de neón, en 1913, encontró dos valores distinguibles de la relación carga/masa: una 20 veces, y la otra 22 veces superior a la del hidrógeno. La intensidad relativa entre los haces era de aproximadamente 9 a 1; el menos abundante era el isótopo más pesado. Con anterioridad se había establecido que el peso atómico del neón es de 20.2. Este resultado es consistente con el hecho de que se tiene 90% de neón con masa 20 y 10% con masa 22. El trabajo de Thomson fue extendido, después de la primera Guerra Mundial, por uno de sus asistentes, Francis William Aston, quien por medio de la deflexión magnética no sólo confirmó el trabajo de su maestro sino que encontró isótopos estables para una gran variedad de elementos. En todos los casos la masa de los isótopos resultó ser casi exactamente un número entero de la masa del hidrógeno, con lo que borró las objeciones que se antepusieron a Prout un siglo antes. Por esta contribución, Aston recibió el Premio Nobel en química en 1922.
VI.3. ¿ELECTRONES EN EL NÚCLEO?
Una vez descubierto el protón, la estructura de la materia parecía ser simple si se suponía que la masa y la carga se concentran en forma elemental en dos partículas fundamentales: el electrón y el protón. Esto explicaba que la carga de cualquier átomo resultara ser un múltiplo entero de la carga del electrón, que es la misma que la del protón pero de signo opuesto. Además, una vez establecida la existencia de los isótopos, se vio que era la masa de éstos la que resultaba ser muy cercana a un múltiplo de la masa de protón. Bastaba entonces con suponer que el núcleo estaba constituido por el número de protones necesario para explicar su masa y un número tal de electrones que neutralizara la carga excedente igualándola a la carga característica de cada elemento.
La idea alternativa de una partícula neutra con masa similar a la del protón había sido propuesta por Ruthefford en una conferencia en 1920. Según él, esta partícula podía originarse en un átomo de hidrógeno en el que el electrón habría caído al nucléo neutralizándolo eléctricamente.
Esta concepción, sin embargo, parecía innecesaria por aquella época. Por otra parte, la presencia de electrones en el núcleo parecía ser apoyada por el decaimiento b , en el que el núcleo emite un electrón de gran energía (el llamado rayo b ).
Hacia 1928, con el desarrollo de la mecánica cuántica, surgieron algunas dudas sobre la veracidad del modelo de protones y electrones en el núcleo. Primero, Werner Heisenberg (Premio Nobel de 1932) había postulado que la descripción cuántica de una partícula implica una indeterminación en el conocimiento simultáneo de algunos fenómenos observables, lo que se conoce como principio de incertidumbre. Un par de estos fenómenos observables son la posición y el ímpetu, para los cuales el producto de la incerteza en la medida de uno por el de la incertidumbre en la medida del otro no puede ser inferior a una constante, pequeña pero finita, que se conoce como constante de Planck. El ubicar electrones en el núcleo implica que la incertidumbre en la localización de éstos, lógicamente, no podía ser mayor que el núcleo mismo. Tal certidumbre en la localización requería de una incertidumbre enorme en el ímpetu para que el producto se mantuviera superior a la constante de Planck. Esta incertidumbre en el ímpetu, implicaba que las energías de los electrones dentro del núcleo fueran, al menos, diez veces mayores que las observadas en el decaimiento b y muy superiores a las estimadas para el campo eléctrico de atracción debido a los protones, que era la fuerza considerada como responsable del confinamiento de los electrones en el núcleo.
Otra contradicción inquietante para el modelo provenía de la espectroscopía molecular. Las moléculas, como los átomos, por ser sistemas cuánticos sólo pueden absorber o emitir cantidades discretas de energía. El conjunto de estos niveles permitidos de energía forma el espectro del sistema, y estos espectros son característicos de cada molécula. En 1929, Walter Heitler y Gerhard Herzberg hicieron notar que el espectro de las moléculas diatómicas debía cambiar radicalmente dependiendo de si sus núcleos contenían un número par o impar de partículas elementales. A una molécula de este tipo, con dos núcleos idénticos, sólo le sería accesible la mitad de los niveles de los que podría ocupar si sus núcleos fueran distintos. Con base en esto, se comprobó que núcleos como el oxígeno contienen un número par de partículas elementales, lo que está de acuerdo con el modelo de protones y electrones que predice que estos núcleos deberían estar formados por 16 protones y 8 electrones; existen varios otros ejemplos en que esta regla se cumple. Sin embargo, pronto se observó que existían contraejemplos claros a esta regla, como el del nitrógeno, el cual se comportaba claramente como si sus núcleos estuvieran formados por un número par de partículas elementales. El nitrógeno, según el modelo nuclear de electrones y protones, debería estar compuesto por 14 protones y 7 electrones, lo que da un total de 21 partículas elementales. Este total es impar y por lo tanto contradice lo anterior. Pero, si no contiene electrones, ¿de qué está hecho el núcleo?
La primera evidencia experimental de la existencia del neutrón fue observada por Walter Bothe y su alumno Herbert Becker en Alemania, aunque ellos no lo supieron interpretar como tal. Bothe nació en 1892 en el pueblo de Orainenburg, cerca de Berlín. Tomó clases con Planck e inició su carrera como ayudante de Geiger en Berlín. En 1928, Bothe y Becker se interesaron por averiguar si las desintegraciones nucleares reportadas por Rutherford estaban acompañadas por algún tipo de radiación. En sus experimentos bombardeaban berilio con partículas a que eran producto del decaimiento del polonio. Utilizando métodos eléctricos de detección, algo novedoso para su época, encontraron que efectivamente aparecía cierto tipo de radiaciones muy penetrantes que ellos interpretaron como rayos g . Este tipo de radiaciones también aparecían al bombardear litio y boro. Lo más notable de su hallazgo era que, al determinar la energía de esas radiaciones, a través de su atenuación en diferentes materiales, concluyeron que ésta debería ser mayor que la energía de los a incidentes, lo que fue interpretado vagamente como un efecto de la desintegración.
Estos resultados intrigaron a la pareja francesa Joliot-Curie. Irčne Curie, nacida en 1897, era hija de Pierre y Marie Curie, pioneros de la radiactividad y descubridores de elementos como el radio y el polonio. Frederic Joliot era ayudante de Marie cuando conoció a su hija Irčne, tres años mayor que él y con quien se casó en 1927. Entre los primeros intereses científicos de la nueva pareja estuvieron los de reproducir y profundizar en los resultados de Bothe y Becker, utilizando una fuente muy poderosa de polonio propiedad de Marie. En enero de 1932, los Joliot-Curie publicaron otro hallazgo sorprendente relacionado con las mencionadas radiaciones: éstas eran capaces de expeler protones de una capa de parafina. Al tratar de medir la energía de estos protones encontraron que era enorme. Siguiendo la sugerencia de Bothe, los Joliot-Curie calcularon que, si fuesen rayos g , éstos deberían tener, al menos, diez veces más energía que los a del polonio que los originaba. Tal resultado los llevó incluso a dudar sobre la conservación de la energía en los procesos de desintegración.
El mecanismo por medio del cual se suponía que la supuesta radiación g arrancaba los protones de la parafina era un efecto predicho por Einstein en 1905 y confirmado por A. H. Compton en 1923. El efecto Compton, como se le conoce, se debe a la dispersión de fotones por partículas. Este efecto había sido observado en la interacción entre rayos X y electrones, pero es igualmente válido para la dispersión de rayos g por protones. Sin embargo, los protones son casi 2 000 veces más pesados que los electrones, por lo que, para arrancarlos de un sólido, serían necesarios g de gran energía. Otro problema con esta interpretación era que, dado el número de protones observados, habría que suponer que la probabilidad de colisión entre estos g y los protones de la parafina era millones de veces mayor a la que se esperaría de extrapolar el cálculo válido para el electrón.
Tiempo antes, en el Laboratorio Cavendish de Cambridge, Inglaterra, James Chadwick había realizado varios intentos de descubrir una supuesta partícula neutra mencionada por su profesor Rutherford años antes. Según comentarios posteriores, Chadwick pensaba producir neutrones mediante descargas eléctricas que hicieran caer al electrón hacia el protón en átomos de hidrógeno. Chadwick nació en Inglaterra en 1891, fue alumno de Rutherford en Manchester y, cuando su maestro descubrió la desintegración del nitrógeno en 1917, trabajó con él en la desintegración de otros elementos como el flúor, el aluminio y el fósforo.
Su fe en la existencia de tal partícula resurgió al leer los resultados del matrimonio Joliot-Curie, ya que Chadwick consideraba difíciles de creer las interpretaciones de estos trabajos. En menos de un mes, realizó una serie de experimentos que lo llevaron a la conclusión de que las radiaciones de Bothe no eran otra cosa que los neutrones que él buscaba. Chadwick quiso probar la capacidad de las radiaciones de Bothe para arrancar núcleos de superficies. Pronto encontró que podían eyectar núcleos de nitrógeno de un polímero cianurado con energías considerables. Al repetir el cálculo de los Joliot-Curie, suponiendo todavía que se tratase de rayos g , encontró que la energía necesaria para arrancar esos nitrógenos era casi el doble de la requerida para explicar el caso de los protones de la parafina. Es decir, la energía estimada, para los mismos rayos g , difería enormemente de un caso al otro. Sin embargo, si en lugar de rayos g y se suponía que se trataba de algún tipo de partícula, la masa que se deducía en ambos casos (protones de parafina y nitrógenos del polímero) resultaba ser consistentemente la misma y aproximadamente igual a la del protón. Por otro lado, la gran penetrabilidad de estas radiaciones implicaba que, de ser una partícula, ésta debería ser neutra. Cabe recordar que las partículas cargadas, debido al gran alcance de la fuerza eléctrica, interactúan con las de los átomos a todo lo largo de su trayectoria dentro de un material, por lo que pierden energía rápidamente.
El 27 de febrero de 1932, Chadwick reportó sus resultados, interpretándolos como evidencia de una nueva partícula neutra, a la que llamó neutrón, igual a la predicha por Rutherford doce años antes. El descubrimiento de Chadwick, sin embargo, no tuvo una repercusión inmediata en la concepción de la estructura del núcleo, puesto que él mismo imaginaba al neutrón como un compuesto electrón-protón. Sólo en un comentario, al final de su trabajo, menciona que, si el neutrón fuese considerado como partícula elemental, podría resolverse el problema de la estadística cuántica del nitrógeno, pero no le dio gran importancia a este punto.
Es difícil definir quién o a partir de cuándo el neutrón pasó a ser considerado como la segunda partícula elemental constituyente del núcleo tal como ahora se concibe. El primer modelo del núcleo con base en neutrones y protones fue propuesto por Heisenberg en 1932. En este modelo los protones y neutrones estaban ligados por el intercambio de electrones, pues todavía se seguía con la idea de que había electrones en el núcleo. Si la fuerza responsable de la interacción entre neutrón y protón surgía de este intercambio, una consecuencia lógica del modelo de Heisenberg sería una diferencia en la interacción neutrón-protón con el sistema protón-protón en que no habría electrones que intercambiar. En 1936, las medidas de dispersión protón-protón hechas por Merle Antony Tuve, N. Heisenberg y L. R. Hafstad demostraron que estas interacciones son tan fuertes como aquellas para el sistema neutrón-protón. Ese mismo año, Gregory Breit y E. Feenberg, así como, independientemente, Benedict Cassen y Edward Uhler Condon, propusieron un modelo de fuerzas nucleares en el que neutrones y protones interaccionaban indistintamente entre sí. En estas ideas quedaba ya implícita la condición del neutrón como partícula elemental en el mismo nivel del protón. El propio Chadwick, al recibir el Premio Nobel en diciembre de 1935, ya habló del neutrón como constituyente elemental del núcleo aunque sin dar una idea clara de la naturaleza de su interacción con el protón.
La sistemática derivada de las masas de los núcleos (sección VI.2) indicaba la existencia de masa neutra en ellos. La primera interpretación para esto fue que podría tratarse de combinaciones de protones y electrones (sección VI.3). Tal modelo, sin embargo, pronto encontró dificultades para explicar algunas evidencias experimentales (sección VI.4). En 1928, Bothe y Becker descubrieron un nuevo tipo de radiaciones (sección VI.5) que despertaron el interés de varios investigadores. Entre ellos se encontraba Chadwick, quien había dedicado parte de su tiempo a explorar una hipótesis alternativa de su maestro Rutherford sobre la existencia de una partícula neutra: el neutrón (sección VI.7), que logró esclarecer en 1932.