III. CALOR Y TRABAJO
LA TIERRA recibe energía del Sol, la cual se aprovecha de muchas maneras. Una gran parte es absorbida por la atmósfera y los mares mientras que una porción relativamente pequeña es utilizada por las plantas para realizar el proceso de fotosíntesis. Nuestro planeta también emite energía al espacio que lo rodea, de tal forma que la energía interna de la Tierra es prácticamente constante y por lo tanto, la temperatura global también se mantiene.
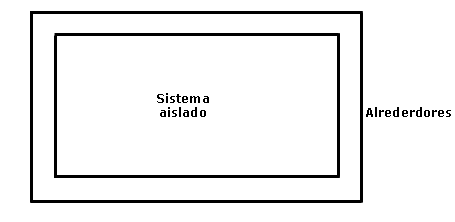
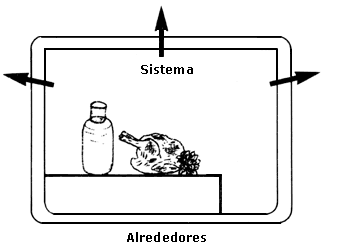
Figura 26. Un sistema aislado no intercambia ni masa ni energía con sus alrededores.
El valor de la temperatura promedio en la Tierra, o en cualquier otro lugar; depende —como vimos en el capítulo anterior— de la escala que se haya elegido. En forma análoga, podemos medir cambios en la energía de un cuerpo u objeto, pero no podemos asignar un valor a la energía, a menos que fijemos una escala arbitraria con un cero arbitrario. Si llamamos U a la energía interna de un cuerpo, lo que podemos medir son cambios en el valor de U, o sea DU (delta U). Para simplificar estas mediciones, es muy útil delimitar las fronteras del cuerpo u objeto que queremos estudiar y llamar a esta parte del Universo "el sistema".
Si tomamos un sistema y lo aislamos del universo que lo rodea, que llamamos "alrededores", de tal manera que no pueda haber intercambio de energía entre ellos, podemos afirmar que la energía del sistema Usist. permanecerá sin cambio.
De ser posible el intercambio de energía entre el sistema y sus alrededores,
de todas maneras podremos afirmar que la energía total del Universo (sistema
+ alrededores) será la misma, esto es:
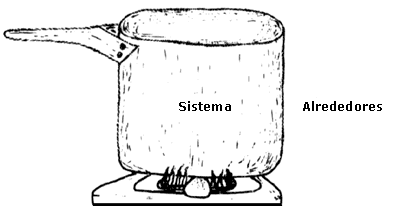
Figura 27. El sistema recibe energía de los alrededores. |
|
| Usist. aumenta |
Ualr. disminuye
|
|
Figura 28. El sistema transmite energía a los alrededores. |
|
| Usist.disminuye |
Ualr. aumenta
|
ya que si, por ejemplo aumentara Usist esta energía adicional necesariamente provendría de los alrededores y Ualr. disminuiría en esta cantidad.
Esta situación es de hecho una regla universal conocida como Ley de la conservación
de la energía, y que se expresa como: "La energía no se crea ni se destruye,
sólo se transforma." 1![]()
¿Cómo se puede transferir energía de los alrededores hacia el sistema o viceversa?
Las formas de transmisión de energía más conocidas, y por lo tanto las más utilizadas, son la transmisión por medio de calor Q o por medio de trabajo mecánico W.
Al calentar nuestros alimentos, comúnmente utilizamos la energía proveniente
de una reacción de combustión. Por ejemplo, una hornilla puede utilizar butano
(C4H10) como combustible:
En esta reacción se desprenden unas 11 860 calorías por cada gramo de butano consumido. Podemos considerar que la hornilla son los alrededores que proporcionan energía a nuestros alimentos (el sistema). Como referencia, debemos recordar que una caloría es la cantidad de energía que se necesita para elevar la temperatura de un gramo de agua, un grado Celsius, de 14.5°C a 15.5°C.
El proceso contrario lo realizamos cuando enfriamos o congelamos algún alimento utilizando un refrigerador. El refrigerador extrae energía de los alimentos que colocamos en su interior y transfiere esa energía, en forma de calor; al aire exterior. Por esta razón si acercamos nuestra mano a la parte trasera de un refrigerador en funcionamiento podremos sentir el calor que se desprende.
En los dos casos mencionados anteriormente, calentamiento o refrigeración, la energía total (Usist. + Ualr.) permanece constante. La forma de transmisión de energía utilizada es el calor Q. Los sistemas como los mostrados en las figuras 27 y 28, que pueden intercambiar energía con sus alrededores pero no pueden intercambiar masa, se denominan sistemas cerrados.
Es importante hacer notar que un cuerpo (o sistema) tiene energía, pero no podemos decir que contiene calor. El calor es un medio por el que la energía se transfiere, y suele decirse que es energía en tránsito.
Lo anterior es igualmente válido para el trabajo (W) que también es energía en tránsito.
Por convención, asignamos un signo positivo (+) al calor, Q o al trabajo, W cuando el que recibe la energía es el sistema, o sea, cuando Usist. aumenta.
Si, por lo contrario, el sistema pierde energía y Usist disminuye, consideramos que el calor y/o el trabajo son negativos (-).
Esta convención es llamada del "sistema egoísta" ya que sólo considera cantidades positivas cuando el sistema gana energía.
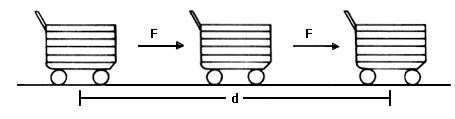
Figura 29a. Al desplazarse el objeto, se realiza trabajo.
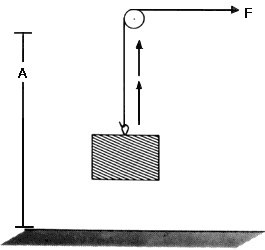
Figura 29b. Al levantar un objeto se realiza trabajo.
Un tipo de trabajo mecánico es el que implica cambiar la posición de un objeto:
En este caso, el trabajo, W es igual al producto de la fuerza aplicada,
E, por la distancia recorrida, d:
W = F x d
Cuando se mueve el carrito (fig. 29 a) generalmente el trabajo se requiere para
vencer la fricción. Si se trata de levantar un objeto a una cierta altura A,
(fig. 29b) la energía queda acumulada en el objeto como energía potencial. Si
se libera el objeto, éste caerá adquiriendo una cierta velocidad. Durante la
caída, la energía potencial se va transformando en energía cinética. En el momento
en que el objeto choca con la superficie, nuevamente se produce una transformación
de la energía, si bien esta transformación depende de las propiedades mecánicas
y elásticas de los cuerpos que chocan. Si se trata de un balón de fútbol, sabemos
que rebotará varias veces hasta quedar detenido y haberse liberado de toda la
energía cinética que había adquirido durante su caída. Si es un objeto de vidrio,
lo más probable es que la energía sea utilizada para romper enlaces atómicos
y se produzca la ruptura del material. Un objeto de metal puede deformarse por
el impacto, como sucede cuando chocan dos automóviles. Al menos parte de la
energía se utiliza para generar esta deformación en el material.
En todos los procesos, una parte de la energía se libera en forma de calor hacia los alrededores. Pero lo importante es notar que en todos estos ejemplos y en todos los que, como lector; pueda usted inventar; la energía total se mantiene. Y también que la posibilidad de acumular energía potencial en un cuerpo por el simple hecho de elevarlo, se debe a que existe un campo gravitatorio y por tanto una fuerza F de gravedad, que generará el trabajo W al caer el cuerpo una distancia d.
¿Cómo podemos, entonces, alterar la cantidad de energía que posee un cuerpo u objeto?
Suministrándole o extrayéndole energía en forma de calor o en forma de trabajo. Una manera de expresar esto utilizando símbolos es:
DU = Q + W
ya que el cambio en la energía interna del sistema (DU)
dependerá de la cantidad de calor y de trabajo que se transfiera entre el sistema
y los alrededores o viceversa. Aquí nos resulta útil recordar la convención
que establecimos unos párrafos atrás: si Q y W son positivos,
DU es positivo y nos indica
que la energía del sistema ha aumentado, ya que, también por convención,
para la cual U final significa la energía interna del
sistema al final del proceso, y U inicial, la energía
que tenía inicialmente el sistema.
La expresión DU= Q + W se puede escribir también de otra forma que resulta más útil desde el punto de vista de análisis matemático. El cambio consiste en considerar que las cantidades de calor y/o trabajo que se transfieren son muy pequeñas (infinitesimales, solemos decir). Obviamente, el cambio de la energía también resulta infinitesimal. En símbolos matemáticos esto se expresa así:
la d antepuesta se lee como diferencial de la variable que continúa. Por ejemplo, dU se lee como "diferencial de energía" y representa un cambio muy pequeño en la energía interna del sistema.
La expresión dU = dQ + dW se conoce como primera ley de la termodinámica.
ENERGÍA, CALOR Y TRABAJO
EN SISTEMAS GASEOSOS
Los gases, por no tener forma ni volumen propios, son muy útiles para estudiar
transformaciones de energía. Sabemos que la principal diferencia entre gases
y líquidos o entre gases y sólidos, es que, en un gas, las moléculas que lo
constituyen se encuentran tan lejanas entre sí que las podemos considerar como
partículas independientes.
Para un primer estudio de las transformaciones de energía, nos resulta muy útil un sistema en el que podemos considerar que las energías de interacción entre las partículas son muy pequeñas, como sucede con los gases, al menos en un intervalo normal de presiones y temperaturas.
Por supuesto que si aumentamos la presión de un gas y disminuimos su temperatura, lograremos que las moléculas estén más cerca unas de otras. Esto daría lugar a interacciones moleculares que, de ser tomadas en cuenta, complicarían en gran medida nuestro estudio.
Es una ley natural que todos los sistemas tienen tendencia a adquirir un estado de mínima energía. En un gas, este estado se halla asociado a la menor temperatura posible y a las presiones más bajas, para que sus moléculas estén muy lejanas entre sí de modo que no existan interacciones.
Al comprimir un gas, esto es, disminuir su volumen y por tanto aumentar la presión, estamos obligando a las moléculas a acercarse unas a otras y por lo tanto aumentará la energía del sistema.
Si permitimos que el sistema transfiera esta energía excedente —recibida por el trabajo de compresión— en forma de calor hacia los alrededores, podemos lograr que, finalmente, DUsist. sea cero, lo que equivale a que la temperatura del sistema se hubiera mantenido constante. Por esta razón diríamos que el proceso ha sido isotérmico (de isos, "igual", en griego).
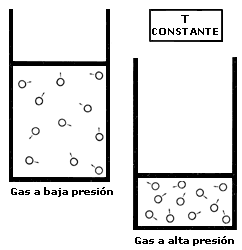
Figura 30. Al disminuir el volumen, las partículas se acercan, las condiciones aumentan y la presión también aumenta.
Si el sistema no puede transferir energía hacia sus alrededores y realizamos un trabajo de compresión, su temperatura tendría que aumentar como consecuencia de que Usist ha aumentado.
Como ya hemos mencionado, llamamos sistemas cerrados a aquellos en los que puede haber transferencia de energía entre el sistema y sus alrededores pero no puede haber transferencia de masa.
Por ejemplo, un recipiente metálico perfectamente cerrado como el que se muestra en la figura 31, contiene en su interior el sistema "agua". Si calentamos el recipiente, el calor será transmitido hacia el agua y por tanto hay transferencia de energía entre los alrededores y el sistema.
Pero el agua no puede salir del recipiente. A esto nos referimos al decir que no puede haber transferencia de masa o materia entre los alrededores y el sistema. Por lo tanto, en la figura 31 tenemos un ejemplo de sistema cerrado.
Llamamos sistema aislado a aquel cuyas paredes no permiten ni la transferencia de masa ni la transferencia de energía. Si recordamos la primera ley de la termodinámica, nos será fácil reconocer la validez del siguiente postulado: "La energía de un sistema aislado es constante."

Figura 31. Sistema cerrado.
Figura 32. Sistema aislado.
Es difícil tener un sistema perfectamente aislado. Un dispositivo común y conocido que pretende tener paredes aislantes, es el recipiente térmico que utilizamos para mantener nuestros alimentos a una temperatura constante.
Existen sistemas llamados abiertos, cuyas paredes permiten el intercambio de masa y de energía entre sistema y alrededores. De estos sistemas hablaremos más adelante.
La termodinámica estudia los sistemas que se encuentran en equilibrio. Esto significa que las propiedades del sistema —típicamente la presión, la temperatura, el volumen y la masa— son constantes. En la vida cotidiana, es difícil encontrar un sistema que esté, de manera rigurosa, en equilibrio. Sin embargo, hay sistemas en los que las propiedades están cambiando, pero en una forma tan lenta que, para fines prácticos, podemos considerarlos como sistemas en equilibrio.
Esto sucede en muchos sistemas abiertos, uno de los cuales podemos ser nosotros mismos. ¿Somos un sistema en equilibrio? Es evidente que no, pues podemos observar que vamos envejeciendo con los años. Nuestra piel se va arrugando, nuestro pelo encanece o desaparece. Pero si nos ponemos frente a un espejo durante varias horas, es claro que no podríamos notar este proceso de envejecimiento.
Nuestro organismo está diseñado para mantener una temperatura constante. Ya hemos mencionado que normalmente este valor es de unos 37°C. El cambio en unos cuantos grados puede ser de consecuencias fatales. ¿Cómo logra nuestro cuerpo mantener su temperatura?
Cuando decimos que hace mucho calor, es porque nuestros sentidos detectan que la temperatura de los alrededores es mayor que la de nuestro cuerpo. Generalmente sudamos mediante un proceso llamado transpiración. Eliminamos agua, la cual utiliza energía para evaporarse. Esta energía la toma de nuestro cuerpo y ello nos ayuda a mantenernos a una temperatura constante.
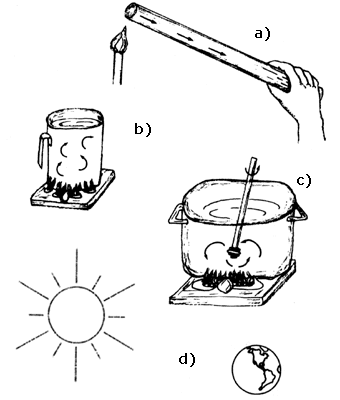
Figura 33. Transmisión de calor: (a) por conducción; (b) por convección libre; (c) por convección forzada, y (d) por radiación.
Este fenómeno lo podemos experimentar fácilmente si ponemos un poco de alcohol en nuestras manos. Si movemos las manos para facilitar la evaporación del alcohol, sentiremos una sensación de frescura. Esto se debe a que el alcohol, para pasar de estado líquido a vapor; requiere de energía y la toma de los alrededores.
En este caso, los alrededores son básicamente nuestra piel. Al perder esta energía de nuestra piel, la temperatura disminuye momentáneamente y sentimos "frío". La sensación desaparece rápidamente, pues nuestra temperatura se equilibra de nuevo.
La transferencia de calor entre una región y otra del sistema o bien entre el sistema y sus alrededores puede llevarse a cabo por tres medios diferentes: convección, conducción y radiación.
Conducción es la transferencia de calor de una parte de un cuerpo a otra parte del mismo cuerpo, o de un cuerpo a otro cuerpo con el que está en contacto físico, sin que podamos apreciar un desplazamiento de las partículas que forman estos cuerpos. Cuando tomamos una pequeña varilla metálica por un extremo y calentamos el otro extremo, por ejemplo metiéndolo al fuego, muy pronto sentiremos el calor en el extremo que estamos deteniendo con nuestra mano. El calor se ha transmitido por conducción a través de la varilla. Al igual que sucede con los conductores eléctricos, no todos los cuerpos conducen el calor con la misma facilidad. Si repetimos la experiencia de la varilla pero ahora utilizando un cuchillo con mango de madera, este material impedirá en gran medida el paso del calor hacia nuestra mano.
Convección es la transferencia de calor de un punto a otro punto dentro de un fluido, gas o líquido, mediante la mezcla de regiones frías con regiones calientes. En la convección "natural", el movimiento del fluido se debe exclusivamente a las diferencias locales de densidad ocasionadas por las diferencias en temperaturas en las distintas regiones del sistema. En la convección "forzada" se utilizan medios mecánicos para favorecer el mezclado, por ejemplo, cuando calentamos nuestros alimentos es muy común que utilicemos un cucharón para agitar el fluido y obtener un calentamiento más uniforme.
Radiación es la transferencia de calor de un cuerpo hacia otro que no se halla en contacto con aquél, mediante ondas que viajan a través del espacio. El ejemplo de transmisión de calor por radiación más conocido por nosotros es el del calor que recibimos desde el Sol.
Ecuación del modelo de gas ideal
De las consideraciones anteriores podemos intuir que debe existir una relación
entre el volumen (V), la presión (P) y la temperatura (T) de
un cuerpo. Para el caso más simple, que es el de un gas, la ecuación más sencilla
que conocemos es la ecuación del gas ideal:
donde n representa el número de moles que tenemos en el sistema (moles
= peso en gramos/peso molecular) y R es un numero conocido como la constante
de los gases.
La constante, R, de los gases se utiliza en la resolución de muchos problemas fisicoquímicos y por esta razón suele encontrarse en los libros de texto expresada en diferentes unidades. Los valores más utilizados son:
|
8.3145J / K mol, 8.3145 Pascal m3 / K mol |
|
0.08206 litros-atmósfera / K mol |
|
1.9872 calorías / K mol |
Esta ecuación proviene de una idealización en la que consideramos, entre otras cosas, que las moléculas no interactúan. Si comparamos los resultados obtenidos con esta ecuación con los obtenidos por experimentación en el laboratorio, encontraremos que la ecuación nos da resultados más confiables cuando las condiciones del gas "real" son de presiones bajas y temperaturas altas, ya que dichas condiciones favorecen que las moléculas no interactúen.
Es común que hablemos de gases "ideales" y gases "reales", considerando que los primeros son aquellos gases cuyo comportamiento es bien descrito por la ecuación PV= nRT. Es claro que todos los gases que conocemos son reales y que resulta más correcto hablar de gases que se comportan de acuerdo con el modelo ideal y gases cuyo comportamiento no es descrito adecuadamente por el modelo de gas ideal.
Por lo anterior; es más correcto decir "ecuación del modelo de gas ideal" que ecuación del gas ideal.