IV. LAS REACCIONES QUÍMICAS Y EL CALOR
EN LA NATURALEZA ocurren continuamente cambios químicos que pueden pasar inadvertidos para los que no son especialistas en la disciplina. Difícilmente se puede estar consciente, por ejemplo, de las innumerables reacciones químicas que ocurren en nuestro cuerpo relacionadas con la respiración, el crecimiento, la alimentación, la reproducción, etcétera.
Las plantas verdes, por ejemplo, absorben dióxido de carbono (CO2)
de la atmósfera y con la energía proveniente del Sol, el agua y la clorofila
(pigmento que les da el color verde), son capaces de producir azúcares y oxígeno
libre. Este complicado proceso químico de la naturaleza se llama fotosíntesis.
12 H2O + 6 CO2 ® C6H12O6 + 6 O2 + 6 H2O
Los animales que se alimentan de plantas verdes, ingieren azúcares 1
![]() y
otros productos químicos elaborados por las plantas, y de esta manera obtienen
la energía que requieren para el desarrollo de sus funciones vitales. Este
cambio químico, que ocurre en los animales, devuelve al ambiente agua y dióxido
de carbono en la expiración.
y
otros productos químicos elaborados por las plantas, y de esta manera obtienen
la energía que requieren para el desarrollo de sus funciones vitales. Este
cambio químico, que ocurre en los animales, devuelve al ambiente agua y dióxido
de carbono en la expiración.
La investigación química y el desarrollo tecnológico producen continuamente nuevos materiales: detergentes, colorantes, aromatizantes, conservadores, plásticos, etcétera.
Sin la química no habría automóviles, fotografía, televisores, materiales sintéticos, cosméticos, ni muchas otras cosas que utilizamos diariamente.
Las expectativas de vida se han incrementado gracias a la producción de nuevos fármacos (medicamentos). Muchas enfermedades mortales han sido eliminadas debido al desarrollo de métodos químicos y bioquímicos para su control y desaparición. Actualmente, cientos de profesionales se dedican afanosamente a la búsqueda de remedios y/o vacunas para el síndrome de inmuno deficiencia adquirida (SIDA).
También es importante reconocer que existen procesos químicos y tecnológicos que conllevan resultados perjudiciales para la salud de los seres vivos, por ejemplo, la contaminación, la producción de basura, los efectos secundarios de algunos pesticidas, etc., que amenazan a nuestro planeta y pueden causar que se vuelva inhabitable.
El conocimiento de las reacciones químicas es importante, no sólo para los especialistas sino también para la sociedad, ya que ayuda a crear una conciencia sana y responsable en la preservación de nuestro medio ambiente y, en términos generales, de la vida en nuestro planeta.
Para poder conocer un poco de estos procesos es necesario ver de manera sencilla aquello que los químicos llaman reacción química.
Ya hemos visto que la materia (sólidos, líquidos y gases)está formada por átomos que a su vez se combinan con otros átomos y moléculas para producir muchas sustancias que conocemos y usamos. En la producción de nuevos compuestos, se absorbe o se desprende calor.
Se llama termoquímica al estudio de los cambios de calor que ocurren durante una reacción química. Ya hemos visto que la cantidad de calor que se transfiere de un sistema a otro se identifica con la letra Q. Cuando en una reacción química el calor ha entrado al sistema, Q es positivo y a la reacción química se le llama endotérmica; si el sistema pierde calor; Q es negativo y la reacción se llama exotérmica.
En la introducción de este libro hemos mencionado el fenómeno de la combustión. La combustión es un caso particular de las reacciones de oxidación en las cuales una sustancia (o elemento) reacciona con el oxígeno. Para ilustrarlo veamos la reacción de oxidación de un metal:
Metal + oxígeno = óxido metálico + absorción o desprendimiento de calor
Es bien conocido que si se deja un metal, por tiempo prolongado, expuesto al
aire, su superficie se transforma por la formación del óxido. Por ejemplo,
los clavos "oxidados" recubiertos de herrumbre. Esta oxidación de la superficie
se llama corrosión. 2 ![]() En
el caso de nuestro ejemplo, la humedad es un factor importante en la aceleración
de la formación del óxido de fierro. Por la corrosión, al transcurrir el tiempo,
pueden descomponerse o utilizarse maquinarias, transportes, reactores, etc.
En nuestro país, la sola corrosión del metal fierro ocasiona pérdidas por
millones o billones de pesos.
En
el caso de nuestro ejemplo, la humedad es un factor importante en la aceleración
de la formación del óxido de fierro. Por la corrosión, al transcurrir el tiempo,
pueden descomponerse o utilizarse maquinarias, transportes, reactores, etc.
En nuestro país, la sola corrosión del metal fierro ocasiona pérdidas por
millones o billones de pesos.
Los especialistas en corrosión, mediante el estudio de las reacciones químicas, pueden detener y a veces eliminar estos efectos cuando son indeseables.
Algunos metales, como el cinc, níquel, aluminio y el cromo, entre otros, no necesitan ser protegidos de manera especial contra la corrosión, bien sea porque no se oxidan con el aire (el aire contiene 1/5 parte de oxígeno) o porque cuando se forma una capa muy delgada del óxido, éste mismo sirve de protección al resto del material para que no se siga oxidando. Por esta razón se usan como metales protectores de otras superficies más vulnerables a los efectos de la corrosión. Actualmente se usan también materiales plásticos para recubrir y proteger superficies contra estos efectos.
El lenguaje simbólico de la química
En párrafos anteriores escribimos una reacción de oxidación de la siguiente manera:
Metal + oxígeno = óxido metálico + absorción o desprendimiento de calor
Para representar esta reacción de manera más económica y hacerla más explícita,
se utilizan los símbolos de los elementos y las fórmulas químicas de los compuestos.
Tomemos como ejemplo de un metal al mercurio, cuyo símbolo es Hg. La reacción
química de oxidación del mercurio se expresaría en el lenguaje de la química:
Traduzcamos ahora, al lenguaje común, toda la información contenida en esta
ecuación química. Primero veremos el significado de la ecuación y más
adelante trataremos la información contenida en el recuadro.
Hg es el símbolo del mercurio y proviene del nombre original que se le dio en latín a este elemento: hydrargirium (que en español quiere decir plata líquida). Hg es, por lo tanto, una abreviatura del nombre.
(s) es una abreviatura de la palabra sólido.
(+) este signo, igual al de "suma" en las ecuaciones matemáticas, indica que el mercurio se unirá o combinará con el elemento que sigue a continuación.
(O2) O es el símbolo del oxígeno y el número 2 indica que se trata de una molécula de oxígeno formada por 2 átomos.
(g) indica que el oxígeno está en estado gaseoso.
La flecha sustituye al signo = de nuestra ecuación original simplemente porque la flecha puede hacerse del tamaño que se desea y a veces se puede poner información adicional sobre ella. En realidad no necesita mayor justificación: ¡los químicos la prefieren!
A los elementos a la izquierda de la flecha, en nuestro caso el Hg y el O2, se les suele llamar reactivos, y a los que están en el lado derecho de la flecha, productos. Quizá con esto hemos encontrado una justificación al uso de la flecha; los químicos dicen: "El mercurio al reaccionar con el oxígeno produce óxido de mercurio." Así pues, la flecha está en lugar de la palabra produce, el uso del signo = sería incorrecto, ya que de ninguna manera el mercurio y el oxígeno como elementos son "iguales" al óxido de mercurio, que es un compuesto.
Es importante saber si en una reacción química los productos pueden volver
a reaccionar para formar los reactivos originales. Cuando esto sucede, se coloca
en la ecuación una segunda flecha en sentido contrario:
A + B ![]() C + D
C + D
En este caso se dice que la reacción es reversible: puede ocurrir de derecha a izquierda y viceversa. Un ejemplo de una reacción reversible es la del hierro (Fe) con vapor de agua para producir el óxido de hierro 11-111 (Fe3O4) e hidrógeno (H2):
3 Fe + 4 H2O ![]() Fe3 O4 + 4 H2
Fe3 O4 + 4 H2
Si se hace pasar vapor de agua sobre hierro caliente, la reacción procede de
izquierda a derecha. Pero si se hace reaccionar hidrógeno con Fe3O4,
la reacción procede de derecha a izquierda. Por cierto, al Fe3O4
le llamamos magnetita o, más comúnmente, piedra imán. Generalizando, para una
reacción del tipo:
A + B ![]() C + D,
C + D,
cuando ambas reacciones llegan a un estado en el cual se están formando C y D por reacción de A con B, con la misma rapidez que se combinan C y D para formar nuevamente A y B, se dice que se ha alcanzado un estado de equilibrio dinámico. Este equilibrio es función de la temperatura, de la presión y de las cantidades en exceso de reactivos o productos que puedan estar presentes.
En todas las reacciones químicas ocurren cambios de energía, es decii; se puede absorber o liberar energía en forma de calor, luz, energía eléctrica, etcétera.
Si en una reacción se libera energía en forma de calor; decimos que la reacción es exotérmica; si la energía es absorbida, entonces la reacción es endotérmica.
La manera de expresar esto en el lenguaje de las reacciones químicas es mediante el símbolo DH (cambio de entalpía), que precedido de un signo negativo (-DH) indica que la energía es liberada; otra forma de expresar lo mismo es DH < O, esto es, que DH es menor que cero. Si en la reacción se absorbe energía, se antepone un signo + (+DH) o bien en su forma equivalente DH > O (DH es mayor que cero).
|
|
|
|
Lo anterior lo podemos resumir en este cuadro:
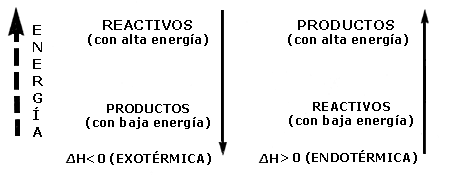
El símbolo H representa la entalpía del sistema y es una función
con propiedades semejantes a la energía interna (U). Cuando
los procesos se llevan a cabo a presión constante, es más conveniente utilizar
la función entalpía.3![]()
Un ejemplo de una reacción exotérmica común es la combustión del gas natural:
Se obtienen unas 13 300 calorías por cada gramo de metano (CH4) quemado.
Un ejemplo de reacción endotérmica es la producción del ozono (O3).
Esta reacción ocurre en las capas altas de la atmósfera, donde las radiaciones
ultravioleta proveen la energía del Sol. También ocurre cerca de descargas eléctricas
(cuando se producen tormentas eléctricas):
El olor del ozono puede usted reconocerlo aun en pequeñas cantidades, por ejemplo: cuando un tren eléctrico de juguete está en operación y saltan chispas. Es un olor irritante.

Figura 34. Foto de un día muy contaminado.
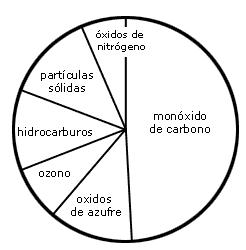
Figura 35. Representación gráfica que muestra las fuentes y las magnitudes
relativas de la contaminación del aire en EUA.
Si usted vive en la ciudad de México o conoce el problema de contaminación que en ella existe, seguramente que la palabra ozono le producirá gran preocupación, si está usted pendiente de los informes que la Secretaría de Medio Ambiente, Recursos Naturales y Pesca (SEMARNAP) presenta al respecto. ¿Qué reacciones químicas están ocurriendo en la atmósfera de esta ciudad que causan una excesiva cantidad de ozono, tan perjudicial para la salud?
Desde luego no es la reacción natural, que hemos descrito y que ocurre en las capas altas de la atmósfera (estratosfera) ya que las radiaciones (fotones) no alcanzan la superficie terrestre. Los científicos no tienen todavía respuestas absolutas con respecto a este proceso de contaminación pero piensan que, al menos de manera parcial, puede ocurrir lo siguiente:
El dióxido de nitrógeno (NO2) es un componente normal del aire, y se disocia por la acción del Sol en la siguiente reacción:
El oxígeno atómico (O) formado, reacciona a su vez con el oxígeno molecular (O2) presente en el aire.
El ozono producido vuelve a reaccionar con el NO de la primera reacción:
en un ciclo natural que evita la producción excesiva de ozono en la superficie.
Sin embargo, pruebas realizadas en el laboratorio demuestran que ciertos tipos de hidrocarburos producidos con los gases de combustión de los motores (sobre todo de la gasolina de los autotransportes) parecen alterar este ciclo natural del NO2. Estos hidrocarburos reaccionan con el oxígeno y los productos formados reaccionan a su vez con el NO para formar NO2. En esta forma, se aumentan las proporciones de O3 y O2 al ser eliminado el NO.
Tanto el exceso de O3 como el de NO2 son
peligrosos para plantas y animales. El NO2 es un gas picante,
de olor dulzón, de color café amarillento (¿usted recuerda el color del llamado
smog?). Otro efecto peligroso es que cuando este exceso de NO2
reacciona con vapor de agua se forma el ácido nítrico (HN03), compuesto
muy conocido, que forma parte de la llamada lluvia ácida, otro de los
desastres de las ciudades muy contaminadas. Otro componente de la lluvia ácida,
el más importante, es el ácido sulfúrico (H2SO4)
que se forma debido a un exceso del elemento azufre (S) también presente
en el petróleo. El azufre, durante la combustión, forma SO2
y SO3, que se combinan con las moléculas de H2O:
La energía asociada con las reacciones químicas está relacionada con las energías
de unión entre los átomos que forman las moléculas. Este proceso es complejo,
ya que durante una reacción algunas uniones químicas se rompen y otras se forman.
Por ejemplo, en la formación del ozono a partir de oxígeno:
|
|
|
|
|
Se rompen uniones (se absorbe energía para romperlas) |
Se forman uniones (al formarse se libera energía pero en menor cantidad) |
|
|
|
||
En el caso de la reacción de combustión del gas natural (metano):
|
|
|
|
|
Se rompen uniones CH Se rompen uniones O2 (Se absorbe menos energía) |
Se forman uniones CO Se forman uniones OH (Se libera más energía) |
|
|
|
||
En los motores de combustión interna de la mayoría de los automóviles, se aprovecha la energía que se desprende de la combustión de la gasolina. Al quemarse el combustible dentro del cilindro, el gas formado genera el movimiento del pistón y posteriormente este movimiento sirve para mover las ruedas del automóvil. Desafortunadamente sólo 20 % de la energía contenida originalmente en el combustible se transforma efectivamente en trabajo útil, esto es, gran parte de la energía se desperdicia.
Conocer los cambios de energía asociados con una determinada reacción química nos ayudará a determinar las posibilidades de que esta reacción ocurra fácilmente en la naturaleza. En general, es más fácil que se den reacciones exotérmicas, ya que las endotérmicas requieren de un suministro de energía. Sin embargo, conocer el DH de una reacción no es suficiente para asegurar que esta reacción ocurrirá o no. También es necesario conocer otras características como, por ejemplo, la necesidad de una cierta energía de activación para que se inicie la reacción. Estos aspectos no son temas del presente libro por lo que sugerimos al lector interesado revisar un libro de termodinámica básica.
Por otra parte, el conocimiento de las variables termodinámicas tampoco nos será de utilidad para establecer la rapidez con que puede ocurrir una reacción. Recordemos que la termodinámica clásica sólo estudia sistemas en equilibrio. La rapidez de una reacción química se suele expresar en términos de cantidad de productos obtenidos por unidad de tiempo o, alternativamente, cantidad de reactivos que se consumen por unidad de tiempo. El estudio de la rapidez con que puede ocurrir una reacción y los factores que afectan dicha rapidez, corresponde a otra rama de la química: la cinética química.
En la sección anterior hemos visto cómo están asociadas las reacciones químicas con los cambios de energía, principalmente en su forma de calor.
El ingenio del hombre ha permitido construir sistemas en los que se utilizan otras reacciones químicas que liberan energía, pero no en forma de calor sino como una corriente eléctrica. Son las conocidas pilas, una de cuyas versiones utilizamos diario para proveer de energía diversos aparatos portátiles como radios de transistores, grabadoras, linternas, etc. Esta pila común es la "pila seca" o pila de Leclanché.
Así como algunas reacciones químicas nos proporcionan energía eléctrica, en ocasiones podemos utilizar el proceso inverso: si aplicamos corriente eléctrica a un sistema químico, podemos producir reacciones químicas y lograr que la energía quede acumulada como energía interna en los productos de la reacción. Un caso interesante es el acumulador que utilizan los automóviles, ya que en él se presenta la interconversión de energía eléctrica y química. Para que el motor arranque se requiere de energía eléctrica, la cual es proporcionada por una reacción química que se produce en el acumulador. Una vez puesto el motor en marcha, un dispositivo genera corriente eléctrica que es suministrada al acumulador para recargarlo". Si cuidamos el acumulador, el ciclo de carga-descarga se puede llevar a cabo miles de veces.
|
|
|
|
|
|
|
|
Debido a los problemas de contaminación, los investigadores de todo el mundo están perfeccionando los automóviles eléctricos. En gran medida, el buen éxito de este tipo de transporte se basa en la invención de acumuladores más eficientes.
Generalmente asociamos la energía eléctrica con un flujo de electrones en el interior de un material conductor. Sin embargo, en los sistemas electroquímicos, el transporte de carga se realiza también gracias a un movimiento de átomos y moléculas con carga, llamados iones.
Figura 36. Las principales fuentes de contaminación.
Ya sabemos lo peligroso que resulta el manejar un aparato eléctrico con las manos mojadas, debido a que el agua, que normalmente contiene diversas sales, resulta ser muy buen conductor de la corriente eléctrica y disminuye la resistencia de nuestra piel al paso de una descarga. En realidad, el agua pura es muy mala conductora de la electricidad. Sin embargo, las sustancias químicas disueltas, presentes en forma de iones, son las responsables de la aparente buena conductividad del agua.