II. ANTES DE LA COMIDA
EN ESTE capítulo veremos algunas de las operaciones imprescindibles
para la elaboración doméstica de los alimentos y su relación con algunas variables
fisicoquímicas. Así trataremos la influencia del tamaño de los trozos de zanahoria
en la preparación de las sopas, el encendido de los cerillos y su composición,
el funcionamiento del horno, etcétera.
CORTAR Y PICAR O SUPERFICIE DE CONTACTO
Un procedimiento muy común al preparar los alimentos es el trozado de los mismos. Sea que se vayan a cocinar zanahorias, filetes, etc., es casi inevitable cortarlos.
En general la velocidad de una reacción aumenta cuando aumenta la superficie de contacto (o superficie activa) entre ambos reactantes. Lo anterior explica que sea "más violenta" la reacción de la "Sal de uvas Picot" que la del "AlkaSeltzer".
La traducción del párrafo previo, en términos culinarios, es: se cuecen más rápidamente los alimentos cortados en trozos pequeños.
Es notable cómo aumenta la superficie activa de una zanahoria cuando se corta sucesivamente. Si consideramos un cubo de arista x su volumen es x3 y su área total es 6x2. Al partir en mitades al cubo el volumen total es el mismo pero el área total es 6x2 + 2x2 por las dos nuevas caras obtenidas. Si se parte el cubo original en 8 cubos iguales el área total será 8(6(x/2)2) = 12x2 si cada uno de estos cubitos se vuelve a partir en 8 tendremos un área total de 8(8(8(6(x/4)2))) = 24x2. Así cada vez que se parte en dos la arista de un cubito el área total se duplica.
En otras palabras, mientras más molido esté el café más cargado queda, aunque
sea el mismo número de cucharadas. Los químicos conocen como lixiviación1
![]() al
proceso de extracción por disolventes, esto es, a la preparación de café express,
como veremos en el capítulo IV.
al
proceso de extracción por disolventes, esto es, a la preparación de café express,
como veremos en el capítulo IV.
Análogamente para obtener un color intenso al preparar la sopa de betabel conviene cortarlo en trozos muy pequeños.
El bicarbonato de sodio casero (mal llamado "carbonato" por las amas de casa) tiene una gran superficie de contacto por lo que es un eficaz eliminador de olores, sean de alimentos en el refrigerador o de tabaco en los ceniceros, véase el capítulo II "Donde se trata acerca de los olores...".
Por otro lado, en los gases las partículas son del tamaño de las moléculas, por lo que hay una enorme superficie activa, de aquí que resulta sumamente fácil encender la estufa. Cosa muy distinta cuando se trata de hacer carnitas al carbón; en este caso los trozos grandes de carbón presentan poca superficie activa y conviene trozarlo en pedazos pequeños, poner pedazos de periódico por abajo y encenderlo. Rociar con gasolina el carbón resulta poco efectivo pues la temperatura más alta se tiene cerca del extremo superior de la flama, no en la base. Del mismo modo, si se desea enfriar rápidamente las cervezas conviene tener el hielo en trozos pequeños. Hay más detalles para resolver esta emergencia en el capítulo III, "El enfriamiento de las chelas".
Una forma tradicional de eliminar el olor a quemado de arroz, frijoles, etc., es poner un paño húmedo sobre la olla. Como es sabido, el olor lo producen sustancias volátiles, generalmente gases muy solubles a baja temperatura. La función del paño húmedo es no sólo proveer el agua para que se disuelvan sino también, una gran superficie de contacto. Con ello las abuelas nos dan la prueba de que "más sabe el diablo por viejo.. .".
La carne seca (cecina) y el bacalao seco se fabrican en rebanadas de poco espesor a fin de tener una gran superficie de contacto con el aire; de esta manera se asegura que el agua de la carne se evaporará rápidamente sin dar tiempo a que los microorganismos la descompongan. Ciertamente también se les añade sal; de esto ya hablamos en el capítulo 1. Un último ejemplo acerca de la importancia de la superficie activa: si se añade ablandador a los bisteces conviene que éstos sean delgados.
Es bien sabido que para encender una vela lo primero que se necesita es la
vela. Y para encender la estufa, lo segundo es un cerillo2 ![]() o
un fósforo.3
o
un fósforo.3 ![]()
Pero ¿qué contiene un cerillo? ¿Por qué se mantiene la reacción una vez iniciada?
Antes veamos algo sobre el origen de los cerillos.
Los intentos de producir cerillos comenzaron en 1680 con Robert Boyle, poco
después del descubrimiento del fósforo4 ![]() por
el alquimista Hennig Brand. Con todo, el cerillo, tal como lo conocemos, fue
inventado en 1834. Un ayudante de Boyle, Godfrey Haukewitz, empleaba astillas
de madera con cabeza de azufre, la cual, con ayuda del fósforo y frotamiento
se encendía. Sin embargo tales cerillos eran malolientes, peligrosos, caros
y, por si no bastara lo anterior; venenosos.
por
el alquimista Hennig Brand. Con todo, el cerillo, tal como lo conocemos, fue
inventado en 1834. Un ayudante de Boyle, Godfrey Haukewitz, empleaba astillas
de madera con cabeza de azufre, la cual, con ayuda del fósforo y frotamiento
se encendía. Sin embargo tales cerillos eran malolientes, peligrosos, caros
y, por si no bastara lo anterior; venenosos.
Al comenzar el siglo XIX el método usual de encender un fuego era usar
un pedernal y un eslabón5 ![]() martillo
para encender una mecha. La idea de emplear trocitos de madera con azufre reapareció
en 1800 y al poco tiempo ya se mezclaban clorato de potasio y azúcar al azufre
para mejorar su combustión. En 1830 ya había una versión doméstica de los cerillos,
los llamados "cerillos prometeicos" estaban hechos de un rollito de papel, el
cual tenía en un extremo la mezcla con un pequeño tubo hermético que contenía
un poco de ácido sulfúrico. Rompiendo el tubito con un par de tenacillas o ¡con
los dientes! el ácido reaccionaba con la mezcla encendiendo el papel.
martillo
para encender una mecha. La idea de emplear trocitos de madera con azufre reapareció
en 1800 y al poco tiempo ya se mezclaban clorato de potasio y azúcar al azufre
para mejorar su combustión. En 1830 ya había una versión doméstica de los cerillos,
los llamados "cerillos prometeicos" estaban hechos de un rollito de papel, el
cual tenía en un extremo la mezcla con un pequeño tubo hermético que contenía
un poco de ácido sulfúrico. Rompiendo el tubito con un par de tenacillas o ¡con
los dientes! el ácido reaccionaba con la mezcla encendiendo el papel.
También por esas fechas aparecieron los primeros cerillos de fricción, conocidos con la marca "Lucifer"; la cabeza estaba formada por sulfuro de antimonio y cloruro de potasio aglutinados con goma y agua; tenían en la caja una advertencia para que no los usaran "las personas de pulmones delicados". Se encendían frotándolos entre dos hojas de papel de lija.
Los cerillos de seguridad, fabricados con el menos peligroso fósforo rojo (el cual no presenta combustión espontánea ni es tóxico), se comenzaron a usar en Suecia en 1852. En éstos, los ingredientes necesarios para la combustión se hallan separados, unos en la cabeza y otros en una superficie especial para frotarlos. Sin embargo, se seguían fabricando cerillos con fósforo blanco debido a su gran resistencia a la humedad. Cuando se descubrieron sus efectos tóxicos en los obreros de las fábricas se prohibió la fabricación de cerillos con fósforo blanco en la Conferencia de Berna de 1905.
Los cerillos actuales tienen en la cabeza sulfuro de antimonio y diversos agentes oxidantes como clorato de potasio y azufre o carbón; y en la superficie de frotamiento, fósforo rojo, vidrio molido, y aglutinante.
Para que ocurra una reacción química se necesita cierta energía mínima para
su inicio, llamada "energía de activación". Al encender la estufa esta energía
es suministrada por el cerillo. En las reacciones de combustión, como la del
gas doméstico, se libera suficiente energía calorífica6 ![]() como
para sostener la reacción y, además, calentar la sopa.
como
para sostener la reacción y, además, calentar la sopa.
El encendido de un fósforo implica muchas reacciones sucesivas. Aunque el mecanismo no está del todo comprendido es, en principio, el siguiente: la energía mecánica debida al frotado del cerillo es mayor que la energía de activación para la reacción del fósforo rojo (contenido en la tira café oscuro de la cajetilla); ésta reacción libera suficiente calor como para iniciar la combustión del azufre (en la cabeza del cerillo); y ésta libera suficiente calor como para iniciar la combustión de la madera (o papel encerado) del cerillo.
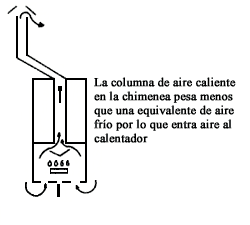
Figura II. 1. Chimenea de calentador doméstico.
Al parecer, los antiguos egipcios ya empleaban hornos para la fabricación de pan hace cosa de 6 000 años. De entonces a la fecha el diseño básico no ha cambiado. Hay, sin embargo, adelantos. Una ventana de vidrio doble permite ver el interior sin tener que abrir la puerta lo que (bajaría la temperatura del horno), una chimenea especialmente diseñada permite aprovechar mejor el combustible y hay, también, un dispositivo para controlar la temperatura. A continuación algunas observaciones acerca de este utensilio:
Al encender el horno podrá notarse que el vidrio de éste primero se empaña y luego se seca. La combustión del gas doméstico produce H20 que se condensa en la superficie fría del vidrio (y del metal, pero es más fácilmente visible en el vidrio)... hasta que éste se calienta por la misma combustión.
| 13 | ||
|
C4 H10
+
|
|
O2 Ť 4CO2 + 5H2O |
| 2 |
La función de la chimenea en un calentador de gas, como el horno, no es únicamente
dar salida a los gases de la combustión. Puesto que la densidad del aire es
menor que la de los gases calientes, se produce una diferencia de presión entre
dos columnas, figura II.1, la cual asegura el suministro indispensable del aire
a la cámara de combustión.
Desde luego el alto de la chimenea tiene que ver con la eficiencia del calentador: un chimenea larga da un gran "tiro" con lo que se asegura una combustión completa por tener exceso de oxígeno. Sin embargo un gran tiro hace que se pierda mucho calor por la chimenea en vez de transmitirlo al material que se desea calentar.
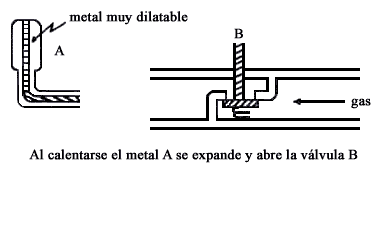
Figura II. 2. Controlador de temperatura.
Para controlar la temperatura del horno se emplea el mal llamado "termopar" que es, realmente, un bimetal. Se trata de un tubo de cobre que contiene una varilla con un extremo altamente dilatable, este extremo se halla cerca de la flama sea del horno, sea del calentador de agua, figura II.2, según la temperatura es el desplazamiento del extremo que llega a una válvula, así se controla el suministro de gas.
En 1824 Faraday encontró que el AgCl absorbe a temperatura ambiente al NH3. Dispuso un aparato como el mostrado en la figura II.3 de forma que al calentar la sal de cloruro de plata amoniacal se liberaba NH3 que se condensaba en el otro extremo del tubo. Al apagar la flama encontró que el NH3 líquido comenzaba a hervir ¡enfriando el tubo!
Cuando se deja escapar el gas de un encendedor de bolsillo (sin encenderlo) puede notarse que el gas sale frío. Se tiene en este caso una expansión Joule-Thomson. El lector sospechará acertadamente que tal es la base del funcionamiento de un refrigerador. Pero no todos los gases se comportan de la misma manera. El helio, por ejemplo, se enfría cuando se comprime y se calienta cuando se expande. Hay una temperatura, característica de cada gas, en la cual no ocurre cambio de temperatura con la expansión y se le llama "temperatura de inversión"; el lector perspicaz podrá hallar el valor aproximado de la temperatura de inversión para el He y el N2 a partir de la tabla II.1. El coeficiente Joule-Thomson (m J T) indica la variación en grados Kelvin de la temperatura del gas debida a una variación de 1 atmósfera en su presión.
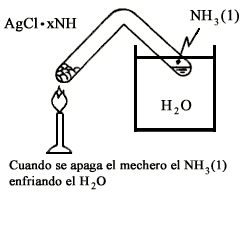
Figura II. 3. Refrigerador de Faraday.
|
|
||
|
t°
|
m
JT H E 1 at
|
m
JT N 2 1 at
|
|
|
||
|
-100 0 100 200 |
- 0.058 - 0.062 - 0.064 - 0.064 |
0.649 0.266 0.129 0.056 |
|
|
||
Es claro que mientras mayor sea el coeficiente m
J T del gas usado en el refrigerador mayor será su
eficiencia. Comercialmente se usan los "freones"7 ![]() para tal fin. Éstos tienen un alto m J
T y una baja temperatura crítica,8
para tal fin. Éstos tienen un alto m J
T y una baja temperatura crítica,8 ![]() de
forma que no se llegan a licuar a la temperatura de operación.
de
forma que no se llegan a licuar a la temperatura de operación.
La primera patente norteamericana para la fabricación de un refrigerador fue presentada en 1834 por Jacob Perkins. Por otro lado un impresor escocés, James Harrison, empleaba éter para limpiar los tipos de su imprenta, según era costumbre. Notó entonces la capacidad del éter de enfriar al evaporarse. Tanto el refrigerador de Perkins como el de Harrison empleaban la evaporación de líquidos muy volátiles para enfriar; éstos posteriormente se comprimían para licuarlos y volverlos a usar.
La ventaja de la refrigeración, y de la congelación en particular; es que inhibe el desarrollo de bacterias y de otros microorganismos contenidos en los alimentos; sin embargo, éstos recuperan su actividad al regresar a la temperatura ambiente.
Pero no todo son ventajas, al congelarse el agua aumenta su volumen, lo que produce un cambio en la textura de los alimentos congelados, desnaturaliza las proteínas y rompe las emulsiones, como ocurre al congelar la leche, que se forman gotas de aceite que se hallaban emulsionadas. Por lo mencionado conviene hacer la congelación lo más rápidamente posible a fin de que los cristales de hielo formados sean microscópicos y no rompan la estructura de los alimentos. Para ello el congelador debe estar a muy baja temperatura (aproximadamente -18°C). Si al descongelar la carne se forma un líquido sanguinolento es señal de que los cristales de hielo formado rompieron la estructura celular.
La mayoría de las bacterias, levaduras y mohos crecen mejor entre 16 y 38°C. A una temperatura menor de 10°C el crecimiento es mucho más lento. De aquí que, como mencionamos, los alimentos refrigerados o congelados se conserven más tiempo debido a la disminución de la actividad microbiana, con ello se evita la descomposición de los alimentos que puede provocar intoxicaciones, amén de mal sabor. Debe anotarse que algunos alimentos, debido a la presencia de componentes disueltos, se congelan a cerca de -10°C. Por lo anterior la temperatura del congelador se mantiene cerca de -18°C, mientras que la del refrigerador está entre 4.5 y 7°C.
Debe subrayarse que ni la refrigeración ni la congelación esterilizan los alimentos; en cuanto los alimentos se sacan del refrigerador los organismos sobrevivientes reinician su crecimiento y, dividiéndose, se multiplican.
|
|
|||
|
Alimento
|
0°C
|
Duración en días 22°C
|
38° C
|
|
|
|||
| Carnes rojas | 6 a 10 | 1 | 1 |
| Pescado | 2 a 7 | 1 | 1 |
| Aves | 5 a 18 | 1 | 1 |
| Carne seca | 1 000 o más | 350 o más | 100 o más |
| Frutas | 2 a 180 | 1 a 20 | 1 a 7 |
| Frutas secas | 1 000 o más | 350 o más | 100 o más |
| Hortalizas | 3 a 20 | 1 a 7 | 1 a 3 |
| Raíces | 90 a 300 | 7 a 50 | 2 a 20 |
| Semillas secas | 1 000 o más | 350 o más | 100 o más |
|
|
|||
Una gran ventaja de la refrigeración es la de no modificar el sabor; la textura ni el valor nutritivo de los alimentos (cosa que no ocurre siempre con la deshidratación o el enlatado); sin embargo el grado en que evita el deterioro de los alimentos es muy reducido, tabla II.2. Los valores indicados son meramente indicativos. Los cerdos alimentados con cacahuates y soya (grasas no saturadas) dan carne y manteca más blandas que los alimentados con cereales, además la carne de estos últimos se conserva mejor en el frío. Si los animales están descansados antes de su sacrificio su carne se conserva mejor pues no han consumido sus reservas de glucógeno (almidón animal), el cual se convierte en ácido láctico con poder conservador.
Una desventaja del refrigerador doméstico es la facilidad con que se intercambian los sabores y olores. Así, por ejemplo, la mantequilla y la leche absorben el olor del pescado y la fruta; los huevos el de la cebolla.
El enfriamiento disminuye la velocidad de algunas reacciones químicas y enzimáticas, no sólo la velocidad de crecimiento de los microorganismos, de aquí que se le emplee para controlar el envejecimiento de los quesos.
Por otro lado el enfriamiento facilita el pelado y deshuese de los duraznos y el rebanado de la carne y del pan, precipita las ceras de los aceites comestibles y conserva el CO2 de los refrescos y cervezas al aumentar la solubilidad del gas con la baja temperatura.
Y ya que hablamos de temperatura conviene distinguir y precisar los siguientes términos: temperatura, calor; conductividad térmica y otros relacionados.
La ambigŁedad cotidiana del término calor se puede ver en expresiones como:
"este suéter es muy calientito", "¡qué calor hace en el Metro!", etc. Lo anterior
se relaciona, desde luego, con la sensación de temperatura. Cosa muy
diferente del concepto de temperatura empleado por los científicos. La
sensación de temperatura se puede comprender en términos de la ley cero
de la termodinámica.9 ![]() Ésta
es, como todas, una generalización de la experiencia: "dos cuerpos que estén
en equilibrio termodinámico con un tercero están en equilibrio termodinámico
entre sí." Otra generalización es que la energía calorífica se transmite de
los cuerpos de mayor temperatura a los de menor; así como los objetos caen de
los lugares más altos a los más bajos. Ahora bien, puesto que el cuerpo humano
tiene una temperatura de 37°C continuamente está en desequilibrio termodinámico
con el ambiente (suponiendo unos 20°C en el medio). De aquí que la sensación
de temperatura resulta del sentido de flujo de calor en el sistema cuerpo- ambiente.
Ésta
es, como todas, una generalización de la experiencia: "dos cuerpos que estén
en equilibrio termodinámico con un tercero están en equilibrio termodinámico
entre sí." Otra generalización es que la energía calorífica se transmite de
los cuerpos de mayor temperatura a los de menor; así como los objetos caen de
los lugares más altos a los más bajos. Ahora bien, puesto que el cuerpo humano
tiene una temperatura de 37°C continuamente está en desequilibrio termodinámico
con el ambiente (suponiendo unos 20°C en el medio). De aquí que la sensación
de temperatura resulta del sentido de flujo de calor en el sistema cuerpo- ambiente.
El organismo humano tiene un pérdida continua de calor del orden de 15 kilocalorías/hora, tabla II.3. Es interesante mencionar que, como señala la tabla, una persona sentada y pensando no consume más energía que un foco de 20 watts.
Es precisamente este flujo de calor el que nos dice si "hace calor" o no. Si el cuerpo pierde calor a baja velocidad "sentimos calor"; y al contrario, si se disipa calor a gran velocidad "sentimos frío".
De hecho un suéter "calientito" no produce calor. En todo caso es un buen aislante térmico y, en rigor científico, es un suéter "con un bajo coeficiente de conductividad térmica".
|
|
||
| Sentado | 15 kcal/hora | 17 wats |
| De pie relajado | 20 | 21 |
| Escribiendo | 20 | 21 |
| Caminando | 200 a 350 | 210 a 400 |
| Corriendo | 800 a 1 000 | 930 a 1 160 |
| Bailando | 200 a 400 | 210 a 460 |
| Gimnasia | 200 a 500 | 210 a 460 |
| Tenis | 400 a 500 | 460 a 600 |
| Natación | 300 a 900 | 350 a 1 050 |
| Escalamiento | 700 a 900 | 800 a 1 050 |
|
|
||
Puesto que el flujo de calor depende de una diferencia de temperaturas... si en el Metro la temperatura es alta, el flujo de calor del cuerpo humano al ambiente es menor y, obviamente, "sentimos calor". La función de la ropa (aparte de la social y erótica) es controlar la pérdida de calor del organismo por las corrientes de convección. Véase en el capítulo III, "La convección en el atole".
Ahora bien, la sensación de calor depende de muchos factores. Basta mencionar que al soplar con la boca abierta sobre una mano se siente calor; sin embargo, al soplar con la boca casi cerrada se siente frío. En la sensación de temperatura influyen la humedad ambiental, la humedad del organismo, la presencia de corrientes de aire y, por supuesto, la temperatura (la de los científicos, se entiende).
Una de las formas en que el cuerpo controla su temperatura es la transpiración.
Debido al alto calor latente de evaporación10 ![]() del
agua (10.5 kcal/mol a 25°C), al pasar a fase vapor; el sudor "toma calor"
del organismo y así disminuye su temperatura. Obviamente se requiere que el
porcentaje de humedad en el ambiente sea bajo para que haya evaporación... lo
que explica que "se sienta más calor" en los lugares húmedos (el bello puerto
jaibo, p. ej.)11
del
agua (10.5 kcal/mol a 25°C), al pasar a fase vapor; el sudor "toma calor"
del organismo y así disminuye su temperatura. Obviamente se requiere que el
porcentaje de humedad en el ambiente sea bajo para que haya evaporación... lo
que explica que "se sienta más calor" en los lugares húmedos (el bello puerto
jaibo, p. ej.)11 ![]() que
en los lugares secos (Monterrey). Anotemos marginalmente que los perros casi
siempre tienen la lengua de fuera porque no sudan; para controlar su temperatura
exhalan el calor... por la lengua y las orejas.
que
en los lugares secos (Monterrey). Anotemos marginalmente que los perros casi
siempre tienen la lengua de fuera porque no sudan; para controlar su temperatura
exhalan el calor... por la lengua y las orejas.
La capacidad que tienen los materiales para conducir la energía calorífica12
![]() determina
que una sustancia sea más "fría" que otra. Así el hierro es más "frío" que la
madera porque el cuerpo humano pierde fácilmente calor en contacto con el metal;
en otros términos: el metal conduce más rápido el calor que le cede el cuerpo
humano produciendo una sensación diferente que la madera.
determina
que una sustancia sea más "fría" que otra. Así el hierro es más "frío" que la
madera porque el cuerpo humano pierde fácilmente calor en contacto con el metal;
en otros términos: el metal conduce más rápido el calor que le cede el cuerpo
humano produciendo una sensación diferente que la madera.
Una gráfica, llamada diagrama de fases del H2O, nos permite entender la ventaja de bajar la flama cuando ya están hirviendo los frijoles de "l'olla".
A continuación una breve explicación del diagrama de fases. La figura II.4 muestra con líneas continuas las temperaturas y presiones de equilibrio de las diferentes fases del agua: líquido, sólido y vapor. Así, a una presión de 1 at la temperatura de equilibrio para las fases vapor y líquido es 100°C. Como ilustración de lo complejo que puede ser el hielo, en la figura II.5 se muestra su diagrama de fases a una presión que no es, obviamente, muy frecuente.
A presión constante, la temperatura máxima de equilibrio entre el vapor y el líquido es la temperatura de ebullición del H2O. Nótese, que la curva de equilibrio LG (líquido—gas) se interrumpe a 374°C; ésta es la temperatura crítica del agua; la presión correspondiente se llama, obviamente, "presión crítica".
Por lo dicho, la máxima temperatura a la que se puede hervir los frijoles es 93°C en el D.F. Si se "sube" la flama de la estufa lo único que se logra es evaporar el agua más rapidamente y... que haya que poner más agua (previamente calentada, según establece la mexicana tradición culinaria). Los frijoles de ninguna manera se cuecen más rápido por subir la flama pues esto no aumenta la temperatura del agua en ebullición. La única manera de reducir el tiempo de cocimiento es emplear una marmita de Papin, digestor u olla de presión.
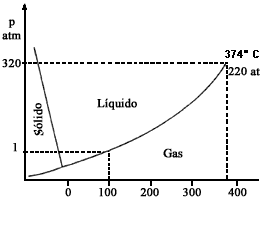
Figura II. 4. Diagrama de fases del H2O.
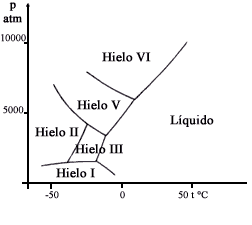
Figura II. 5. Diagrama de fases del hielo a altas presiones.
En este punto es oportuno mencionar el origen de este implemento y su funcionamiento.
Denise Papin fue ayudante de Robert Boyle y ambos se movían en el ambiente de la Royal Society. En 1679 presentó un "digestor de vapor" que era un recipiente con una tapa hermética de forma que se podían cocinar alimentos a una temperatura mayor que la usual. Puesto que la tapa hermética permitía una presión interior mayor que la atmosférica, la temperatura de ebullición del agua era mayor que la ordinaria, véase la figura II.6. El "digestor de vapor" contaba, por lo que pudiera ofrecerse, con una válvula de seguridad, también diseñada por Papin. Esta contribución fue completada un año más tarde con un recetario (elaborado por el mismo Papin) para cocinar conejo, pichón, carnero, pescado, frijol, cereza, etc. Los autoclaves son, en principio, marmitas de Papin, empleadas para fines tan diversos como la obtención de caucho sintético, hidrogenación de aceites insaturados (véase en el capítulo I, "Margarina"), fabricación de colorantes, margarinas, fármacos y plásticos, para la esterilización de instrumental quirúrgico, etcétera.
Actualmente las ollas de presión cuentan con varios dispositivos que aumentan su eficiencia y seguridad. Una olla de presión típica, figura II.6, tiene una válvula de seguridad en el centro de la tapa, una válvula pequeña de saturación, y una rosca de seguridad.
Cuando comienza la cocción queda aire encerrado en la olla, el cual conviene
eliminar pues, mientras mayor sea el porcentaje de humedad, mayor será la dificultad
para conseguir la evaporación (y por consiguiente mayor será la temperatura
de ebullición).13 ![]() La valvulita permite la salida del aire y se cierra al aumentar lo suficiente
la presión interna. Si la presión dentro de la olla es muy grande se bota la
válvula central. En caso de no ocurrir lo anterior la rosca de la tapa se deforma
y salta la tapa, pero la olla no explota con fractura.
La valvulita permite la salida del aire y se cierra al aumentar lo suficiente
la presión interna. Si la presión dentro de la olla es muy grande se bota la
válvula central. En caso de no ocurrir lo anterior la rosca de la tapa se deforma
y salta la tapa, pero la olla no explota con fractura.
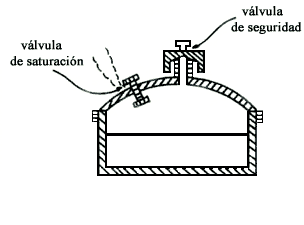
Figura II. 6. Olla de presión.
De esta manera el fabricante garantiza lo más posible la seguridad del usuario o, menos frecuentemente, de la usuaria.
La presión interna que se llega a generar en la olla es de 1.40 kg cm2, lo que implica una temperatura de ebullición del agua de casi 130°C. No parece mucho, pero basta para aumentar la velocidad de las reacciones de cocimiento casi diez veces.
Y ya que hablamos de presión, es decir; de:
|
F
|
|
|
P =
|
|
|
A
|
fuerza aplicada al área unitaria, se entiende por qué hay que afilar cuchillos, tijeras, navajas, etc. En tanto sea menor el área en que se aplica una fuerza dada, mayor será el cociente F/A, esto es, la presión.
De los efectos de la presión en el azúcar tratamos en el capítulo IV, en "Triboluminiscencia".
En 1897 Eduard BŁchner; químico alemán, hizo un extracto de levadura que, para
su sorpresa, al ponerlo en jugo de uva produjo fermentación.14 ![]() Por
primera vez en la historia la glucosa se transformó en alcohol y bióxido de
carbono sin usar microorganismos. El extracto que obtuvo BŁchner lo llamó "enzima"
que significa "en el jugo".
Por
primera vez en la historia la glucosa se transformó en alcohol y bióxido de
carbono sin usar microorganismos. El extracto que obtuvo BŁchner lo llamó "enzima"
que significa "en el jugo".
Las enzimas controlan innumerables reacciones del organismo. Una rebanada de chocolate contiene 400 kilocalorías, suficientes para elevar la temperatura del cuerpo humano a 43°C, lo que provocaría la muerte. Sin embargo, las enzimas del cuerpo controlan una cadena de reacciones que dosifica notablemente el poder energético del chocolate almacenándolo para el momento que se requiera.
El mecanismo por el que actúan las enzimas se puede ilustrar con una cerradura y su llave. Para abrir la puerta de la reacción se necesita una llave (enzima). La presencia de una llave semejante puede impedir la acción de la enzima, por lo que se le llama "inhibidor". Algunos agentes químicos empleados para conservación de alimentos actúan como llaves equivocadas que bloquean la cerradura, de esta manera impiden que la enzima correcta provoque las reacciones de descomposición.
La mayoría de las enzimas se desnaturalizan fácilmente por el calor. 70 u 80°C durante cinco minutos bastan para impedir la actividad de las enzimas, como puede verse en "La carne", capítulo III, donde hablamos de los ablandadores. De aquí que se conserven mejor los alimentos cocinados que los crudos. Por ejemplo, si continúa la actividad enzimática se tiene un cambio de color en la clorofila o en los carotenos, o una modificación en el sabor de las grasas (rancidez) o un cambio en el valor nutritivo de las proteínas y vitaminas, o una modificación de la textura de los alimentos.
Además, el calentamiento es un método conveniente para destruir los microorganismos de los alimentos. De aquí que, con el mismo procedimiento, se logran dos objetivos: la preservación microbiológica y la estabilización enzimática de los alimentos.
Se dan casos de enzimas que, después del calentamiento, se regeneran. La inactivación térmica se debe a la pérdida de la estructura de los sitios activos como resultado de la desnaturalización, esto es, a que la llave pierde su forma. La regeneración se debería, entonces, a un proceso de reorganización de la molécula de proteína que conduce a la restauración de los sitios activos. La estabilidad de los alimentos frente a la acción enzimática depende de la temperatura, del pH, del estado físico de las enzimas (Si está adsorbida en partículas sólidas) y del tiempo de almacenamiento.
En los alimentos, igual que en todos los sistemas biológicos, el agua es uno de los componentes más importantes. Como disolvente, el agua sirve para poner en contacto las diferentes moléculas que interaccionan. Más aún, la reactividad de muchas sustancias depende del grado de disociación iónica y de la configuración molecular; es decir; del grado de hidratación. El agua misma es frecuentemente uno de los reactivos o de los productos de la reacción.
La influencia del agua en la velocidad de las reacciones enzimáticas de los alimentos se ha conocido empíricamente desde hace muchos años, de aquí que el secado, ahumado y salado de los alimentos sean formas antiguas de conservación de los mismos, véase capítulo I, "Algunas formas de conservar los alimentos".
El contenido de agua en los alimentos varía desde más de 90% en algunas hortalizas, como el tomate, hasta un bajo porcentaje en granos y alimentos deshidratados.
La influencia del agua en la reactividad de los alimentos depende del estado en que se hallan las moléculas de agua. En los alimentos el agua se halla fuertemente adsorbida en la superficie de las proteínas, carbohidratos, etc., en sus sitios polares, p.ej. los grupos -OH de los carbohidratos. El papel del agua en las reacciones enzimáticas es semejante al de un lubricante en la analogía llave-cerradura. En gran medida el papel del agua es el de disolvente, permitiendo la difusión del sustrato hacia la enzima.
La papaína es una enzima de origen vegetal que hidroliza al colágeno de la carne. En términos culinarios, "ablanda la carne". También una enzima de la piña (bromelaína, capítulo III) tiene tal propiedad, por lo que se emplea en la preparación de algunas carnes (tacos al pastor; jamón Virginia, alambres, etc.).
Las enzimas intervienen en una gran cantidad de procesos para la elaboración de alimentos y bebidas. La fermentación alcohólica, por ejemplo, es producida por levaduras, hongos microscópicos unicelulares que liberan unas sustancias, precisamente las enzimas, causantes de las fermentaciones.
En general las levaduras requieren materia orgánica para alimentarse y se desarrollan muy bien en líquidos azucarados, obteniendo de ellos la energía almacenada en los glúcidos.
A continuación veremos con algún detalle el papel de la levadura de pan (o de cerveza) en la elaboración de estos satisfactores de la humanidad.
La levadura de pan libera dos enzimas, una de las cuales, la "invertasa" o "sacarasa", convierte la sacarosa en glucosa:
La glucosa, a su vez, se convierte en etanol y bióxido de carbono por la acción de otra enzima: la "zimasa":
Esta fermentación alcohólica tiene diversas aplicaciones en el campo de la
alimentación. En unos casos se aprovecha el CO2
(para que esponje el pan) y en otros el etanol (cerveza, vino, etc.). En este
caso la reacción no requiere oxígeno, lo que químicos y biólogos llaman proceso
anaerobio.15 ![]()
Las bacterias útiles en la alimentación son las llamadas saprófitas,16 ![]() que
producen sustancias útiles para el medio en que viven o bien descomponen la
materia orgánica pasándola a material mineral.
que
producen sustancias útiles para el medio en que viven o bien descomponen la
materia orgánica pasándola a material mineral.
Las principales fermentaciones bacterianas son:
1) Fermentación acética:
Una implacable reacción de desastrosas consecuencias, como lo puede atestiguar cualquiera que haya sufrido los terribles efectos de la "cruda".
Esta fermentación requiere oxígeno y la producen bacterias del tipo acetobacter.
La fermentación acética es responsable de la fabricación del vinagre17 ![]() a partir del vino.
a partir del vino.
2) Fermentación láctica:
La produce el lactobacillus. Tiene lugar en la fabricación del yogur; kéfir, quesos con mohos, col fermentada, etcétera.
3) Fermentación butírica:
requiere oxígeno y es producida por el clostridium butiricum y el bacillus amylobacter. Es la fermentación que tiene lugar al enranciarse la mantequilla; también se emplea para la obtención de fécula de papa.
4) Fermentación pútrida: Consiste en la desintegración de las proteínas en
aminoácidos a partir de los restos vegetales o animales; en el proceso se liberan
gases como el amoníaco, bióxido de carbono, hidrógeno, metano y otros de olor
fétido como sulfuro de hidrógeno, nidol, escatol, etc. Se producen también las
"ptomaínas",18 ![]() sustancias
muy tóxicas.
sustancias
muy tóxicas.
Con la descomposición, los alimentos no sólo toman un mal aspecto, mal olor y mal sabor sino que pueden enfermar al que los ingiere.
Cocinar los alimentos es una forma de retrasar la descomposición y una forma de disimular el sabor, debido a ésa son las especias. No es raro que la pimienta, el chile, etc., se hayan comenzado a usar en regiones calurosas donde los alimentos se descomponen más facilmente, además de que son las regiones donde se producen.
Sin embargo no todas las descomposiciones son desagradables. Piénsese, por ejemplo, en el vino, la cerveza, el queso, el pan, el yogurt, etc. Por otro lado estos alimentos tienen una vida útil mayor que los alimentos de los que se obtienen, lo cual explica que hayan sido importantes vituallas de las primeras civilizaciones. Otras reacciones enzimáticas útiles son las que intervienen en el curtido de pieles.
Ya señalamos que la baja temperatura ayuda a conservar los productos vegetales, como las frutas; pero "nada con exceso, todo con medida", así que conviene mantenerlos a temperatura baja sin llegar a la congelación pues se puede perder la textura. En las frutas la oxidación de los hidratos de carbono es un proceso continuo que se acompaña de generación de calor y bióxido de carbono y, por consiguiente, se calientan durante el almacenamiento llevando a un círculo vicioso: cuanto más sube la temperatura más rápidamente actúan las enzimas y mayor es el calentamiento. Por eso conviene refrigerarlas.
Una de las clasificaciones más útiles en la química es la de ácidos19 ![]() y
bases (también llamadas "álcalis"20).
y
bases (también llamadas "álcalis"20). ![]() Como mencionaremos más adelante el color de muchos vegetales depende de la acidez
o basicidad de la solución, esto es, del pH; 21
Como mencionaremos más adelante el color de muchos vegetales depende de la acidez
o basicidad de la solución, esto es, del pH; 21
![]() y, en consecuencia, el aspecto de frutas, verduras y ensaladas tiene que ver
con los ácidos y las bases.
y, en consecuencia, el aspecto de frutas, verduras y ensaladas tiene que ver
con los ácidos y las bases.
En la antigua Roma era bien sabido que la fermentación de los jugos vegetales podía llegar más allá del vino produciendo vinagre. Químicamente esto implica la oxidación del alcohol transformándose en ácido acético. Aparte de su uso culinario, el vinagre era importante por ser el ácido más fuerte de la antigŁedad.
Si bien en el siglo IX eran pocos los ácidos conocidos (vinagre, jugos de frutas) ya se habían desarrollado los métodos y equipos de laboratorio necesarios para la producción de muchos más. Los alquimistas alejandrinos conocían los procesos de destilación pero es poco probable que tuvieran aparatos lo suficientemente avanzados como para conseguir componentes volátiles puros antes del siglo XlI. El descubrimiento de los ácidos minerales (es decir; derivados de materiales inorgánicos) comenzó en Europa en el siglo XIII. Probablemente el primero fue el ácido nítrico, obtenido mediante la destilación de salitre (nitrato de sodio y potasio) y vitriolo (sulfato de cobre) o alumbre (sulfato de aluminio y magnesio). Seguramente fue más difícil de descubrir el ácido sulfúrico, pues requiere mayores temperaturas y equipo más resistente a la corrosión. Y más difícil aún el ácido clorhídrico, pues los vapores no pueden condensarse sino que deben ser disueltos en agua.
Si bien la química comenzó su desarrollo con el curtido de pieles, la elaboración
de alimentos, etc., esto es, con el origen mismo del hombre, la elaboración
precisa de los conceptos químicos fundamentales comenzó en el siglo XVII.
Sólo entonces se definieron elementos, compuestos, ácidos, bases, sales, etc.
Robert Boyle (1627-1691) dio una descripción precisa de los ácidos al decir
que tales sustancias podían enrojecer al "tornasol".22 ![]() Existían,
además, otras formas de reconocer a los ácidos: su sabor peculiar; el ataque
a los metales y a la piedra caliza, el cambio de color de algunos vegetales.
(p. ej. líquenes);23
Existían,
además, otras formas de reconocer a los ácidos: su sabor peculiar; el ataque
a los metales y a la piedra caliza, el cambio de color de algunos vegetales.
(p. ej. líquenes);23 ![]() y,
aunque sea redundante, los ácidos se caracterizaban por su sabor ácido. Las
sustancias que cambiaban de color en medio ácido o básico se llamaron "indicadores",
uno de los más empleados fue el tornasol.
y,
aunque sea redundante, los ácidos se caracterizaban por su sabor ácido. Las
sustancias que cambiaban de color en medio ácido o básico se llamaron "indicadores",
uno de los más empleados fue el tornasol.
No es de sorprender que las primeras clasificaciones de las sustancias se hayan hecho empleando los recursos más disponibles por los investigadores: sus sentidos, esto es, la vista, el tacto, el gusto. Hoy día esto puede parecer poco preciso y subjetivo, sin embargo el entrenamiento logra mejorar notablemente tales sentidos. Por ejemplo, el olfato; la mayoría de la gente puede distinguir algunos cientos de olores pero un químico hábil logra identificar casi 3 000. En cuanto al color, el ojo humano llega a distinguir hasta 700 matices distintos de forma que, sin entrenamiento, pueden distinguirse unos 4 000 colores distintos.
Fue Robert Boyle, en 1661, quien buscó características más allá de lo inmediato: análisis a la flama, análisis de los rastros metálicos en la célebre "piedra de toque", análisis de manchas, de humos, de precipitados, acción de disolventes, peso específico, etc.; los álcalis los identificaba por su tacto aceitoso (luego veremos por qué tal carácter aceitoso) y su capacidad para neutralizar a los ácidos formando sustancias cristalinas de sabor salado. Los ácidos, en cambio, por la efervescencia que producían con los metales, y ambos, ácidos y bases, porque anulaban sus características al combinarse para dar lugar a una sustancia de gusto salado. Probablemente ya era común en ese tiempo quitar la acidez al vino pasado con cal: una reacción de neutralización.
Estas observaciones permitieron la clasificación de muchas sustancias en ácidos y bases lo cual llevó a relacionar una gran cantidad de observaciones experimentales. Así muchas sustancias pudieron catalogarse como ácidos (nítrico, sulfúrico, carbónico, etc.), como bases (sosa, potasa, cal, amoniaco, etc.) y como sales (sal de mesa, salitre, bórax, alúmina, etc.).
El primer intento de dar una explicación teórica del comportamiento de los
ácidos fue hecho por Antoine-Laurent Lavoisier a fines del siglo XVIII,
quien afirmaba que todos los ácidos contenían oxígeno.24 ![]() Sin
embargo el elemento clave para el comportamiento ácido no está en el oxígeno
sino en el hidrógeno, como propuso Humphry Davy en 1815. Con todo, no basta
que exista hidrógeno en una sustancia, se requiere que éste sea sustituible
por un metal (como sugirió Justus von Liebig en 1838). Esta definición de ácido
fue un poco más duradera que las anteriores, aproximadamente 50 años, pero no
dio ninguna explicación acerca del comportamiento de las bases, éstas simplemente
se definían como sustancias que neutralizaban a los ácidos.
Sin
embargo el elemento clave para el comportamiento ácido no está en el oxígeno
sino en el hidrógeno, como propuso Humphry Davy en 1815. Con todo, no basta
que exista hidrógeno en una sustancia, se requiere que éste sea sustituible
por un metal (como sugirió Justus von Liebig en 1838). Esta definición de ácido
fue un poco más duradera que las anteriores, aproximadamente 50 años, pero no
dio ninguna explicación acerca del comportamiento de las bases, éstas simplemente
se definían como sustancias que neutralizaban a los ácidos.
El tema adquirió una nueva perspectiva con los trabajos de Wilhelm Ostwald y Svante A. Arrhenius en la década de 1880. A grandes rasgos la teoría de Arrhenius propone que los ácidos son sustancias que en solución acuosa producen iones H+ y las bases, a su vez, producen iones (OH)- de forma que la neutralización de ácidos y bases se explica en términos de la reacción:
La teoría de Arrhenius tuvo una vigencia de 35 años pues no tardaron en presentarse inconsistencias. Por ejemplo, hay sustancias que producen el vire al color básico de indicadores pero no producen iones (OH)- sino (CH30)-; si el disolvente es metanol (CH3OH), o bien forman iones (NH2)- si el disolvente es amoniaco líquido (NH3). También la definición de "ácido" como sustancia que produce iones H+ tiene excepciones. La más importante es que en solución acuosa no existe el H+ como tal sino asociado, al menos, con una molécula de disolvente como (H30)+ en agua ((H904)+ según algunos), como (CH30H2)+ en metanol y como (NH4)+ en amoniaco líquido. Aún más, en disolventes como benceno o cloroformo, donde se dan las reacciones y propiedades típicas de ácidos y bases... ¡no se ha detectado la existencia de iones!
Otro escollo a la teoría de Arrhenius lo constituyen las sustancias que no
tienen (OH-) en su composición y se comportan como bases.
Tales son la mayoría de los alcaloides.25 ![]() Son
ejemplos de alcaloides: nicotina, efedrina, mezcalina, morfina, heroína, etc.
Cabe aclarar que algunos alcaloides (como la morfina) sí tienen grupos (OH)-.
Son
ejemplos de alcaloides: nicotina, efedrina, mezcalina, morfina, heroína, etc.
Cabe aclarar que algunos alcaloides (como la morfina) sí tienen grupos (OH)-.
Además, según la teoría de Arrhenius, un ácido produce iones H+ sólo si hay una base que los reciba. Por ejemplo, el ácido acético:
produce el ion H+ (asociado a H20 como H3O+) sólo si hay H20 que se comporte como una base:
Análogamente, una base sólo produce iones (OH)- si hay un ácido presente, así el ion bicarbonato (HC03)- producido por la disolución de una sal (por ejemplo: bicarbonato de sodio) recibe un H+ del agua (que en este caso se comporta como ácido):
Hoy día existen otras teorías (como la de Lewis) con mayor poder explicativo, sin embargo están fuera de los objetivos de este parágrafo. Y volviendo al tema, resumiremos con lo siguiente: la definición de ácido y de base depende del disolvente involucrado y, por ser el más común el agua, suelen emplearse los conceptos de ácido y base con ese referente. Esto significa que un pH menor de 7 indica acidez, uno mayor de 7, alcalinidad y un pH = 7 corresponde a neutralidad.
Pero... veamos cómo podemos reconocer ácidos y bases en el laboratorio cotidiano llamado cocina.
A decir verdad hay una gran abundancia de sustancias, además de las ya mencionadas (extracto de violetas, tornasol, etc.), que pueden emplearse como indicadores. Por ejemplo el repollo morado, por su contenido de antocianinas (véase "El color en los alimentos", capítulo III), puede usarse como indicador ácido-base.
Para obtener el pigmento se necesita dejar el repollo rallado en una taza con agua y agitarlo ocasionalmente. Cuando el agua tome un fuerte color rojo se vierte con cuidado de forma que se elimine lo más posible los sólidos.
Se puede averiguar el color del indicador para el ácido con jugo de limón,
y el color para el medio básico con bicarbonato de sodio (mal llamado por muchas
amas de casa carbonato).26 ![]()
Examine, por ejemplo, las siguientes sustancias:
1) Agua resultante del cocimiento de vegetales, chícharos, frijoles, cebollas, espárragos, etcétera.
2) Líquidos que acompañan a los vegetales y frutas enlatadas.
4) Refrescos gaseosos, Coca-Cola, Tehuacán, etcétera.
Figura II. 7. Moléculas de clorofila.
9) Leche a punto de "cortarse".
Como mencionamos, las bases se caracterizaban por ser aceitosas al tacto y poder cambiar a azul el color del liquen llamado "tornasol"; también se caracterizaban por su sabor "amargo".
Boyle encontró que muchas sustancias orgánicas cambiaban de color con ácidos y bases. El alcatraz y el jazmín, por ejemplo, se ponen amarillos con vapores ácidos. Las rosas cambian a púrpura con el amoniaco y, en general, los vegetales verdes cambian a color pardo en medio ácido.
Por lo anterior la sabiduría de las abuelas elaboró una receta consistente
en poner un poco de bicarbonato o tequesquite27 ![]() en
el agua empleada para cocer los vegetales y mantener su color verde. Con el
cocimiento se libera el ácido contenido en las células del vegetal y cambia
el color de la clorofila. Pero al haber bicarbonato el ácido producido se neutraliza
y se conserva el color de los vegetales.
en
el agua empleada para cocer los vegetales y mantener su color verde. Con el
cocimiento se libera el ácido contenido en las células del vegetal y cambia
el color de la clorofila. Pero al haber bicarbonato el ácido producido se neutraliza
y se conserva el color de los vegetales.
La molécula de clorofila tiene un átomo de magnesio, figura II.7, el cual es eliminado por los ácidos destruyendo la estructura de la clorofila y dando lugar a nuevas moléculas; si el vegetal contiene carotenos (casi inertes al calor y a los ácidos) se revela un color pardo que disminuye el atractivo de las legumbres. Esto explica por qué el aderezo de ensaladas (el cual contiene vinagre) se ponga justo cuando está por servirse, de esta suerte se retrasa el "marchitado" de los vegetales verdes.
Volviendo a la receta de las abuelas, al poner exceso de bicarbonato en el
agua de cocido de vegetales se tiene el riesgo de ablandar la textura de éstos
y hacerlos poco apetitosos pues, como ya señalamos, las sustancias con características
básicas reblandecen o disuelven los tejidos orgánicos. Esta propiedad explica
que se usen cenizas o cal para hacer el nixtamal.28 ![]() Hay
otras ventajas en el empleo de álcalis para el nixtamal. Las proteínas del maíz
son de bajo valor nutritivo pero mejoran su calidad con la nixtamalización pues
se libera la niacina29
Hay
otras ventajas en el empleo de álcalis para el nixtamal. Las proteínas del maíz
son de bajo valor nutritivo pero mejoran su calidad con la nixtamalización pues
se libera la niacina29 ![]() al
hidrolizarse los enlaces que la mantienen unida a otros constituyentes.
al
hidrolizarse los enlaces que la mantienen unida a otros constituyentes.
Otra forma de mantener el color verde brillante de los vegetales es cocerlos en olla de cobre o de aluminio, se evita así que se pongan cafés debido a la formación de Cu(OH)2 (o Al(OH)3) que neutraliza al ácido responsable de la pérdida del Mg de la clorofila.
Otra forma de conservar el verde de las verduras es cocerlas rápidamente. Basta hervir una gran cantidad de agua y vaciar en ella las legumbres. Con esto disminuye el tiempo de cocimiento y la cantidad de ácido liberado. Otra aplicación culinaria de los ácidos es la disminución del olor a pescado o pollo. Lo tratamos en el capítulo siguiente.
Los conceptos de acidez y basicidad surgieron de nociones y experiencias cotidianas, así como la mayoría de los conceptos de la ciencia surgieron de las prácticas de artesanos y artistas.
Sin embargo, hoy día difícilmente podemos afirmar que el concepto científico de ácido o base forma parte de la experiencia común. Esto parece ser muy "común" en la química moderna: el "sentido común" lo es solamente en el sentido de que debe ser "común" para el que tiene una preparación especial y está consagrado a un campo específico. Sólo él puede mirar sus problemas y las soluciones como algo "común". Tan "común" como puede ser a un(a) cocinero(a) su tarea.
Ahora bien, durante mucho tiempo se consideró que la "acidez" o "basicidad" de una sustancia era una característica intrínseca (como podría serlo su masa molecular o su estructura molecular). En la actualidad es más aceptado pensar en la "acidez" o "basicidad" como una forma de comportarse de las sustancias en determinadas situaciones. El ejemplo más notable es el H2O. Tiene las características de un ácido y de una base.
Según la teoría de Arrhenius un ácido se caracteriza por producir iones H+; esto es, desde luego, simplificado pero permite explicar muchos fenómenos. Pocos científicos sostienen que realmente hay iones H+ involucrados, proponen, más bien, la intervención de iones complejos del tipo (H9O4)+.
Al encontrarse sustancias como el cloruro de aluminio, el trióxido de azufre y el trifluoruro de boro que, sin producir H+ en solución, reaccionan con bases y producen sales (y muchas otras características de los ácidos) fue necesario revisar el concepto de Arrhenius para los ácidos.
Desde luego, esto ha tenido su precio: la ciencia se ha alejado de las representaciones sensibles que fácilmente nos permiten "imaginar" a un "protón" cambiando de "amante". Ante tal situación recordemos que la validez de los conceptos científicos no está ni en su evidencia ni en la posibilidad de representarlos con analogías sino en la posibilidad de definir los conceptos sin ambigŁedad ni contradicción a partir de efectos mensurables permitiendo explicar fenómenos. Como ha dicho Einstein, el científico se presenta ante los filósofos como un tipo oportunista y sin escrúpulos:
...un científico parece realista en cuanto
busca describir el mundo independientemente de su acto de percepción;
idealista, en cuanto considera los conceptos y teorías como libres
invenciones del espíritu humano (y que no se derivan lógicamente de
los datos empíricos); positivista, en cuanto considera sus conceptos
y teorías justificados solamente porque proporcionan una representación
lógica de las relaciones entre las experiencias sensibles. Incluso puede
parecer platónico o pitagórico porque considera la simplicidad
lógica como el instrumento indispensable y efectivo de su investigación. |
La importancia de ácidos y bases no es teórica exclusivamente. Ambos desempeñan un importante papel en la cocina y en la industria química, sea como reactantes o como catalizadores. Casi no hay proceso biológico, en la célula o en el organismo como un todo, que sea indiferente a la acidez o alcalinidad del medio. La sangre, por ejemplo, es ligeramente alcalina y sólo en un pequeño intervalo de pH (7.35 £ pH ³ 7.45) se mantiene la óptima regulación de las reacciones químicas del organismo. Se pueden citar muchos otros ejemplos: la acidez o alcalinidad de un terreno influye en los cultivos, la lluvia ácida en el deterioro de monumentos, lagos y bosques, etc. etc. Y en los alimentos, tema que nos ocupa y preocupa, el pH interviene en la conservación de los alimentos y su sabor. Véase el capítulo III donde hablamos de la sazón.
COCER, HORNEAR, FREÕR, ROSTIZAR, ETC.
Son muy diversas las razones por las que se cocinan los alimentos. Entre ellas podemos enumerar:
1) Se prolonga la vida del alimento pues se interrumpen reacciones enzimáticas y microbianas.
2) Se mejora el sabor de los alimentos.
3) Se mejora la textura, así como el color y el olor.
4) Se disfruta en la comida de unos lazos culturales más fuertes que
el mismo idioma.30 ![]()
Los procedimientos para lograr el cocimiento de los alimentos son muy variados;
aunque básicamente son: freír; cocer en agua, cocer al vapor y hornear; son
tantas y tan ricas las variantes de cada uno de ellos que no se puede hacer
una descripción completa. Por otro lado, muchos platillos implican más de un
procedimiento; para la "lasagna",31 ![]() por
ejemplo, primero se cuece la pasta en agua y luego se hornea.32
por
ejemplo, primero se cuece la pasta en agua y luego se hornea.32 ![]()
Rostizar, dorar, tostar, freír, sofreír, saltear, capear, acitronar, guisar, escalfar, rebozar; mechar, adobar, manir, trinchar, aderezar, gratinar, hervir; etc., etc., etc., son apenas unas muestras de la fertilidad de la imaginación cuando se trata del placer cotidiano de la comida. Remitimos al lector (o simpática lectora) a las recetas de su respetabilísima abuela quien, sin duda, puede abundar en el tema.
Por nuestra parte sólo podemos indicar algunas características fisicoquímicas de los procedimientos de cocinado más comunes: cocer al vapor; cocer con agua, hornear y freír.
En 1770, José Antonio Alzate, astrónomo, físico, historiador; geógrafo, arqueólogo
y naturalista mexicano, presentó ante la Academia de Ciencias de París una memoria
donde explicó la forma en que los indios mexicanos preparan... los tamales.
A tal fin colocaban en el fondo de una olla de barro un poco de agua y encima
de ella el tapextle33 ![]() de
tejamanil34
de
tejamanil34 ![]() y
sobre ese emparrillado colocaban los alimentos: tamales,35
y
sobre ese emparrillado colocaban los alimentos: tamales,35 ![]() chayotes,36
chayotes,36
![]() elotes,37
elotes,37
![]() etcétera.
etcétera.
Los tamales son un ejemplo de cocimiento al vapor rodeado de consejas y consejos. Uno de los de la abuela es no hacer tamales cuando la mujer está "esperando", pues los tamales se ponen prietos. Otro es poner unas monedas en el recipiente con agua. Ciertamente, este último sí tiene fundamento: el sonido de las monedas, resultado de las corrientes convectivas del agua hirviente indica la existencia de líquido en el recipiente y, en consecuencia, una temperatura constante (la del vapor) en los tamales; en terminándose el agua, dejan de sonar las monedas y no tardan en quemarse los tamales. En el cocimiento al vapor se tiene una temperatura constante, como puede entenderse con el diagrama de fases del agua, véase "La olla de presión", capítulo II; aunque no es un método muy rápido, tiene la ventaja de que es casi imposible sobrecocer los alimentos.
Aunque ya no se acostumbran las tortillas del comal, los que tengan buena memoria recordarán que se forma una película delgada en la cara superior de la tortilla, antes de voltearla. Esta capa resulta de cocerla al vapor primero y, después, de ponerla sobre el comal para que se ase.
El cocimiento con agua es uno de los procedimientos más empleados en la cocina. Casi todas las sopas, consomés, caldos, etc. se preparan con los mismos fundamentos fisicoquímicos: la alta conductividad térmica del agua, las corrientes de convección, la constancia de la temperatura de ebullición.
Ya señalamos en otra parte de este capítulo la importancia de la temperatura para la destrucción de microorganismos e iniciar el rompimiento de las moléculas que atacarán las enzimas durante la digestión. El cocimiento con agua es común en la cocina por varias razones: rapidez, economía, facilidad y sazón. En efecto, la velocidad se debe a la producción de corrientes de convección en el agua que, agitando continuamente los alimentos, aseguran uniformidad de cocinado. El costo del agua respecto al aceite, el tiempo empleado, la versatilidad del cocimiento con agua para preparar diferentes tipos de alimentos lo hace, con mucho, el método más económico. Además, la alta (y constante) temperatura de ebullición del agua hace que el tiempo no sea una variable crítica en el cocinado (hay mayor flexibilidad en el tiempo de cocido que en el de asado). Véase, en este mismo capítulo: "Olla de vapor". El agua es un disolvente eficaz de la mayoría de las especias y sales para sazonar; lo que explica en términos gastronómicos que el cocimiento con agua sea un método muy empleado.
A continuación mencionaremos algunos fenómenos asociados con la preparación de los huevos cocidos.
Es común, que al cocer huevos se rompa el cascarón debido a la dilatación del gas contenido en la cámara de aire. Una manera de evitar que se agriete el cascarón es hacer un pequeño orificio en la parte ancha, esto facilita la salida del gas y, por otro lado, hace que el huevo cocido sea perfectamente curvo sin esa parte plana típica, figura II. 8.
Desde hace tiempo nuestras abuelas saben que para cocer huevos conviene poner un poco de sal en el agua. Si bien ese poco de sal aumenta la temperatura de ebullición del agua (véase el capítulo III) la principal razón de la sal es que funciona como catalizador para coagular la albúmina que sale del cascarón, figura II.9. Con ello se evita que se formen las poco apetitosas tiras de clara coagulada en donde se cuecen los blanquillos.
Figura II. 8. ¿Cuál fue cocido después de perforar el cascarón?
Figura II. 9. Acción de sal en la albúmina.
La clara de huevo está constituida de aproximadamente 88% agua y 11% proteína. La molécula de proteína semeja una bola de estambre enrollado y se mantiene así por unos enlaces muy débiles. Cuando aumenta la temperatura los enlaces ya no pueden mantener la forma de la bola y la molécula se desenrolla dejando expuestos los puntos de enlace; al encontrar otras moléculas en las mismas condiciones se forma una red tridimensional. Como los enlaces químicos tienen base eléctrica, al poner sal (sólido iónico) en agua se producen partículas eléctricas que sirven para unir las moléculas en sus puntos de enlace. Así, si el cascarón del huevo se rompe al hervirlo, la sal sirve para coagular la albúmina en la fisura misma taponando la grieta.
Por otro lado es interesante anotar la capacidad de la clara de huevo para formar un estuco muy resistente cuando se combina con yeso. En efecto, durante la época colonial se preparaba un estucado con los materiales citados para hacer el decorado barroco de las iglesias. Como es sabido, el barroco se caracteriza por sus volutas, hornacinas, imágenes, etc. Entre tantas madres de ese tiempo no faltó alguna religiosa que aprovechara las yemas de los huevos en... repostería; lo cual explica que Puebla, Morelia, etc., famosas por su arte religioso colonial, también lo sean por su rompope, yemitas y borrachitos, hechos, naturalmente, con yema de huevo.
El horneado es parecido al cocimiento al vapor en cuanto que emplea gases a
alta temperatura para transferir el calor. Y la diferencia entre el horneado
y el rostizado38 ![]() radica en que éste emplea sólo el aire caliente y el calor que se refleja en
las superficies del rostizador. Los pollos así preparados se colocan fuera de
la trayectoria de los gases de combustión; en el horneado los gases de combustión
influyen en el sazón de los alimentos más que en el rostizado.
radica en que éste emplea sólo el aire caliente y el calor que se refleja en
las superficies del rostizador. Los pollos así preparados se colocan fuera de
la trayectoria de los gases de combustión; en el horneado los gases de combustión
influyen en el sazón de los alimentos más que en el rostizado.
Curiosamente, aunque la temperatura del horno sea de casi 400°C, 300 grados más que la de ebullición del agua, el tiempo de horneado es mayor que el de cocido. La razón es que la conductividad térmica del aire es mucho menor que la del agua, para el aire es 31.8 cal/(hora m grado) y para el agua es 540 ca1/(hora m grado) a 300°C.
Por otro lado, las corrientes de convección del agua durante el cocimiento son mayores que en el horneado, pues el horno se mantiene cerrado (en la olla de frijoles siempre hay una zona expuesta a la temperatura ambiente, lo que propicia la convección). Lo anterior también explica que hornear sea más lento que cocer.
Ya mencionamos en el capítulo II un hecho curioso: al encender el horno ¡se humedece el vidrio de su puerta!
Por otro lado, la fabricación de barbacoa en hoyos es una combinación de horneado, rostizado y ahumado. Con ello se obtiene un producto totalmente sazonado y tierno.
La temperatura de ebullición del aceite casero es, aproximadamente, 280°C
razón por la que freír39 ![]() permite preparar los alimentos más rápidamente que cocer con agua o vapor. La
alta temperatura del aceite produce reacciones de caramelización y de Maillard
en las proteínas (véase en capítulo III, "La carne") que hacen muy apetitosos
los alimentos fritos; además el aceite remanente los lubrica facilitando la
deglución.
permite preparar los alimentos más rápidamente que cocer con agua o vapor. La
alta temperatura del aceite produce reacciones de caramelización y de Maillard
en las proteínas (véase en capítulo III, "La carne") que hacen muy apetitosos
los alimentos fritos; además el aceite remanente los lubrica facilitando la
deglución.
Sin embargo hay bemoles en el concierto de las frituras. La inmiscibilidad del agua y el aceite hace que éste brinque (casi todos los alimentos tienen agua). Si el aceite está muy caliente, el agua de los alimentos se evapora rápidamente produciendo salpicaduras. Las freidoras eléctricas tienen un calentamiento más uniforme y una superficie expuesta mucho menor que las sartenes por lo que son más seguras en cuanto a las salpicaduras.
Una forma de disminuir las salpicaduras de aceite cuando se trata de pescados, berenjenas, etc. (alimentos con gran porcentaje de agua), es empanizarlos o enharinarlos. El agua de la superficie de los alimentos queda incorporada a los radicales OH de los polisacáridos; de esta manera se evita su rápida evaporación y, por consiguiente, las salpicaduras. El enharinado tiene una ventaja extra: disminuye el tiempo de freído; puesto que el agua requiere de una gran cantidad de calor para evaporarse, al estar enlazada a los polisacáridos ya no se evapora y no se desperdicia el calor del aceite.
También en la preparación de chicharrones hay riesgo de salpicaduras; para
evitarlas la tradición pide emplear cazuelas de cobre (la alta conductividad
térmica del cobre asegura un calentamiento uniforme).