III. EN LA MESA
LA GRAN variedad de gustos y preferencias por determinados alimentos
puede analizarse en términos de cuatro características básicas que hacen apetecible
la manducatoria: textura, color; olor; sabor.
En este capítulo trataremos desde el punto de vista fisicoquímico lo que cotidianamente se trata desde el punto de vista gastronómico.
Por ejemplo, la textura de los alimentos (cremoso, batido, tostado, dorado, esponjoso, etc.) se reduce en términos fisicoquímicos a... dispersiones, De éstas trataremos a continuación. Y del color; olor y sabor.
Soluciones, suspensiones, emulsiones, coloides, etc.
Las soluciones, las suspensiones, las emulsiones y los coloides son mezclas
con dos fases, esto es, pueden estar constituidas por dos de los tres más abundantes
estados de la materia: líquido, sólido, gaseoso. La principal diferencia en
estas mezclas es el tamaño de las partículas de la fase dispersa, conocida como
soluto.1 ![]()
En una solución las partículas son aproximadamente del tamaño de las moléculas del soluto, es decir de 0.1 a 1 x 10-7 cm, casi diez veces el tamaño de un átomo de hidrógeno.
En una suspensión las partículas son suficientemente grandes como para ser retenidas en un filtro, .6 a 2 x 10-4 cm.
En una emulsión las partículas se mantienen dispersas por la presencia de una tercera sustancia llamada emulsificante. El tamaño de las partículas de una emulsión es semejante al de un coloide aunque en ocasiones es mayor. En estos casos las partículas tienen un diámetro de 10-7 a 10-4 cm. De estas últimas dispersiones hablaremos al final de este apartado. El sutil lector (o lectora) habrá notado con razón que no hay una frontera precisa entre solución, suspensión y coloide.
En la última clase de mezclas de dos fases: los coloides,2 ![]() las
partículas son mayores que las moléculas pero menores que las de una suspensión,
de manera que se tiene una mezcla homogénea. A simple vista no se puede distinguir
las soluciones de los coloides.3
las
partículas son mayores que las moléculas pero menores que las de una suspensión,
de manera que se tiene una mezcla homogénea. A simple vista no se puede distinguir
las soluciones de los coloides.3 ![]() Sin
embargo, las partículas en un coloide son suficientemente grandes como para
dispersar la luz de la misma forma en que se dispersa en un cuarto con polvo
en suspensión. Si se hace pasar el haz de luz de una lámpara de mano a través
de una cerveza, figura III.1, puede notarse la dispersión de luz que produce
un coloide. Haga la misma prueba con: jugo de naranja, café, consomé, vinagre,
clara de huevo, sidra, miel, agua con sal, agua con azúcar; etcétera.
Sin
embargo, las partículas en un coloide son suficientemente grandes como para
dispersar la luz de la misma forma en que se dispersa en un cuarto con polvo
en suspensión. Si se hace pasar el haz de luz de una lámpara de mano a través
de una cerveza, figura III.1, puede notarse la dispersión de luz que produce
un coloide. Haga la misma prueba con: jugo de naranja, café, consomé, vinagre,
clara de huevo, sidra, miel, agua con sal, agua con azúcar; etcétera.
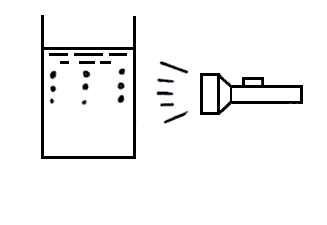
Figura III. 1. Un refresco de cola, ¿es coloide?
Cuando la luz viaja a través de un medio en el que hay partículas, parte de
su energía se dispersa en todas direcciones (efecto Tyndall).4 ![]() Este
fenómeno también se da en las plumas de ciertas aves, sus colores iridiscentes
se deben a burbujas de aire de tamaño coloidal suspendidas en el medio transparente
sólido. Tales burbujas dispersan la luz azul pero dejan pasar la luz roja la
cual llega al cuerpo del ave y como resultado las plumas se ven azules. Muchos
de los colores que vemos son resultado de la dispersión de la luz por partículas
coloidales, colores que dependen del tamaño de las partículas, de su orientación
y de su textura.
Este
fenómeno también se da en las plumas de ciertas aves, sus colores iridiscentes
se deben a burbujas de aire de tamaño coloidal suspendidas en el medio transparente
sólido. Tales burbujas dispersan la luz azul pero dejan pasar la luz roja la
cual llega al cuerpo del ave y como resultado las plumas se ven azules. Muchos
de los colores que vemos son resultado de la dispersión de la luz por partículas
coloidales, colores que dependen del tamaño de las partículas, de su orientación
y de su textura.
Volviendo a las dispersiones, las de partículas mayores a 2 x 10-4 cm se consideran simplemente mezclas.
Según el medio dispersor y el tipo de coloide disperso se tienen nueve tipos de dispersiones, tabla III. 1.
|
|
|||
|
Fase dispersa
|
Medio dispersor
|
Nombre
|
Ejemplos
|
|
|
|||
| Sólido | Gas | Aerosol | Humos |
| Sólido | Líquido | Sol o suspensoide | Atole, puré, cerveza, etc. |
| Sólido | Sólido | --- | Vidrios coloreados |
| Líquido | Gas | Aerosol | Nieblas, nubes |
| Líquido | Líquido | Emulsión | Aderezos, mayonesa, mantequilla |
| Líquido | Sólido | Gel | Gelatinas, ópalos |
| Gas | Gas | --- | Olores |
| Gas | Líquido | Espuma | Crema batida, merengue |
| Gas | Sólido | --- | Pan, helados, piedra pómez |
|
|
|||
Uno de los coloides más representativo que se encuentra en la cocina es la
gelatina,5 ![]() una
proteína con muchos grupos polares, tales como -C = O (carbonilo) y =
N - H (imino), dispuestos a formar enlaces de hidrógeno con el agua que,
como es sabido, está formada por moléculas muy polares. Cuando la gelatina está
dispersa en agua caliente forma lo que se llama sol. Al enfriarse forma
un gel, un líquido disperso en un sólido, en este caso las partículas
coloidales de gelatina están en contacto entre sí formando una red tridimensional,
la cual engloba al líquido, como en albercas microscópicas.
una
proteína con muchos grupos polares, tales como -C = O (carbonilo) y =
N - H (imino), dispuestos a formar enlaces de hidrógeno con el agua que,
como es sabido, está formada por moléculas muy polares. Cuando la gelatina está
dispersa en agua caliente forma lo que se llama sol. Al enfriarse forma
un gel, un líquido disperso en un sólido, en este caso las partículas
coloidales de gelatina están en contacto entre sí formando una red tridimensional,
la cual engloba al líquido, como en albercas microscópicas.
La gelatina, como buen coloide que es, se precipita fácilmente cuando se le añade un líquido que disuelve al medio dispersor. Así, al añadir alcohol a una gelatina que no ha cuajado se provoca la coagulación (resultado de eliminar el agua a las partículas coloidales), figura III. 2.
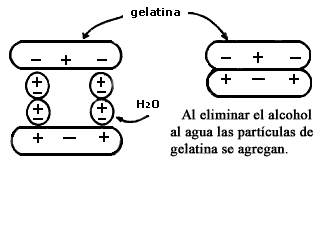
Figura III. 2. Cuajado de gelatina con alcohol
Hay un fenómeno común en los geles, denominado sinéresis,6 ![]() consiste
en la formación de un líquido constituido por las mismas moléculas coloidales
muy diluidas. Este fenómeno se presenta cuando se enfrían gelatinas y postres
semejantes: el gel se contrae y expulsa agua. La contracción se debe a un rearreglo
de las moléculas del coloide que adquiere una estructura más estable.
consiste
en la formación de un líquido constituido por las mismas moléculas coloidales
muy diluidas. Este fenómeno se presenta cuando se enfrían gelatinas y postres
semejantes: el gel se contrae y expulsa agua. La contracción se debe a un rearreglo
de las moléculas del coloide que adquiere una estructura más estable.
Otro coloide cotidiano es la leche. Si ésta se diluye más de lo que el fabricante
ya ha hecho puede notarse la dispersión de luz característica de los coloides.
Las moléculas de caseína,7 ![]() una
proteína de la leche, se mantienen dispersas por tener carga negativa. Obviamente
la leche se "corta" cuando se aglomeran las partículas de caseína. Esto ocurre
por la producción de ácido láctico debida a la fermentación de los azúcares
de la leche. El ácido (que tiene carga positiva) se une a las moléculas de caseína
neutralizándolas, al no repelerse en éstas se forman los grumos característicos
de la leche cortada. Éste es un fenómeno semejante al coagulado de la
gelatina por alcohol mencionado en el párrafo anterior; pero con un origen diferente.
En el primer caso se elimina al medio dispersor; en el segundo se anula la repulsión
entre partículas.
una
proteína de la leche, se mantienen dispersas por tener carga negativa. Obviamente
la leche se "corta" cuando se aglomeran las partículas de caseína. Esto ocurre
por la producción de ácido láctico debida a la fermentación de los azúcares
de la leche. El ácido (que tiene carga positiva) se une a las moléculas de caseína
neutralizándolas, al no repelerse en éstas se forman los grumos característicos
de la leche cortada. Éste es un fenómeno semejante al coagulado de la
gelatina por alcohol mencionado en el párrafo anterior; pero con un origen diferente.
En el primer caso se elimina al medio dispersor; en el segundo se anula la repulsión
entre partículas.
Ya hemos dicho que hay muchas clases de sustancias que no se disuelven en agua y, dependiendo del tamaño de las partículas mezcladas en el líquido, dan lugar a suspensiones o coloides; en particular; si la mezcla de una sustancia en un líquido se separa cuando se deja reposar se llama suspensión.
Suspensiones muy comunes en la cocina son: puré, cremas de espárragos, alcachofa, betabel, etc. Y en el botiquín la suspensión infaltable es la leche de magnesia (hidróxido de magnesio).
Casi todos los aderezos8 ![]() para
ensaladas están constituidos por dos líquidos inmiscibles: vinagre y aceite.
Desde luego llevan especias, ajo, sal, etc. El punto es que hay que agitar el
aderezo para usarlo. Y mientras mayor el tiempo de agitación, mayor el tiempo
que tardan en separarse los dos líquidos, pues con la agitación violenta se
producen partículas muy pequeñas. Este procedimiento se emplea para fabricar
la leche homogeneizada: se hace pasar el lácteo por una fina malla que rompe
las pequeñas partículas de grasa a fin de lograr una mayor estabilidad en la
dispersión... que se pierde con la congelación, véase en el capítulo II, "El
refrigerador".
para
ensaladas están constituidos por dos líquidos inmiscibles: vinagre y aceite.
Desde luego llevan especias, ajo, sal, etc. El punto es que hay que agitar el
aderezo para usarlo. Y mientras mayor el tiempo de agitación, mayor el tiempo
que tardan en separarse los dos líquidos, pues con la agitación violenta se
producen partículas muy pequeñas. Este procedimiento se emplea para fabricar
la leche homogeneizada: se hace pasar el lácteo por una fina malla que rompe
las pequeñas partículas de grasa a fin de lograr una mayor estabilidad en la
dispersión... que se pierde con la congelación, véase en el capítulo II, "El
refrigerador".
Ahora bien, cuando el aderezo para ensalada se deja de agitar, las gotitas
de aceite comienzan a crecer hasta que forman una capa separada. La adición
de una tercera sustancia impide, en ocasiones, que las gotitas de aceite se
separen. El resultado es una mezcla estable llamada emulsión y la tercera
sustancia es, obvio, el agente emulsificante, emulsivo o, simplemente,
emulsificante.9 ![]() Unos
ejemplos de emulsificantes son el jabón, el detergente y la mayonesa.
Unos
ejemplos de emulsificantes son el jabón, el detergente y la mayonesa.
La mayonesa o salsa mahonesa10 ![]() (hecha
con yema de huevo, aceite, sal y jugo de limón) es una suspensión estabilizada
por la lecitina contenida en la yema de huevo. La clave para hacer la mayonesa
es verter las gotas de aceite muy lentamente sobre el vinagre, la yema y la
mostaza (bien batidos) de forma que la yema de huevo pueda cubrir las gotas
de aceite que se están añadiendo impidiendo que se junten. En la mayonesa casera
debe cuidarse la velocidad de añadido del aceite a la mezcla vinagre—yema
de huevo. La velocidad de adición debe ser menor a la capacidad de dispersión
del aceite en la emulsión.
(hecha
con yema de huevo, aceite, sal y jugo de limón) es una suspensión estabilizada
por la lecitina contenida en la yema de huevo. La clave para hacer la mayonesa
es verter las gotas de aceite muy lentamente sobre el vinagre, la yema y la
mostaza (bien batidos) de forma que la yema de huevo pueda cubrir las gotas
de aceite que se están añadiendo impidiendo que se junten. En la mayonesa casera
debe cuidarse la velocidad de añadido del aceite a la mezcla vinagre—yema
de huevo. La velocidad de adición debe ser menor a la capacidad de dispersión
del aceite en la emulsión.
Como indicamos, la mayonesa se mantiene estable por la yema de huevo cuyo ingrediente
activo es la lecitina. Hay muchas lecitinas11 ![]() estructuralmente iguales a las grasas pero con un extremo polar, esto es, cargado
eléctricamente, figura III. 3; el otro extremo no tiene carga eléctrica (es
no polar).
estructuralmente iguales a las grasas pero con un extremo polar, esto es, cargado
eléctricamente, figura III. 3; el otro extremo no tiene carga eléctrica (es
no polar).
El extremo polar es atraído por el agua (es hidrofílico) y el extremo no polar es atraído por la grasa (hidrofóbico), figura III.4. El resultado es que el emulsificante disuelve la mitad de sí mismo en el agua y la otra mitad en el aceite. Los extremos no polares de las moléculas de lecitina se orientan dentro de las gotitas de grasa y los extremos polares entran a la fase acuosa. Estas gotitas se repelen y mantienen estabilizada la emulsión. En la mayonesa se tiene una emulsión de aceite en un medio acuoso. La mantequilla es, por el contrario, emulsión de agua en un medio aceitoso.
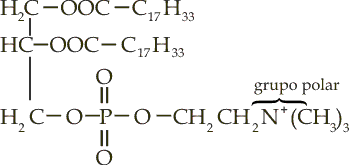
Figura III. 3. Leticina típica.
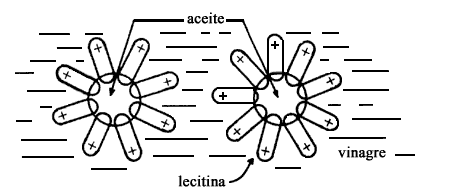
Figura III. 4. La mayonesa es una emulsión. La lecitina, el emulsificante.
En el capítulo V se trata de otros emulsificantes: los jabones y los detergentes.
DONDE SE TRATA ACERCA DE LOS OLORES EN ALGUNOS ALIMENTOS,
DE SU ORIGEN Y DE DIVERSASE INGENIOSAS FORMAS PARA REDUCIRLOS
Ajos, cebollas, brócolis, coliflor, col etc., no sólo se caracterizan por ser
muy olorosos sino también porque tienen el mismo mecanismo de producción de
olores. Se trata, en general, de dos sustancias separadas por la membrana celular,
la cual al romperse (sea por corte, macerado, cocimiento, etc.) permite que
reaccionen produciendo las sustancias odoríferas. En la coliflor; por ejemplo,
la sinigrina12 ![]() y
la mirosinasa,13
y
la mirosinasa,13 ![]() se
encuentran separadas, pero al juntarlas la mirosinasa descompone a la sinigrina
en aceite de mostaza,14
se
encuentran separadas, pero al juntarlas la mirosinasa descompone a la sinigrina
en aceite de mostaza,14 ![]() que
a su vez da lugar a ácido sulfhídrico (el mismo de los huevos cocidos o peor;
podridos).
que
a su vez da lugar a ácido sulfhídrico (el mismo de los huevos cocidos o peor;
podridos).
La mejor manera de limitar los olores de brócolis, coliflor; etc., es cocinar con una gran cantidad de agua para reducir el tiempo de cocción y, obvio, emplear tapadera. Aunque, paradójicamente, puede tenerse menor olor a col en la cocina si no se pone la tapadera; los ácidos volátiles, responsables de la producción del ácido sulfhídrico, se eliminan rápidamente del agua cuando no se pone la tapadera.
El ajo, como mencionamos anteriormente, posee dos compuestos: la aliina15 ![]() y
la alinasa.16
y
la alinasa.16 ![]() La
reacción, como mencionamos, está impedida por la membrana celular que separa
ambos compuestos. Sólo cuando rompemos la membrana, al cortarlo, triturarlo,
macerarlo, etc., se produce el característico olor a ajo debido a la nueva sustancia,
llamada alicina,17
La
reacción, como mencionamos, está impedida por la membrana celular que separa
ambos compuestos. Sólo cuando rompemos la membrana, al cortarlo, triturarlo,
macerarlo, etc., se produce el característico olor a ajo debido a la nueva sustancia,
llamada alicina,17 ![]() un
tiol o mercaptano, véase nota 17 del capítulo I. Entre paréntesis, el azufre
también se encuentra en las cebollas, los huevos, los puerros y el gas de cocina.
En general los tioles son compuestos muy olorosos, un olfato sin entrenamiento
especial puede captar a una sola de estas partículas en 3 millones de partículas
de aire.
un
tiol o mercaptano, véase nota 17 del capítulo I. Entre paréntesis, el azufre
también se encuentra en las cebollas, los huevos, los puerros y el gas de cocina.
En general los tioles son compuestos muy olorosos, un olfato sin entrenamiento
especial puede captar a una sola de estas partículas en 3 millones de partículas
de aire.
La aliina está presente en el ajo en muy baja concentración, sólo 0.24% y es una molécula inodora; sólo cuando se pone en contacto con la enzima alinasa se produce la alicina. Esta sustancia es la que más contribuye al olor característico del ajo, pero también intervienen el disulfuro de dipropilo (C6H12S2), el disulfuro de dialilo (C6H10S2), trisulfuro y tetrasulforo de dialilo, etc. Todas estas moléculas contienen átomos de azufre.
Con las cebollas ocurre algo semejante que con los ajos: sólo al triturarlas,
macerarlas, cortarlas, etc., se produce el olor típico y, en este caso, el lagrimeo
consecuente. Nuevamente hay dos reactantes separados por la membrana celular.
La cebolla contiene también un compuesto muy semejante a la aliina, sólo que
sus átomos están acomodados de diferente manera,18 ![]() la
alinasa de la cebolla la convierte en una sustancia lacrimógena, el C3H6SO
(que, a decir verdad, son más de 50 estructuras químicas diferentes, con sus
respectivos nombres). En este caso la nueva molécula es muy reactiva y muy soluble
en agua, de aquí que se disuelva en la película acuosa que cubre los ojos irritándolos
y produciendo el lagrimeo. La misma solubilidad es el remedio para evitar el
llanto cebollino: cortar las cebollas bajo el chorro de agua. Hay muchos remedios
tradicionales al llanto que provoca la cebolla: sostener un pedazo de cebolla
en la cabeza (efectivo, pues se mantienen los ojos alejados de los gases); sostener
un cerillo usado entre los dientes (efectivo, el carbón absorbe los gases);
enfriar las cebollas antes de cortarlas (efectivo, disminuye la volatilidad
de las sustancias lacrimógenas), etcétera.
la
alinasa de la cebolla la convierte en una sustancia lacrimógena, el C3H6SO
(que, a decir verdad, son más de 50 estructuras químicas diferentes, con sus
respectivos nombres). En este caso la nueva molécula es muy reactiva y muy soluble
en agua, de aquí que se disuelva en la película acuosa que cubre los ojos irritándolos
y produciendo el lagrimeo. La misma solubilidad es el remedio para evitar el
llanto cebollino: cortar las cebollas bajo el chorro de agua. Hay muchos remedios
tradicionales al llanto que provoca la cebolla: sostener un pedazo de cebolla
en la cabeza (efectivo, pues se mantienen los ojos alejados de los gases); sostener
un cerillo usado entre los dientes (efectivo, el carbón absorbe los gases);
enfriar las cebollas antes de cortarlas (efectivo, disminuye la volatilidad
de las sustancias lacrimógenas), etcétera.
Tanto en el caso de las cebollas como en el de los ajos la alinasa actúa sobre otras sustancias. La aliina del ajo tiene un autoenlace débil en su estructura el cual, al contacto con la alinasa, se rompe quedando expuesto a la acción del agua que parte a la molécula de aliina y la separa de la alinasa. La alinasa queda entonces dispuesta a recibir nuevas moléculas de aliina y repetir la secuencia.
Es obvio que se puede controlar la intensidad del sabor a ajo o cebolla controlando la cantidad de membranas destruidas, es decir; el tamaño de la picadura de ajo y cebolla. También se puede controlar con la temperatura de cocimiento puesto que el calor destruye las paredes celulares. Y también con el tiempo de cocimiento, ya que las moléculas con azufre (responsables del sabor y olor a ajo o cebolla) se evaporan fácilmente de los alimentos. Por otro lado, los compuestos azufrados entran al torrente sanguíneo y salen con el aliento y el sudor. De aquí que el olor de las personas, efectivamente, depende de su dieta y no sólo de su higiene.
El olor del pescado es debido a las laminas que resultan de la descomposición de las proteínas de la carne.
En la fórmula, R indica a los grupos alquil,19
![]() unos
compuestos de carbono e hidrógeno que se ajustan a la fórmula general CnH2n+1
unos
compuestos de carbono e hidrógeno que se ajustan a la fórmula general CnH2n+1
La forma tradicional de disminuir el olor a pescado es rociar jugo de limón. El grupo amino (-NH2) presente en los compuestos volátiles del pescado tiene la capacidad de asimilar iones hidrógeno (H+), con lo cual la molécula queda cargada eléctricamente:
Ahora bien, puesto que los ácidos tienen una gran abundancia de iones hidrógeno
(capítulo II), el jugo de limón suministra los iones H+
que cargan eléctricamente a las aminas odoríferas y suministra también el agua
en que quedarán disueltas.20 ![]() Con
lo anterior las partículas odoríferas quedan disueltas en el agua del jugo de
limón sin llegar a las membranas de la nariz del comensal.
Con
lo anterior las partículas odoríferas quedan disueltas en el agua del jugo de
limón sin llegar a las membranas de la nariz del comensal.
El característico olor de los huevos cocidos lo causa, ya lo hemos dicho, el
ácido sulfhídrico (H2S) producido
por la descomposición de las proteínas. La temperatura del cocimiento hace que
la albúmina21 ![]() (principal
componente de la clara, después que el agua) genere este gas que, afortunadamente,
es muy soluble en agua.22
(principal
componente de la clara, después que el agua) genere este gas que, afortunadamente,
es muy soluble en agua.22 ![]() Ahora
bien, los gases son más solubles a baja temperatura por lo que conviene poner
el huevo recién cocido bajo el chorro de agua fría por unos segundos. Lo anterior
tiene una ventaja más: se evita la formación de una desagradable capa verdosa
sobre la yema de huevo. Ésta, como es sabido,23
Ahora
bien, los gases son más solubles a baja temperatura por lo que conviene poner
el huevo recién cocido bajo el chorro de agua fría por unos segundos. Lo anterior
tiene una ventaja más: se evita la formación de una desagradable capa verdosa
sobre la yema de huevo. Ésta, como es sabido,23 ![]() y
lipovitelinina, que contienen hierro; éste descompone al ácido sulfhídrico formando
un sulfuro verdoso que cubre a la yema.
y
lipovitelinina, que contienen hierro; éste descompone al ácido sulfhídrico formando
un sulfuro verdoso que cubre a la yema.
En los alimentos hay cuatro tipos fundamentales de colorantes:
1) Los carotenoides24 ![]() constituyen
un grupo de pigmentos amarillos, rojos y naranjas distribuidos en casi todos
los organismos vivos. Generalmente los carotenoides son insolubles en agua pero
se disuelven fácilmente en grasas y en alcohol. Dan el color naranja a las,
obvio, naranjas, zanahorias, maíz, duraznos, tomates, etc. También se hallan
en la yema de huevo, la piel de pollo, mariscos, etc. En este último caso los
carotenoides se hallan unidos a una proteína. Como habrá sospechado el antojadizo
lector este complejo caroteno-proteína25
constituyen
un grupo de pigmentos amarillos, rojos y naranjas distribuidos en casi todos
los organismos vivos. Generalmente los carotenoides son insolubles en agua pero
se disuelven fácilmente en grasas y en alcohol. Dan el color naranja a las,
obvio, naranjas, zanahorias, maíz, duraznos, tomates, etc. También se hallan
en la yema de huevo, la piel de pollo, mariscos, etc. En este último caso los
carotenoides se hallan unidos a una proteína. Como habrá sospechado el antojadizo
lector este complejo caroteno-proteína25 ![]() se
rompe con la temperatura (generalmente los mariscos26
se
rompe con la temperatura (generalmente los mariscos26 ![]() pasan
por agua hirviente antes de llegar a la boca del comensal), lo que da lugar
al color rojo naranja de los carotenoides de los camarones. El mismo resultado
se obtiene con alcohol.
pasan
por agua hirviente antes de llegar a la boca del comensal), lo que da lugar
al color rojo naranja de los carotenoides de los camarones. El mismo resultado
se obtiene con alcohol.
Aunque los carotenoides están presentes en casi todos los vegetales y en las hojas verdes de los árboles permanecen ocultos por la clorofila. Sólo en otoño, cuando disminuye la clorofila, aparecen los carotenos: amarillos, naranjas, rojos, dando la coloración típica de las hojas.
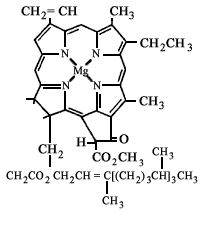
Figura III. 5. Clorofila a.
2) En general, todos los vegetales verdes contienen clorofila.27
![]() Son
los más abundantes en nuestra dieta: espárragos, alcachofas, lechugas, calabazas,
perejil, berros, acelgas, espinacas, chícharos, cilantro, etc., etcétera.
Son
los más abundantes en nuestra dieta: espárragos, alcachofas, lechugas, calabazas,
perejil, berros, acelgas, espinacas, chícharos, cilantro, etc., etcétera.
La clorofila forma parte de una clase de compuestos llamados porfirinas.28
![]() Éstas
están formadas por una estructura anillada combinada con un metal y una proteína.
La hemoglobina es la porfirina más importante del reino animal mientras que
la clorofila lo es del vegetal. En la figura III.5 se presenta la estructura
simplificada de la porfirina llamada clorofila a.
Éstas
están formadas por una estructura anillada combinada con un metal y una proteína.
La hemoglobina es la porfirina más importante del reino animal mientras que
la clorofila lo es del vegetal. En la figura III.5 se presenta la estructura
simplificada de la porfirina llamada clorofila a.
En algunos frutos como cítricos, plátanos y tomates puede haber un color verdoso indeseable debido, obviamente, a la clorofila. Para destruirla se emplea etileno. Este compuesto también se emplea para blanquear el apio, melón, peras, piñas, etcétera.
3) Las antocianinas,29 ![]() producen
los colores azules y rojos de cebolla morada, repollo morado, fresas, betabel,
etc. Como los pigmentos del siguiente apartado, las antoxantinas, casi no se
presentan en animales. En particular las antocianinas cambian notablemente de
color cuando varía el pH. Los cocineros saben que para conservar el color
de los betabeles les conviene un pH ácido y, por lo mismo, les añaden
jugo de limón o vinagre.
producen
los colores azules y rojos de cebolla morada, repollo morado, fresas, betabel,
etc. Como los pigmentos del siguiente apartado, las antoxantinas, casi no se
presentan en animales. En particular las antocianinas cambian notablemente de
color cuando varía el pH. Los cocineros saben que para conservar el color
de los betabeles les conviene un pH ácido y, por lo mismo, les añaden
jugo de limón o vinagre.
Una propiedad interesante de las antocianinas es el cambio de color que presentan cuando se tratan con ácidos a álcalis. La exposición de los pétalos de una flor roja a los vapores del amoniaco (o Ajax con "amonia") los vuelve azul verdoso; una flor azul se pone roja al sumergirla en vinagre.
En las frutas enlatadas las antocianinas llegan a corroer el envase formando sales de estaño y hierro disminuyendo la calidad del producto.
4) Las antoxantinas,30 ![]() dan
lugar al color cremoso de cebollas, espárragos, coliflor, arroz, etc., que en
pH alcalino se vuelve amarillento (de aquí que las amas de casa, para
cocer el arroz blanco, le pongan unas gotas de limón).
dan
lugar al color cremoso de cebollas, espárragos, coliflor, arroz, etc., que en
pH alcalino se vuelve amarillento (de aquí que las amas de casa, para
cocer el arroz blanco, le pongan unas gotas de limón).
Los tres últimos tipos de pigmentos vegetales cambian de color cuando se someten a cocimiento. El caso de la clorofila se tratará más adelante al hablar de los aderezos en "Las ensaladas".
Los carotenos, en cambio, son casi insensibles al calor y la acidez. Por eso al cocinar vegetales verdes, cuando se ha descompuesto la clorofila, se manifiestan los carotenos: amarillos, rojos, anaranjados. En consecuencia, para conservar verdes las verduras conviene cocinarlas rápidamente. Para ello conviene calentar primero el agua y añadir después las verduras; mientras más agua se haya calentado más rápido será el cocimiento.
Nuestros sentidos del gusto y del olfato figuran entre los más asombrosos laboratorios químicos. En una fracción de segundo pueden identificar la estructura química y la concentración de una gran cantidad de compuestos independientemente de las sustancias con que se encuentren mezclados.
Cualquier persona que haya estado acatarrada sabe que la percepción del sabor depende del olfato, siendo muy difícil precisar en qué medida interviene éste en aquél. Sin lugar a dudas el olfato es mucho más preciso y sensible que el gusto, además de que actúa a distancia, pues detecta sustancias volátiles. El olfato puede distinguir casi 10 000 olores diferentes.
Así como hay personas que tienen ceguera a algunos colores, las hay que tienen "ceguera" a algunos sabores y olores, como pueden ser las capsicinas de los chiles (de éstas se trata más adelante).
En el siglo pasado Hendrik C. Zwaardemaker ideó un sistema para clasificar los olores en términos de nueve fundamentales:
1) Etéreo: frutas, resinas, éter.
2) Aromático: alcanfor, clavo, limón.
3) Fragante: violeta, vainilla.
4) Ambrosiano: ámbar; almizcle.
5) Aliáceo: cloro, ácido sulfhídrico.
6) Empireumático: café tostado, benceno, creosota.
7) Caprílico: queso, grasas rancias.
8) Repulsivo: chinche, hierba mora, belladona, beleño.
Sin duda muchos olores pueden clasificarse dentro de estos nueve tipos, pero hay muchos otros que escapan de esta división.
Las células olfatorias, como es sabido, llegan a su umbral de sensibilidad a partir de cierta concentración y duración, lo anterior significa que dejan de detectar cierto olor. Tal fatiga puede considerarse específica para cada olor (pues estimula a los mismos receptores), de manera que un examen de fatiga puede comprobar si un olor es esencialmente el mismo que otro. Los experimentos han mostrado que el alcanfor y el clavo producen el mismo tipo de fatiga, esto es, si el olfato ya no llega a reconocer al alcanfor tampoco reconoce al clavo (ambos están en el mismo grupo de aromáticos de Zwaardemaker).
Hace casi 40 años Ernest C. Crocker y Lloyd F. Henderson propusieron reducir los olores a sólo cuatro tipos fundamentales, correspondientes a los cuatro tipos de células olfatorias. Según este sistema todos los olores están compuestos de los siguientes:
Cualquier olor se describe por una fórmula numérica que da la idea de intensidad (de 1 a 8) para cada componente. El olor de una rosa será 6-4-2-3, indicando que es más fuerte en fragancia que en olores empireumático y caprino y que tiene un mediano olor ácido. Con este sistema la vainilla tiene la descripción 7-1-2-2 y el alcohol etílico 5-4-1-4. Con todo, intentar describir el universo de los olores en términos de cuatro tipos básicos es realmente una sobresimplificación. Basta mencionar que en el olor del café se han identificado... ¡800 compuestos volátiles!
Hasta donde se sabe los compuestos que tienen olores semejantes tienen átomos agrupados en estructuras semejantes. Así los compuestos que tienen olor a alcanfor poseen pequeños grupos de átomos amontonados junto a un átomo de carbono. Incluso pueden ser grupos de átomos muy diferentes: metil, halógeno, nitro, etc. Sin embargo, en ocasiones la naturaleza del grupo sí interviene en el olor; por ejemplo, si en un compuesto con olor a menta se reemplaza un grupo metil (-CH3) por un hidrógeno (-H) se obtiene olor a alcanfor. Por otro lado, sólo una parte de la molécula tiene importancia en su comportamiento olfatorio.
En cuanto al sentido del gusto se acepta que hay sabores fundamentales: amargo, salado, dulce y ácido. Sin embargo, hay más de 10 000 compuestos químicos que intervienen en el sabor y olor de los alimentos. Tan sólo en el sabor de chocolate se han identificado 47 compuestos de los que ninguno tiene sabor a chocolate. Éste resulta de la mezcla en proporciones justas de los constituyentes. Y algo parecido ocurre con el pan, la leche, el café, ¡la cerveza!, etcétera.
El aparato gustatorio está colocado principalmente en la superficie superior de la lengua, en la parte posterior de la bóveda del paladar; la epiglotis y el inicio de la garganta. El sabor amargo se identifica en la parte posterior de la lengua, mientras que lo dulce y lo salado se reconoce en la punta y los lados de la lengua. A diferencia del olfato el gusto sólo identifica las sustancias disueltas en agua a concentraciones 3 000 veces mayor que la necesaria para el olfato.
También en este sentido se han hecho intentos por relacionar el sabor con características químicas. El gusto ácido está efectivamente relacionado con la acidez de la solución, es decir, la concentración de iones H+. El sabor salado proviene de... las sales de algunos metales. Hay excepciones, el cloruro de sodio (sal de cocina) es, por supuesto, salado, mientras que el cloruro de cesio es amargo y durante un tiempo se empleó una sal orgánica de plomo como ¡endulzante!
Para las sustancias dulces es muy difícil encontrar algo en común aparte del sabor. Entre éstas se hallan, la sacarina, la dulcina y el cloruro de berilio, compuestos con muy diferente composición y estructura química. Y lo mismo ocurre con las sustancias amargas con un punto sorprendente: una pequeña modificación en la estructura de una sustancia amarga la transforma en dulce, así se puede obtener dulcina al sustituir un átomo de azufre por uno de oxígeno en la p-etoxifeniltiocarbamida. Esta sustancia es particularmente reveladora de la "ceguera" al sabor; para tres de cada diez gentes no es amarga sino insípida.
Durante mucho tiempo las investigaciones acerca de los olores y sabores se limitaban a las sustancias, actualmente se estudia el mecanismo receptor de las células. Hay una teoría enzimática según la cual las sustancias reaccionan por una catálisis enzimática, véanse en los capítulos I y II, "Las enzimas".
Puesto que las enzimas son sensibles a concentraciones muy bajas y a una gran variedad de agentes, se puede explicar la sensibilidad del olfato y la diversidad tan grande de sustancias odoríferas. Asimismo la reversibilidad de los efectos inhibitorios en las enzimas explica la recuperación del efecto de fatiga olfativa.
Los refinamientos en estos sentidos son señal inequívoca del nivel cultural de la sociedad, como aseguran los franceses.
Según algunos entusiastas, la gastronomía debe figurar entre las bellas artes.31
![]() Lo
que sí es indiscutible es que una buena comida causa impresión sobre más de
un sentido en más de un sentido. La vista, el olfato, el gusto, el tacto, son
los más directamente involucrados. Para alimentos como apio y zanahoria, alguien
añadiría el oído, lo mismo que con los melones y sandías, pues suele conocerse
el estado de estas frutas por el sonido que producen al golpearlas. Así que
lo que denominamos "sabor" de un alimento es resultado de tres sensaciones:
tacto, olfato y gusto.
Lo
que sí es indiscutible es que una buena comida causa impresión sobre más de
un sentido en más de un sentido. La vista, el olfato, el gusto, el tacto, son
los más directamente involucrados. Para alimentos como apio y zanahoria, alguien
añadiría el oído, lo mismo que con los melones y sandías, pues suele conocerse
el estado de estas frutas por el sonido que producen al golpearlas. Así que
lo que denominamos "sabor" de un alimento es resultado de tres sensaciones:
tacto, olfato y gusto.
El aspecto visual de un alimento es el primer paso para predecir el grado de
satisfacción que se obtendrá al comerlo. Las decisiones para comprar alimentos
se basan en el aspecto, en el color, textura y consistencia. Las sensaciones
del tacto al comer son respuestas a la textura, consistencia y temperatura,
la cual influye grandemente en el sabor y el aroma. El gusto es un sentido que
responde a los componentes químicos de los alimentos por las papilas gustativas,
localizadas principalmente en la lengua. Generalmente se aceptan cuatro sabores
básicos: dulce (azúcar), agrio (vinagre), salado (sal) y amargo (cafeína). La
capacidad de reconocer sabores es resultado de muchos factores: genéticos, fisiológicos,
salud, hábitos, etc. Así, por ejemplo, la capacidad de sentir el picor intenso
de la feniltiocarbamida (PTC)32![]() o de las capsicinas.
o de las capsicinas.
El aroma de un alimento no sólo llega a través de las fosas nasales, en la masticación y deglución llega por la región posterior del paladar al tejido olfatorio.
No hay duda de que el arte culinario pretende combinar sabor con nutrición. Y para lo primero se emplean aditivos como sal, azúcar, especias, etcétera.
Curiosamente los principales componentes de los alimentos (proteínas, hidratos de carbono, grasas, etc.) tienen relativamente poco sabor. El azúcar es el único ingrediente que tiene importancia por su sabor. En gran medida son las "impurezas" (sustancias en muy bajo porcentaje) las que suministran el sabor a los víveres. Algunos comestibles toman buen sabor con su desarrollo natural, por ejemplo, frutas, nueces y verduras. Otros lo obtienen de la química de la cocina: la acción de la temperatura produce cambios químicos en carne, pescado, huevos, mariscos, café, etc., y la adición de saborizantes.
Los saborizantes de origen natural pertenecen a diversas familias químicas: alcoholes, cetonas, aminas, ácidos, ésteres, aldehídos, lactonas, hidrocarburos sulfurosos, etc. Sorprenderá saber que se emplean en porcentajes muy bajos, menos de un 0.001%, al preparar los alimentos. Hay ciertas sustancias que mejoran considerablemente el sabor de los alimentos, son los llamados potenciadores por tecnólogos de alimentos y sazonadores por los diletantes culinarios. Entre ellos están la sal y el glutamato, presente en muchos sazonadores comerciales. El glutamato monosódico (MSG) tiene la fórmula
y consiste en cristales blancos solubles. Es particularmente eficaz para los productos de carne.
Por su efecto potenciador se emplea la sal en repostería: sirve para acentuar el sabor dulce (con menor gasto de azúcar). Con todo, también es cierto que añadir sal reduce el sabor ácido de la fruta verde y un sabor empalagoso puede reducirse agregando una pequeña cantidad de sal.
Para la sazón de las comidas también se emplean las especias que tienen, además,
fama de ser preservadores. Sin embargo las especias no constituyen un conservador
químico, aunque sí contienen sustancias antibacterianas. Con todo, las bajas
cantidades en que se emplean las especias para sazonar hacen muy discutible
su papel antibacteriano. Los terpenos33 ![]() que
se obtienen de la nuez moscada, canela, mejorana, tomillo, laurel, pimientos,34
que
se obtienen de la nuez moscada, canela, mejorana, tomillo, laurel, pimientos,34
![]() cítricos,
clavo, menta y cilantro tienen, efectivamente, propiedades antimicrobianas.
Los aceites de las especias tienen algunas propiedades inhibidoras para bacterias
y hongos, así ocurre con: la alcaravea, el cardamomo, el cilantro, el comino,
el hinojo, la cebadilla, el ajonjolí, el anís, el apio, el eneldo y la mostaza.
cítricos,
clavo, menta y cilantro tienen, efectivamente, propiedades antimicrobianas.
Los aceites de las especias tienen algunas propiedades inhibidoras para bacterias
y hongos, así ocurre con: la alcaravea, el cardamomo, el cilantro, el comino,
el hinojo, la cebadilla, el ajonjolí, el anís, el apio, el eneldo y la mostaza.
El ajo y la cebolla también poseen propiedades antimicrobianas debido a los compuestos de tiosulfonato que contienen; estas características se conservan incluso en el ajo deshidratado.
Las hierbas y especias se usan desde tiempo inmemorial para sazonar alimentos. Generalmente las hierbas se clasifican como tales por tener tallos blandos cuyos brotes se emplean frescos o secos. Las hierbas tienen un bajo contenido de aceites volátiles, es decir, que se evaporan. Las especias incluyen cortezas (canela), raíces (jengibre), botones de flor (clavo), semillas (pimienta) y frutas (cardamomo). Tienen un gran contenido de aceites volátiles, por lo que son muy aromáticas. En ciertas especias como los chiles los componentes no volátiles son más importantes para sazonar.
Los chiles empleados en las salsas son las variedades de Capsicum annum
y Capsicum frutescens, que dan sus características propias de sabor
y picor. El ingrediente activo pertenece a una extensa familia de compuestos
conocida como cápsicos.35 ![]() La sensación de dolor debida a los picantes es estimulada por muchas especias:
pimientas negra y blanca, chiles, mostaza, clavo, canela, etc. y también por
ciertas verduras como rábano, cebolla, ajo, jengibre, etcétera.
La sensación de dolor debida a los picantes es estimulada por muchas especias:
pimientas negra y blanca, chiles, mostaza, clavo, canela, etc. y también por
ciertas verduras como rábano, cebolla, ajo, jengibre, etcétera.
Aunque la capsicina no tiene sabor ni olor característicos, una parte en cien mil de agua provoca ardor persistente en la lengua. Como suele ocurrir en química orgánica la capsicina no se refiere a una sustancia sino, al menos, a cinco tipos de compuestos.
La composición de la carne es, en general, 73% de agua, 18% de proteína, 4% de sustancias no proteínicas solubles y 3% de grasa. Estas proteínas son importantes no sólo desde el punto de vista de la nutrición sino también de las propiedades gastronómicas de la carne: textura, color, sabor, olor; etc. A la fecha se han identificado cerca de 50 componentes proteínicos, muchos de los cuales son enzimas que, estando vivo el animal, intervenían en la acción muscular. El colágeno (véase "Las proteínas" en el capítulo 1) y la grasa intramuscular tienen gran influencia en la suavidad de la carne.
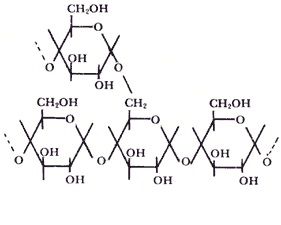
Figura III. 6. Estructura simplificada del glicógeno.
La carne es popular por su carácter nutritivo y por su atractivo: aroma, sabor;
etc. El cocimiento, por lo general, aumenta tal atractivo mejorando el sabor;
la blandura y la digestibilidad. Básicamente hay tres formas de preparación:
calor seco (rostizado 36 ![]() y asado), calor húmedo (cocido, estofado37
y asado), calor húmedo (cocido, estofado37 ![]() )
y calor con aceite (salteado,38
)
y calor con aceite (salteado,38 ![]() freído).
Otros métodos son: el ahumado, el uso de las microondas y la barbacoa.39
freído).
Otros métodos son: el ahumado, el uso de las microondas y la barbacoa.39 ![]() Cada
procedimiento tiene su resultado específico en el producto final. Así, por ejemplo,
el asado y el freído caramelizan la superficie mejorando el color, la textura
y el sabor. Puede pacer extraño hablar de caramelización de la carne
pero, recordemos, uno de sus componentes es el glicógeno, figura III.6, esto
es, un almidón, esto es, un polisacárido, esto es... ¡un azúcar! Compare la
fórmula del glicógeno con la de la maltosa (disacárido), figura I.2.
Cada
procedimiento tiene su resultado específico en el producto final. Así, por ejemplo,
el asado y el freído caramelizan la superficie mejorando el color, la textura
y el sabor. Puede pacer extraño hablar de caramelización de la carne
pero, recordemos, uno de sus componentes es el glicógeno, figura III.6, esto
es, un almidón, esto es, un polisacárido, esto es... ¡un azúcar! Compare la
fórmula del glicógeno con la de la maltosa (disacárido), figura I.2.
Casi siempre se usan para estos métodos los cortes más tiernos porque el calor seco tiende a cortar las fibras musculares endureciendo el producto. El horneado, con cierto grado de humedad resultante de la combustión (véase "El horno", capítulo II) da una carne más suave que el asado pues el calor húmedo hidroliza parcialmente el tejido colagenoso. El color y el sabor producidos por calor húmedo no son tan apetecibles como en el asado, razón por la cual la carne horneada lleva muchos condimentos; a la carne asada, en cambio, le basta un poco de sal, cebollitas y cerveza.
El color de la carne preparada influye notablemente en el apetito. "Término medio" indica el punto de oxidación de la oxihemoglobina (55 a 62°C); "bien cocida" corresponde a formación de pigmentos hemo (65°C) que dan el color gris café. A mayor temperatura la caramelización (véase "Freír", capítulo II) produce un color café oscuro muy atractivo.
Los principales pigmentos de la carne son proteínas conjugadas: hemoglobina (procedente de la sangre que queda en los tejidos) y, en mayor grado, mioglobina (componente del tejido muscular). La mioglobina, a semejanza de la hemoglobina, tiene una fuerte afinidad por el oxígeno y, en su presencia, se combina con el oxígeno molecular para formar oximioglobina. La reacción es reversible e implica "oxigenación" más que oxidación, ya que el hierro de la fracción hémica de la molécula está en estado ferroso en ambos compuestos. El pigmento de la superficie de la carne, debido a la exposición al oxígeno es oximioglobina. El pigmento no oxigenado sólo se da dentro de la carne. La oximioglobina es de color rojo brillante (como habrá supuesto el bien bañado lector), la mioglobina rojo púrpura.
Si la oximioglobina se oxida forma un pigmento pardo, la metamioglobina. Lo anterior ocurre en la carne vieja o durante el cocimiento de la carne fresca. Como mencionamos, la reacción de oxidación es reversible. Algunos carniceros lo saben y ponen azúcar en la carne molida para recuperar el color rojo de la mioglobina.
Cuando se calienta cualquiera de estos pigmentos se coagulan las proteínas y la hematina se vuelve parda, el típico color de la carne fresca cocida. Cuando las carnes curadas (jamón, tocino, cecina, etc.) se cuecen conservan su color rojo. Las carnes curadas generalmente llevan nitrato de sodio, el cual les da un color rosado estable por la producción de mioglobina nítrica. Si bien este pigmento se descompone con el calor, el producto es, nuevamente, de color rojo claro o rosado (hemocromógeno nítrico).
Hay varios factores que influyen en la suavidad de la carne. Desde los antecedentes genéticos del animal, su salud y alimentación hasta, después de sacrificado, el tiempo de almacenamiento, la temperatura, la adición de suavizantes y la forma de preparación.
Entre una raza y otra existe una gran variedad de suavidades, lo mismo que entre un animal y otro e, incluso, dentro de un mismo músculo. Por lo anterior; la habilidad del carnicero es importante para lograr la suavidad de un "corte".
Las enzimas ya existentes en la misma carne pueden emplearse, bajo condiciones controladas, para suavizarla o endurecerla. Si se añejan los cortes buenos se logra mejor sabor y mayor suavidad. Para ello la carne se almacena de 10 a 40 días a 1°C a fin de que las enzimas naturales lleven a cabo su proceso de suavizamiento.
Para ablandar la carne se emplean diferentes enzimas proteolíticas: papaína,40![]() ficina41
ficina41 ![]() y bromelaína.42
y bromelaína.42 ![]() En cualquier caso se trata de disminuir la longitud de las fibras y su anudamiento.
En cualquier caso se trata de disminuir la longitud de las fibras y su anudamiento.
Como mencionamos en el capítulo II ("Ácidos y bases en la cocina"), al hablar del color de los alimentos, la molécula de clorofila tiene un átomo de magnesio que es eliminado por los ácidos; así desaparece el característico color verde de la clorofila y aparece el parduzco debido a los carotenos. Puesto que la base universal de los aderezos es el vinagre, es decir una buena parte de ácido acético, añadirlo a las ensaladas les mejora el sabor pero perjudica su color. La solución doméstica al inevitable pardeamiento de las ensaladas aliñadas es poner el aderezo justo antes de consumirlas.
En general, los aderezos son emulsiones en las que se ha dispersado el aceite
en agua.43 ![]() Como
emulsificante se emplea la yema de huevo, que de suyo es ya una emulsión muy
estable, lo que permite la dispersión del aceite vegetal en el vinagre. En los
aderezos de ensaladas el aceite está expuesto a muchos factores que lo enrancian:
el tiempo, la temperatura, la luz, el aire, la superficie expuesta, la humedad,
el material orgánico nitrogenado y algunos metales. Puesto que el aceite se
halla disperso, la superficie activa es muy grande (véase "Soluciones, suspensiones,
emulsiones...", en este mismo capítulo) y cada vez que se agita para dispersar
los demás componentes se incorpora aire a la emulsión. En condiciones atmosféricas
normales la oxidación de los aceites (enranciado) pasa por un periodo de inducción:
el aceite absorbe oxígeno muy lentamente a una velocidad casi constante. En
este periodo el cambio de sabor es apenas perceptible. En la segunda etapa el
oxígeno forma hidroperóxidos o peróxidos al romper los enlaces dobles de los
ácidos grasos no saturados. Esta reacción tiene una velocidad alta que aumenta
rápidamente según una curva logarítmica hasta llegar a un máximo. Las mayonesas
y aderezos hechos con aceite de soya permanecen en buenas condiciones durante
mucho tiempo; pero los aceites de maíz y algodón son superiores.
Como
emulsificante se emplea la yema de huevo, que de suyo es ya una emulsión muy
estable, lo que permite la dispersión del aceite vegetal en el vinagre. En los
aderezos de ensaladas el aceite está expuesto a muchos factores que lo enrancian:
el tiempo, la temperatura, la luz, el aire, la superficie expuesta, la humedad,
el material orgánico nitrogenado y algunos metales. Puesto que el aceite se
halla disperso, la superficie activa es muy grande (véase "Soluciones, suspensiones,
emulsiones...", en este mismo capítulo) y cada vez que se agita para dispersar
los demás componentes se incorpora aire a la emulsión. En condiciones atmosféricas
normales la oxidación de los aceites (enranciado) pasa por un periodo de inducción:
el aceite absorbe oxígeno muy lentamente a una velocidad casi constante. En
este periodo el cambio de sabor es apenas perceptible. En la segunda etapa el
oxígeno forma hidroperóxidos o peróxidos al romper los enlaces dobles de los
ácidos grasos no saturados. Esta reacción tiene una velocidad alta que aumenta
rápidamente según una curva logarítmica hasta llegar a un máximo. Las mayonesas
y aderezos hechos con aceite de soya permanecen en buenas condiciones durante
mucho tiempo; pero los aceites de maíz y algodón son superiores.
En los aderezos también se emplean sustancias endulzantes: azúcar de caña, dextrosa, jarabe de maíz, glucosa, miel, etc. Además se añaden especias: mostaza, pimienta, pimentón, cebolla, ajo, jengibre, clavo, etc., etc., etcétera.
Para aumentar la viscosidad del aderezo se emplean almidones. En el capítulo I mencionamos que éstos son carbohidratos altamente polimerizados. En el caso de que sea lineal, como la amilosa, los grupos hidroxilos tienen fuerte afinidad hacia los mismos radicales de las demás moléculas y se forman geles al calentar la suspensión de almidón (si la concentración es suficientemente alta). Hay otros almidones que son polímeros ramificados, como la amilopectina, éstos producen pastas elásticas que no gelatinizan ya que las ramificaciones impiden una orientación uniforme. En la industria de alimentos se emplean ambos tipos de almidones: lineales y ramificados y se modifican sus propiedades haciendo reaccionar sus grupos hidroxilo con diferentes sustancias. De esta forma se reduce a cohesión (semejante a la del caucho) de los almidones ricos en amilopectina y se logra la viscosidad deseada en el aderezo.
Hay otros vegetales empleados en las ensaladas, como el aguacate, que se oscurecen sin necesidad del aderezo. De ellos tratamos en el siguiente párrafo. Véase también "Soluciones, suspensiones, emulsiones..." al inicio de este capítulo III.
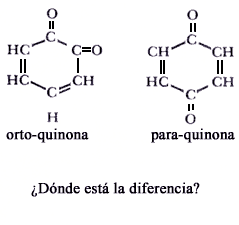
Figura III. 7. Orto y para-quinona.
La enzima responsable del color café que aparece sobre las superficies cortadas
de ciertas frutas es la fenolasa.44 ![]() A
decir verdad, "fenolasa" es un término genérico como azúcar; almidón, gelatina,
etc., y se emplea para nombrar a las enzimas que catalizan la oxidación de sustancias
mono y ortodifenólicas; tienen un peso molecular de 128 000.
A
decir verdad, "fenolasa" es un término genérico como azúcar; almidón, gelatina,
etc., y se emplea para nombrar a las enzimas que catalizan la oxidación de sustancias
mono y ortodifenólicas; tienen un peso molecular de 128 000.
La aparición del color café sobre las frutas y verduras se debe a reacciones
de las o—quinonas,45 ![]() figura
III.7 que comprenden la oxidación catalizada en forma no enzimática y la polimerización
de los productos de oxidación. Donde sí interviene la fenolasa es en la formación
de las o-quinonas. Las o-quinonas son precursoras del color café,
ellas mismas poseen poco color, sin embargo dan lugar a hidroxiquinonas que
se polimerizan y oxidan fácilmente dando, ellas sí, el color café de las frutas.
Esta última reacción de oxidación es rápida y no es enzimática.
figura
III.7 que comprenden la oxidación catalizada en forma no enzimática y la polimerización
de los productos de oxidación. Donde sí interviene la fenolasa es en la formación
de las o-quinonas. Las o-quinonas son precursoras del color café,
ellas mismas poseen poco color, sin embargo dan lugar a hidroxiquinonas que
se polimerizan y oxidan fácilmente dando, ellas sí, el color café de las frutas.
Esta última reacción de oxidación es rápida y no es enzimática.
La fenolasa está ampliamente distribuida en plantas y animales. Entre los productos vegetales que contienen la enzima están: la calabaza, los cítricos, los plátanos, las ciruelas, los duraznos, las peras, las manzanas, los aguacates, los camotes, las papas, los mangos, las berenjenas, los melones, el trigo, las espinacas, los jitomates, las aceitunas, etcétera.
La fenolasa es estable a valores de pH cercanos a 7, es decir, valores neutros. Como la mayoría de las proteínas, la fenolasa puede desnaturalizarse por medio del calor. En productos como las verduras que se cocinarán la solución es obvia. Sin embargo, en las frutas que se comerán crudas debe buscarse un inhibidor. El ácido ascórbico es un efectivo agente reductor de las o-quinonas formadas por la fenolasa, pero como no inhiben la acción de ésta debe ponerse una cantidad excedente.
Otra solución para evitar el color pardo es impedir el contacto del oxígeno con la superficie de la fruta: la clásica mayonesa en el aguacate.
LA "COCA-COLA" Y LA TERMODINÁMICA
El lector perspicaz habrá notado que al destapar una "Coca-Cola" se forman condensaciones dentro de la botella. La razón es que, al bajar rápidamente la presión del gas, la expansión se produce a partir de la energía del mismo gas por lo que disminuye su temperatura y, por tanto, se condensa la humedad.
El proceso descrito es semejante al empleado en el "refri" (véase capítulo II) y al que se puede tener en un encendedor de gas "Cricket". En efecto, si se deja escapar el gas del encendedor (sin encenderlo, es obvio) se notará que el gas sale frío. Y es también semejante al que da lugar a la lluvia. Las masas de vapor producido por la evaporación del agua de mar ascienden por los vientos, disminuye la presión y se produce una expansión del vapor a costa de su energía interna disminuyendo, por consiguiente, su temperatura. El fenómeno de la lluvia es mucho más complejo de lo que indicamos; interviene la presencia de polvo atmosférico, la temperatura, las corrientes de aire del lugar; etc. En pocas palabras: al ascender el aire se expande y lo hace a costa de su energía; si ésta disminuye, disminuye la temperatura.
Nuevamente la "Coca-Cola" puede ilustrar un fenómeno termodinámico. Si el refresco está suficientemente frío al destaparlo se produce su congelación. El diagrama de fase del agua, figura III.8, nos muestra lo que ocurre. El punto 1 corresponde al líquido a una presión mayor que la atmosférica. Cuando se destapa la botella la presión disminuye y el sistema se desplaza punto 2, la temperatura no varía ¡y la "Coca" se congela!
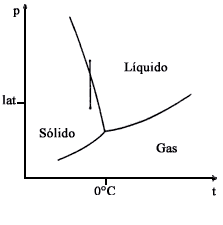
Figura III. 8. Congelamiento espontáneo de la "Coca-Cola".
Aprovecharnos para mencionar que el fenómeno inverso ocurre en el mal llamado "patinaje sobre hielo". La presión de la cuchilla del patín funde el hielo; una vez que ha pasado el patín sobre el líquido el agua recupera la presión original y se congela. En rigor; es "patinaje sobre agua".
Uno de los secretos para preparar un buen atole es agitarlo frecuentemente cuando se está calentando. Debido a su alta viscosidad las corrientes de convección natural no son suficientes para provocar agitación en el líquido, lo que facilita que se queme el atole. Las corrientes de convección son fácilmente visibles al calentar té en un recipiente de vidrio. Al aumentar la temperatura del agua ésta se dilata, véase figura III.11, con lo que disminuye su densidad. Al ser menos densa que el agua fría, el agua caliente asciende arrastrando los trocitos de té. Puede verse cómo las hojitas de té, figura III.9, suben por el centro del recipiente y bajan por los bordes. ¿Puede el lector explicar por que bajan por los bordes?
Figura III. 9. Corrientes de convección natural al hervir té.
¿Y qué diría el bien bañado lector si le aseguramos que el agua no hierve a 100°C (92°C en el D. F)? Basta disponer del siguiente equipo para demostrarlo: una olla grande llena de agua hirviendo que contenga un pocillo de aluminio con agua. El termómetro podrá llegar a 100°C en la olla, y el agua estará hirviendo. Igualmente podrá marcar 100°C en el pocillo ¡pero el agua no hierve!
Como es sabido por el diagrama de fase, la presión de vapor a 100°C es igual a la atmosférica, figura II.4, sin embargo para que se produzca el cambio de fase se requiere suministrar un calor adicional (llamado "calor latente de evaporación" o, mejor; entalpía de evaporación) de 583 cal/g. Para el líquido de la olla este calor se obtiene directamente de la flama (hay una gradiente de temperatura) y se distribuye por las corrientes de convección. Sin embargo para el pocillo no hay gradiente de temperatura ni convección, y el agua contenida en éste no hierve.
Volviendo a las inolvidables quemaduras con atole, es claro que la superficie superior del atole es la que se enfría primero por estar en contacto con el aire que, a su vez, tiene corrientes de convección. Y es claro, que por ser un fluido viscoso, el atole frío no baja fácilmente (aunque haya aumentado su densidad por el enfriamiento). En consecuencia, como cualquiera sabe, el atole de arriba está frío y el de abajo ¡está ardiendo!
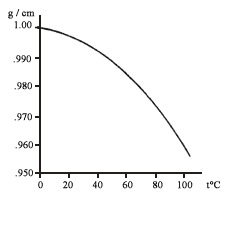
Figura III. 10. Densidad del H2O vs. Temperatura.
La figura III. 10 muestra la variación de la densidad del agua con la temperatura. Nótese que a baja temperatura la densidad es grande, lo que lleva a que el agua fría se dirija al fondo del recipiente. Por el contrario, el agua caliente asciende, como lo habrá notado el lector en el caso del té mencionado antes.
La figura III. 11 muestra un detalle de la III.10. Al bajar la temperatura a menos de 4°C el agua disminuye su densidad y sube a la superficie; en otras palabras, al congelar el agua el hielo se comienza a formar en la superficie.
Por otro lado, cuando se trata de enfriar un líquido conviene poner el hielo encima del vaso, no el vaso encima del hielo. En efecto, el agua fría es más densa que la caliente de forma que aquélla baja manteniendo una diferencia de temperatura respecto al hielo que está arriba del vaso. Si se pone el hielo abajo del vaso el líquido frío queda abajo y no hay corrientes de convección... y el flujo de calor es menor.
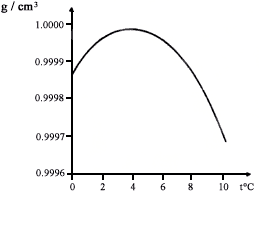
Figura III.11. Densidad del H2O de 0 a 10°C
Figura III.12. El método de la abuelita.
LA CONDUCTIVIDAD TÉRMICA Y OTRAS COSAS
Las abuelas para saber qué tan lleno estaba el "cilindro" de gas bajaban la mano por la superficie del cilindro para saber en dónde se hallaba el nivel del "gas".
Antes hay que aclarar que el gas no se encuentra como tal en el tanque sino como un sistema en equilibrio gas-líquido. Puesto que el "gas" (líquido) es mejor conductor del calor que el "gas" gas, la abuela comenzaba a sentir más frío el cilindro justo donde está el nivel del líquido, figura III. 12.
La capacidad que tiene una sustancia para transmitir el calor es la llamada conductividad térmica. Está relacionada con la sensación de temperatura y calor; como se señala en "La temperatura en la cocina", capítulo II. En este mismo capítulo veremos cómo aprovechar la conductividad térmica del agua para situaciones de emergencia: "El enfriamiento de las chelas"
LA TERMODINÁMICA Y EL ESPAGUETI
Es de todos sabido que para enfriar el atole una forma es añadir atole frío. Con esto se logra una temperatura final que se halla entre la del frío y la del caliente. Tanto más cerca del frío cuanto atole frío se añadió.
Ahora bien, uno de los problemas de la preparación del espagueti 46 ![]() es
que éste se pega fácilmente.
es
que éste se pega fácilmente.
La razón es simple: al cocerse el espagueti las harinas se convierten en almidones
47 ![]() de
manera que la pasta termina "batiéndose". A más de 55°C se rompen los puentes
de hidrógeno de los gránulos de almidón y aumenta notablemente la absorción
de agua (se tiene la ya explicada "gelatinización", véase "Soluciones, suspensiones..."
en este mismo capítulo) La solución es cocerlos rápidamente y lograr que el
almidón se diluya también rápidamente en el agua antes de que se pegue el espagueti.
Ambas cosas se logran calentando mucha agua para el cocimiento y añadiendo el
espagueti cuando el agua está hirviendo. De esta forma la temperatura final
del sistema espagueti-agua estará muy cerca de la del agua y el tiempo de cocimiento
será pequeño. Por otro lado, es claro que la calidad de la pasta, el tipo de
trigo empleado, etc. influyen en que el espagueti se pegue o no. De la misma
forma, para disminuir el tiempo de cocimiento de la coliflor; el brócoli, etc.
y, por tanto reducir el típico olor de éstos, conviene hervir mucha agua y poner
después los vegetales.
de
manera que la pasta termina "batiéndose". A más de 55°C se rompen los puentes
de hidrógeno de los gránulos de almidón y aumenta notablemente la absorción
de agua (se tiene la ya explicada "gelatinización", véase "Soluciones, suspensiones..."
en este mismo capítulo) La solución es cocerlos rápidamente y lograr que el
almidón se diluya también rápidamente en el agua antes de que se pegue el espagueti.
Ambas cosas se logran calentando mucha agua para el cocimiento y añadiendo el
espagueti cuando el agua está hirviendo. De esta forma la temperatura final
del sistema espagueti-agua estará muy cerca de la del agua y el tiempo de cocimiento
será pequeño. Por otro lado, es claro que la calidad de la pasta, el tipo de
trigo empleado, etc. influyen en que el espagueti se pegue o no. De la misma
forma, para disminuir el tiempo de cocimiento de la coliflor; el brócoli, etc.
y, por tanto reducir el típico olor de éstos, conviene hervir mucha agua y poner
después los vegetales.
Volviendo al tema del batido de la pasta, otra solución para evitar que se bata es añadir un poco de aceite al agua. El almidón formado se disuelve en el aceite y éste no se disuelve en el agua; con ello se evita que el almidón se ataque a sí mismo: está separado por el agua.
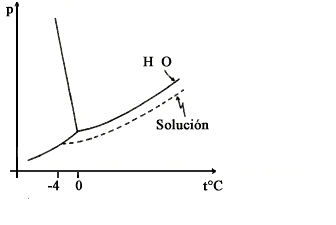
Figura III. 13. Temperatura de congelación de una solución.
EL ENFRIAMIENTO DE LAS "CHELAS"
Los conocimientos teóricos de fisicoquímica llegan al mundo de las necesidades concretas e insoslayables cuando se trata de... enfriar cervezas.
Prepárese una solución saturada de NaCl y viértasele tres charolas con cubos de hielo. En esta mezcla dispónganse las cervezas por enfriar y ¡problema resuelto!
Desde el siglo XVII se sabe que la salmuera permite reducir la
temperatura de fusión del hielo. Precisamente la escala Fahrenheit de temperatura
tenía como punto de calibración la fusión del hielo en salmuera. Ingenuamente,
para nosotros, Daniel Fahrenheit (1724) consideró que ésa era la menor temperatura
posible.
El diagrama de fase del agua nos permite entender la situación, figura III.13.
Ya mencionamos que la línea 1 corresponde al equilibrio entre líquido y vapor.
El punto 2, conocido como "punto triple", 48 ![]() indica
la coexistencia de vapor; líquido y sólido.
indica
la coexistencia de vapor; líquido y sólido.
Si al agua se añade un sólido no volátil, como la sal, la presión de vapor de la solución disminuye, de forma que se necesita una temperatura mayor para lograr la presión de vapor correspondiente al agua pura. Esta situación se representa con la línea punteada 3, de la figura III.13. Como consecuencia la temperatura de congelación de la solución agua-sal es menor que la del agua pura.
Hay un punto muy interesante al respecto, la disminución de la temperatura de congelación es, dentro de ciertos límites, independiente de la sustancia empleada. Sólo depende del número de partículas disueltas. Svante Arrhenius, a fines del siglo pasado, propuso que ciertas soluciones (como la sal, precisamente) provocan una disminución de la temperatura de congelación igual al doble de la que provoca el azúcar porque las moléculas de sal se disocian, es decir, en el agua:
Na Cl è Na+ + Cl -
Y es claro, una partícula de sal da lugar a dos partículas: una de Cl- y otra de Na+.
El gran calor de fusión49 ![]() del
hielo (79 600 cal/kg) y el alto coeficiente de conductividad térmica del agua
(véase "Hornear", capítulo II), hacen el resto.
del
hielo (79 600 cal/kg) y el alto coeficiente de conductividad térmica del agua
(véase "Hornear", capítulo II), hacen el resto.
Es del dominio público que un buen pastel tiene la masa esponjada y firme. Para lograrlo se emplean los polvos para hornear; uno de los más comerciales es el "Royal".
En el "Royal" se recomienda modificar las cantidades de acuerdo con la altura sobre el nivel del mar:
Al nivel del mar use de 1 a 1 1/2 cucharadita cafetera por cada taza de harina; en alturas como la de México, D.F., de 1/2 a 1 cucharadita cafetera, a otras alturas úsese proporcionalmente. (Standard Brands Incorporated)
La Standard Brands acertó con esas recomendaciones. Pero cometió un disparate al decir "a otras alturas úsese proporcionalmente". Con esto dice que si no está uno en el D.F. debe usarlo proporcionalmente, es decir; a mayor altura ¡mayor cantidad de "Royal"! ¿Y por qué habría de ser una excepción el D.F.? Sólo en ese caso se tiene a mayor altura ¡menor cantidad de "Royal"! (Véanse las indicaciones de la Standard Brands.)
Puesto que las burbujas formadas durante el horneado dependen de la elasticidad de la masa, si hay exceso de gas las paredes de las burbujas se rompen perdiéndose el esponjado. En este caso se obtiene una textura gruesa e irregular: La harina que se emplea para hacer pan tiene mayor cantidad de gluten que la de los pasteles y es, por tanto, más elástica y menos sensible a la altura del lugar.
Mejor no mencionar el carácter exponencial de la distribución barométrica... Se entiende que no hayan entrado en detalles los fabricantes de "Royal"... ¡no hay proporcionalidad ni directa ni inversa!
La reacción total, simplificada, para un polvo de hornear que contiene fosfato monocálcico es:
Tanto el CO2 como el H2O contribuyen al esponjado del pastel por la temperatura alta.
Una reacción como ésta ocurre rápidamente de manera que debe regularse su velocidad y temperatura de inicio. Ese es el mérito del "Royal". En la mezcla líquida a base de harina con poco gluten (que retiene los gases producidos) se requiere que los polvos provean mucho gas. Sin embargo, también es importante el momento en que se produce el gas. Si se produce cuando la masa ha endurecido, esto es, cuando la masa ha gelatinizado por el almidón (llamado amilosa, por los químicos), y el gluten y las proteínas del huevo se han coagulado, la producción de gas rompe la estructura rígida y esponjosa. El resultado es un pastel de granos gruesos y volumen menor.
Por otro lado, si la producción de gas en la masa durante el horneado es muy lenta el efecto es parecido: se forma la corteza antes de que se haya liberado todo el gas, se quebranta la estructura del pastel y se producen grietas en la superficie.
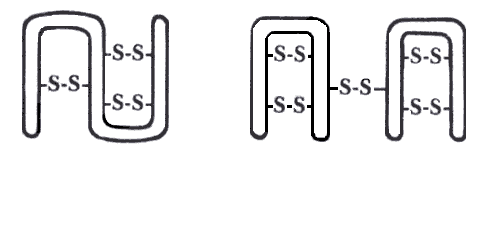
Figura III. 14. Moléculas de gluten.
Una masa muy empleada para pays y galletas es la hojaldrada. Aunque básicamente tiene los mismos ingredientes que la masa común la forma de preparación modifica notablemente el resultado; en particular la forma de amasado es fundamental para el acabado en láminas. Para ello se suele emplear agua fría y tenedor y cuchillo para el amasado. No es sólo por tradición sino porque la sabiduría de las abuelas ya había notado que la temperatura de la mano influye en la consistencia de la grasa y, por consiguiente, en la calidad final del producto. Al amasar a baja temperatura y doblando sobre sí misma la masa repetidas veces se logran varias cosas. Primero, orientar las partículas de gluten (parecidas a largos resortes) y, segundo, distribuir la grasa sin que llegue a formar una pasta homogénea.
En general, el amasado aprovecha el carácter específico de los enlaces de azufre en las proteínas de la harina; éstos se dan dentro de las mismas moléculas de gluten y con otras, figura III.14 El amasado y el agua llevan a la destrucción de los enlaces originales y a la formación de unos nuevos, figura III.15, que dan propiedades elásticas a la masa. Sin embargo, un exceso de amasado termina rompiendo los enlaces intermoleculares y el resultado final es que no se logra el esponjado del pastel.
El helado, tal como lo conocemos, es resultado de una larga evolución. Se atribuye a Nerón el haberlo inventado al endulzar la nieve de las montañas con miel y añadirle jugos de frutas. Algo semejante encontró Cortés en México: los hoy llamados "raspados", "pabellones" o "colorados".
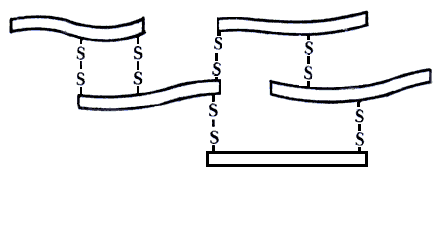
Figura III. 15. Gluten amasado.
En 1777 ya se vendían, en Estados Unidos, helados hechos con crema y leche y en 1851 se comenzaron a fabricar en gran escala en Baltimore.
La composición de los helados es muy variable, generalmente llevan derivados de la leche, huevos, agua, azúcar; saborizantes, colorantes y estabilizadores. La congelación se hace mediante la agitación continua de los ingredientes. Algunos fabricantes emplean glucosa además de sacarosa. La razón es que endulza casi igual que la sacarosa pero por ser aquélla un monosacárido (tiene una masa molecular igual a la mitad de la de la sacarosa) permite disminuir más la temperatura de congelación del helado. En otras palabras, los helados con glucosa tardan más en derretirse.
Es interesante mencionar que los helados llegan a contener más sólidos de leche que la misma leche, por lo que resultan un alimento excelente.
Muchos de los componentes de los helados sirven para hacerlo agradable a la vista, no sólo al paladar. La grasa de la leche, por ejemplo, le da una textura suave y consistente. Los sólidos no grasos (lactosa) mejoran la textura pero el exceso hace arenoso al helado. Los estabilizadores (gelatina, musgo de Irlanda, carboximetilcelulosa sódica, alginato de sodio, pectina) forman estructuras de gel en solución (véase "soluciones, suspensiones..." en este mismo capítulo), impiden la formación de grandes cristales de hielo. Los emulsificantes dan apariencia esponjosa, pues los glóbulos de grasa son más pequeños (2 a 6 micras) y se hallan mejor dispersos. Igual que para la mayonesa (véase "soluciones, suspensiones..." en este mismo capítulo), se emplea la yema de huevo como emulsificante, aunque se reemplaza por monoglicéridos y diglicéridos de ácidos grasos, monoestearato de sorbitán, derivados polioxialquilénicos del monoestearato de sorbitán.
Dependiendo del lugar, el nombre de helado, nieve o sorbete se emplea con diferente
sentido. Sin embargo la distinción entre unos y otros sigue siendo la presencia
de leche (o productos lácteos) o ausencia de éstos, lo que influye en la esponjosidad
del producto.