X. ANALGÉSICOS NARCÓTICOS
CONOCIDAS GENERALMENTE COMO NARCÓTICOS (término derivado de narkotikos, palabra griega que significa adormecimiento), son sustancias relacionadas con los opiáceos, que se utilizan principalmente para combatir el dolor. No hablaremos aquí del grupo de analgésicos no narcóticos, como la aspirina, ya que éstos deben sus efectos a mecanismos no neurales implicados en procesos inflamatorios.
El grupo de los opiáceos, cuyo prototipo es la morfina, tiene interés particular a partir del descubrimiento de sustancias del tipo de la morfina dentro del cerebro. Son las llamadas encefalinas y endorfinas.
(La historia del opio y sus derivados es interesante, y se verá con más detalle en el capítulo XXVI).
La palabra opio se deriva de jugo en griego, pues la droga se obtiene del jugo extraído de los bulbos de la amapola (Papaver somniferum). Los médicos árabes conocían bien sus efectos y probablemente fueron los que introdujeron el opio en el Oriente, donde se le utilizaba básicamente contra la disentería (diarreas agudas). Hacia el siglo XVII, el jugo de amapola era relativamente popular en Europa y hacia el siglo XVIII se fumaba tanto en el Oriente como en el viejo continente.
El opio contiene más de 20 alcaloides. En 1803, el químico alemán Sertürner aisló uno de ellos: la morfina (nombrada así por Morfeo, el dios griego del sueño), y a partir de ese momento se aislaron varios de ellos, como la codeína y la papaverina. Con la invención de la aguja hipodérmica, y la posibilidad de obtener efectos más intensos y rápidos, se inició la era del abuso masivo de opiáceos, en particular durante las guerras en las que a los heridos se les administraba morfina para combatir en forma relativamente indiscriminada el dolor, produciendo así sujetos adictos. Desde la guerra de Secesión en los Estados Unidos de América hasta la guerra de Vietnam, este problema ha transcurrido hasta la fecha. (Nos ocuparemos del problema de esta adicción en la Quinta Parte de esta obra).
A partir de 1915 se sintetizaron compuestos capaces de antagonizar los efectos de los opiáceos. Era necesario contar con tales antídotos para combatir la depresión respiratoria producida por sobredosis de morfina o heroína, y que es la causa más frecuente de muerte por intoxicación de opiáceos. Pero como veremos más adelante, el uso de estos antagonistas puede ser peligroso en sujetos adictos, pues su administración induce la aparición brusca del síndrome de abstinencia o supresión (que se describirá después).
La síntesis química de sustancias derivadas de la morfina produjo nuevos medicamentos
con efectos analgésicos por un lado, antagonista por otro, y también mezclas
de ambos. La existencia de sustancias con efectos tan variados hizo pensar en
la existencia, a nivel del sistema nervioso, de diferentes tipos de receptores
a los opiáceos. En 1973, tres grupos diferentes de investigadores reportaron
el descubrimiento de sitios de reconocimiento (receptores) a opiáceos en el
sistema nervioso de mamíferos. Dos años después, John Hughes y Hans Kosterlitz,
en Inglaterra, reportan el aislamiento, a partir de extractos de cerebro de
puerco, de dos sustancias de tipo peptídico (los péptidos, formados por aminoácidos,
son las moléculas que integran las proteínas) que mostraban efectos del tipo
de la morfina y que se podían revertir con naloxona, el antagonista a opioides
más potente que se conocía hasta esa fecha (en farmacología, la disponibilidad
de antagonistas puros y específicos es fundamental para el estudio de los receptores).
A estos péptidos les llamaron encefalinas. El mismo año, el grupo de Avram Goldstein,
en la Universidad de Stanford, describía una sustancia, también de tipo polipeptídico,
en la glándula pituitaria (hipófisis) de bovino con actividad del tipo opioide,
a la que denominaron b-endorfina. En la actualidad,
se conocen tres familias de péptidos opioides: las encefalinas, las endorfinas
y las dinorfinas. Cada una de estas familias se deriva de un precursor distinto
y tiene una distribución anatómica diferente. Estos precursores se conocen como
proencefalina, proopiomelanocortina (POMC) y prodinorfina, respectivamente.
Cada uno de ellos da lugar a varias sustancias activas. Dependiendo en qué parte
de la cadena peptídica se haga un corte (que se realiza por peptidasas específicas
que reconocen la secuencia de aminoácidos en particular), se obtienen polipéptidos
con efectos diferentes.
En un mecanismo ingenioso que la naturaleza ha creado para ejercer un control más fino de las funciones biológicas a partir de una sola sustancia, al hacer que ésta se encuentre formada, a su vez, por otras sustancias también activas (como una fruta que fuera la unión de todas las frutas y que contuviera todos los sabores, colores, texturas y olores de todas las frutas. El árbol que produjera esta fruta primigenia poseería la capacidad de producir cualquier fruta, pues contaría con todo lo necesario para ello y sabría cómo utilizarlo [enzimas, transportadores, almacenes, etc.] Podría ser el bíblico árbol del saber, también sabedor de la manzana de Adán).
Por ejemplo, la POMC contiene la secuencia de aminoácidos de la
hormona estimulante de los melanocitos (MSH), de la adrenocorticotropina
(ACTH) y de la b-lipotropina. En la
b-lipotropina, proteína presente en la hipófisis,
constituida por 91 aminoácidos, se encuentra incluida la b-endorfina
y la b-MSH. La b-endorfina,
a su vez, incluye una encefalina. Y así sucesivamente (véase la figura X.I).
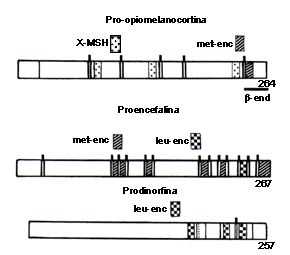
FIGURA X.I. Precursores de las proteínas opioides.
Las tres proteínas precursoras principales de los péptidos opioides, representadas
con barras, formadas por cadenas de aminoácidos son: la proopiomelanocortina,
la proencefalina y la prodinorfina. Estas proteínas contienen varios péptidos
neuroactivos y también varias copias del mismo péptido, como se ilustra con
los pequeños cuadros colocados encima de la proteína, con diferente dibujo.
Por ejemplo, la proencefalina contiene seis copias de la secuencia de aminoácidos
que codifican para la síntesis de la metionina-encefalina. MSH:
hormona estimulante de los melanocitos, de la cual se pueden tener varios subtipos,
indicados aquí por la x, a - MSH, b
- MSH, g - MSH, etc., b
- end: b - endorfina; leu-enc: leucina - encefalina;
met-enc: metionina-encefalina.
La estructura química de las encefalinas y las endorfinas es totalmente distinta. Son péptidos cuyo efecto sólo puede ser demostrado en preparaciones experimentales de células u órganos aislados (in vitro) y por aplicación directa al tejido nervioso. Esto se debe a que a su administración sistémica le sigue rápidamente su destrucción por peptidasas (enzimas que rompen cadenas peptídicas) del plasma. Actualmente se están buscando opioides resistentes a estas peptidasas que puedan tener un uso clínico y que no tengan los riesgos de toxicidad y dependencia.
Se han encontrado, hasta la fecha, tres familias de receptores de opioides
en el SNC, designados como µ (mu), k
(kappa) y d (delta), cada uno de ellos con al menos
dos categorías. Cada uno de estos receptores tiene diferentes afinidades para
agonistas y antagonistas, así como diferente localización (y posiblemente, diferente
función), pero comparten una serie de características: frecuentemente se localizan
en las terminales nerviosas presinápticas, en donde ejercen un control inhibitorio
de la liberación de neurotransmisores. También, un gran número de ellos se encuentran
acoplados a proteínas G, segundos mensajeros que regulan el tránsito de señales
transmembranales (véase la Segunda Parte de esta
obra).
No tratamos aquí de abrumar al lector con tanta información relativa a esta multiplicidad de receptores, sino de abrir perspectivas de las posibilidades farmacológicas de este conocimiento: el diseño de analgésicos potentes que no produzcan dependencia, la síntesis de antidiarreicos sin efectos narcóticos, la síntesis de antitusivos eficaces y poco tóxicos, etc., serán posibles en el futuro gracias a este conocimiento. Pero volvamos a nuestro tema.
Tomaremos a la morfina como prototipo de sustancia opioide, ya que sigue siendo la referencia contra la cual comparamos a las demás. Como decíamos, es un alcaloide que se extrae del exudado lechoso obtenido de la amapola el cual, una vez seco y convertido en polvo, constituye el opio. A partir de la modificación química de la molécula de la morfina podemos obtener derivados más potentes, como la heroína, antagonistas, como la naloxona, o fármacos con efectos más circunscritos, como la apomorfina, sustancia que no tiene propiedades analgésicas pero que es un potente emético (inductor de vómito).
La morfina y sus derivados tienen gran número de efectos sobre el sistema nervioso y sobre el sistema gastrointestinal. Entre ellos tenemos el de analgesia, somnolencia, cambios en el estado de ánimo, depresión respiratoria, disminución de la motilidad del tubo digestivo, náusea, vómito y otras reacciones sobre el SNA y endocrino.
Esta diversidad de efectos se debe a los diferentes tipos de receptores a los opiáceos que se encuentran en el tejido nervioso, tanto central como periférico. Mencionemos aquí que el sistema gastrointestinal contiene tantas neuronas como las que tiene el cerebro, con tantos neurotransmisores como los del SNC.
La analgesia producida por la morfina tiene la particularidad de que ocurre sin pérdida de la consciencia y no afecta otras modalidades sensoriales. En sujetos con dolor, éste puede volverse más tolerable o incluso desaparecer totalmente. Si se administra el alcaloide a sujetos sin dolor, los efectos no siempre son agradables, y pueden tener náusea, vómito, somnolencia, apatía, y letargo. A medida que la dosis aumenta, los efectos subjetivos se vuelven más pronunciados. En sujetos habituados, el efecto euforizante es también mayor. Con dosis de 15 a 20 mg, incluso dolores muy intensos se alivian, aunque con estas dosis la depresión respiratoria —principal efecto tóxico de la morfina— constituye un peligro importante.
Los efectos analgésicos de la morfina se producen tanto a nivel del cerebro como de la médula espinal, y ambos son sinérgicos (esto es, se suman uno al otro). Los efectos centrales son múltiples: además de la analgesia se puede observar disminución de la temperatura corporal y alteraciones neuroendócrinas por acciones en el hipotálamo. La morfina y derivados producen, en forma característica, constricción pupilar (miosis). En casos de abuso o sobredosis por morfina o sus derivados, las pupilas aparecen como puntos (grado máximo de miosis), siendo este signo patognomónico (es decir, característico y suficiente para establecer el diagnóstico).
Otra de las acciones clásicas de los opioides es la depresión respiratoria. Ésta aparece incluso con dosis bajas, y va aumentando a medida que se incrementa la dosis. El mecanismo de esta depresión radica en la disminución de la sensibilidad del tallo cerebral al aumento de la concentración sanguínea de CO2 (lo cual usualmente estimula la respiración). Ésto mismo sucede normalmente durante el sueño, y los efectos de la morfina y del sueño se adicionan. En términos prácticos esto quiere decir que en casos de intoxicación, es esencial no permitir que el sujeto duerma, porque la depresión respiratoria aumentaría y, consecuentemente, el riesgo de muerte por asfixia.
Un efecto relacionado con este último problema es el antitusivo. La morfina y derivados (como la codeína y el dextrometorfán), deprimen el reflejo de la tos. El uso de jarabes que contienen estos derivados es relativamente frecuente.
A nivel gastrointestinal, los opioides son conocidos desde hace siglos por sus efectos antidiarreicos, los cuales persisten aún después de la administración crónica. Disminuyen el tránsito intestinal por aumento del tono muscular desde el estómago hasta el colon, y disminuyen las secreciones estomacal, intestinal, pancreática y biliar. En relación con esto último, no se recomienda usar la morfina en casos de cólico biliar, pues el aumento del tono en el conducto biliar (el que comunica la vesícula biliar con el intestino) produce aumento de la presión dentro del canal, lo cual puede aumentar mucho el dolor cólico.
Otra de las acciones bien conocidas de los opioides es la de producir tolerancia (es decir, aumento de la dosis para obtener el mismo efecto), dependencia física y susceptibilidad al abuso. Esta tríada constituye parte del cuadro conocido como adicción, del cual hablaremos con más detalle posteriormente.
Entre los efectos indeseables de los opioides podemos incluir la depresión respiratoria, náusea, vómito, mareo, confusión mental, comezón, constipación, aumento de la presión del conducto biliar, retención urinaria y caída de la presión arterial.
También es necesario tener cuidado con las mujeres embarazadas en el momento del parto por el peligro de depresión respiratoria (el opioide puede llegar al feto, en el que produce efectos más prolongados que en la madre). También en los ancianos se observan efectos más duraderos que en sujetos jóvenes.
Las acciones farmacológicas que hemos descrito pueden alterarse por la presencia de enfermedades. Por ejemplo, dado que los opioides, al igual que la mayoría de las drogas se metabolizan en el hígado, es necesario tener cuidado en pacientes con daño hepático (hepatitis, cirrosis, etc.) en quienes los efectos serán más prolongados y potencialmente más tóxicos. Lo mismo ocurre en sujetos con limitaciones respiratorias como los fumadores crónicos o aquellos que padecen enfisema, en los que la depresión respiratoria producida por los opioides puede amplificarse.
Finalmente, recordemos que las mezclas de fármacos pueden ser peligrosas. En el caso de los opioides, los efectos depresores se pueden exagerar y prolongar con tranquilizantes (fenotiazinas) y agentes antidepresivos.
Los usos más frecuentes de los opioides son: como analgésicos (pero recuérdese que habitualmente, la aspirina es eficaz en un gran número de casos y hay dolores causados más que nada por ansiedad y tensión que no deben ser tratados con analgésicos narcóticos), antitusivos y drogas antidiarreicas. Se pueden también utilizar en analgesias o anestesias obstétricas o en pacientes con cáncer terminal.
Existen numerosos agentes sintéticos o semisintéticos en el mercado con efectos opioides. Uno de los más empleados es la meperidina (Demerol®), la cual actúa como la morfina misma, aunque con algunas diferencias importantes, como el cuadro de intoxicación, que a diferencia de la morfina, puede aparecer bajo la forma de excitación central, con temblores y hasta convulsiones. El principal uso de la meperidina es como analgésico, con la ventaja sobre la morfina que puede administrarse por vía oral.
Un derivado de la meperidina, el difenoxilato (Lomotil® y otros), se utiliza frecuentemente como antidiarreico, al igual que la loperamida (Imodium® y otros).
El fentanyl es un opioide sintético relacionado con la morfina, aunque es casi 80 veces más potente como analgésico. Se utiliza combinado con el droperidol, un tranquilizante mayor, para inducir anestesia. La metadona es otro agonista morfínico de tipo m(mu) con propiedades muy útiles, como eficacia analgésica (incluso administrada por vía oral), larga duración de acción para suprimir la aparición del síndrome de abstinencia en sujetos adictos (véase la Quinta Parte) y su tendencia a mostrar efectos persistentes después del uso repetido (la miosis y la depresión respiratoria se aprecian por más de 24 horas después de la administración de una dosis única). La metadona se usa primariamente como analgésico en el tratamiento del síndrome de abstinencia a opioides y en heroinómanos.
Otro derivado opioide usado como analgésico es el propoxifeno (Darvón® y otros), el cual es eficaz por vía oral y potencia sus efectos cuando se administra junto con aspirina.
Mencionemos, para terminar, que existen otros agentes opioides que tienen efectos mixtos, ya sea de agonista-antagonista (nalorfina, ciclazocina, etc.) o de agonista parcial (buprenorfina) y que son el resultado de los esfuerzos de químicos y farmacólogos que buscan producir un fármaco más eficaz y menos tóxico.
Finalmente, el grupo de antagonistas opioides merece una mención particular. Se trata de agentes que, en ausencia de narcóticos, no tienen ningún efecto. Sin embargo, en situaciones en las que el sistema de opioides endógenos se activa, como en los casos de dolor, ejercicio, choque o en algunos tipos de estrés, muestran efectos. En la medida que va descubriéndose la participación de endorfinas, encefalinas y dinorfinas en la fisiopatología de algunas alteraciones neurológicas, este grupo de fármacos va encontrando indicaciones de uso, además de su utilización para el estudio de las funciones posibles de los opioides endógenos en relación con el ejercicio (el placer que experimentan las personas que hacen ejercicio en forma regular estaría ligado a la secreción de estos agentes), al efecto placebo o a la acupuntura.
La naloxona es el antagonista prototipo y se utiliza sobre todo para revertir los efectos depresores de los opiáceos en anestesia y en el diagnóstico de adicción a opioides (la inyección de naloxona o nalorfina en sujetos dependientes a narcóticos induce el síndrome de abstinencia). El uso de antagonistas en casos de choque, enfermedad cerebrovascular o trauma neurológico está estudiándose actualmente.

![[Anteior]](../img/prevsec.gif)
![[Previo]](../img/parntsec.gif)
![[Siguiente]](../img/nextsec.gif)