IV. LA SOBREMESA
EN LA sobremesa hay fenómenos recurrentes: cuentos picantes y
amarillos, comentarios sobre la dieta que no se guardó, monólogos de política...,
el cafecito, el coñaquito, el cigarrito, etc. En este capítulo veremos someramente
algunos principios fisicoquímicos que quedan ilustrados en la sobremesa y que
están relacionados con otras experiencias cotidianas como el azul del cielo
y la cinta adhesiva.
Hoy día, cualquier persona preocupada por su salud sabe que una dieta completa implica cierto número de calorías. Esto es, debe haber un equilibrio entre la energía que proporcionan los alimentos y la que consume el organismo. Esta idea es, aunque no lo parezca, reciente, sobre todo si se considera que durante casi un millón de años no preocupó a la especie humana.
La mayoría de las pistas que llevaron a esclarecer la relación entre calor y movimiento viene de los estudios biológicos. Como veremos más adelante, Lavoisier ya había notado la relación entre el calor liberado y el bióxido de carbono producido por los animales.
En 1850, Justus von Liebig, en oposición a quienes afirmaban que la actividad
animal resulta de una "fuerza vital", 1 ![]() sostenía
que el calor y la actividad mecánica en los animales resulta de la combustión
del alimento.
sostenía
que el calor y la actividad mecánica en los animales resulta de la combustión
del alimento.
Y una contribución muy interesante es la de Julius Robert Mayer. A mediados del siglo pasado este cirujano se encontraba embarcado, navegando cerca de Java. Al operar a un nativo notó que su sangre venosa tenía un intenso color rojo. Como es sabido esta sangre es la que llega a los pulmones a oxigenarse. Mayer concluyó que en los trópicos la sangre venosa difiere poco en color de la arterial (cosa que no ocurre a grandes latitudes) porque no se requiere gran consumo de oxígeno para mantener la temperatura del organismo. Concluyó que el oxígeno mantenía las reacciones biológicas del organismo por... combustión.
Para medir la capacidad energética de los alimentos se emplean las kilocalorías (o calorías) y, más recientemente los kJ (kilojoules). Las Calorías, también llamadas calorías grandes por los biólogos, dan lugar a muchas confusiones pues no son iguales a las calorías. Las Calorías son 1 000 veces mayores que las calorías. En otras palabras, para los biólogos la Caloría es la cantidad de calor que eleva en 1°C la temperatura de 1 kg de agua. Para el resto de la humanidad la caloría es la cantidad de calor, que eleva 1°C la temperatura de 1 g de agua.
Señalamos ya que la idea de referirse a la capacidad energética de los alimentos
tiene origen relativamente reciente. Uno de los trabajos pioneros fue el de
Laplace y Lavoisier a fines del siglo XVIII. De éste hablaremos brevemente
a continuación. De 1782 a 1784 experimentaron acerca del fenómeno de la respiración.
Para ello desarrollaron un calorímetro de hielo a fin de medir el calor liberado
durante la respiración de un conejillo de Indias. Después de 10 horas de experimentación
encontraron que el conejillo, por su temperatura corporal, había logrado fundir
13 onzas de hielo. En el mismo tiempo el animal había producido cierta cantidad
de CO2 que midieron cuidadosamente
los experimentadores. Por otro lado quemaron cierta cantidad de carbón para
relacionar las cantidades de CO2
y de calor producidos. Nuevamente midieron el calor producido por la cantidad
de hielo fundido. Hallaron que la fusión de 10.5 onzas de hielo implicaba la
misma cantidad de CO2, fuera
producido por la combustión del carbón o por la respiración del conejillo de
Indias. ¿No era razonable pensar que la respiración es una forma de combustión?
Durante mucho tiempo se pensó que el hombre, como los animales, comía sólo para crecer y reconstruir sus tejidos, poco a poco se fue viendo que los alimentos proporcionan también calor y otras formas de energía necesarias para el organismo. A riesgo de sobresimplificar puede decirse que el cuerpo humano es una máquina química: el oxígeno respirado se combina con los azúcares, grasas y proteínas obtenidas por la digestión; estas moléculas complejas se transforman, en último término, en bióxido de carbono, agua y otros productos de desecho. En este proceso se origina calor y trabajo mecánico en los músculos.
Se ha medido con precisión la energía suministrada en forma de alimento (combustible)
y el correspondiente trabajo y calor que desarrolla el cuerpo a fin de comprobar
si los procesos vitales se pueden describir con los mismos principios de conservación
aplicados a los fenómenos de la naturaleza inanimada, véase la tabla II.3. Desde
1890 se dio respuesta afirmativa. El alimento diario, si se quema fuera del
organismo, proporciona casi 3 x 10 6
cal y la cantidad de calor que el cuerpo cede, el trabajo que realiza y la energía
de los productos de desecho son del mismo orden de magnitud2 ![]() (dentro
de un pequeño error experimental).
(dentro
de un pequeño error experimental).
Sin embargo, el cuerpo considerado como una máquina térmica tiene un rendimiento muy bajo, menor al 20%. Esto quiere decir que sólo el 20% de la energía calorífica puede transformarse en energía mecánica. Por eso al realizar trabajo físico el calor producido es muy grande, el organismo se calienta y, si la disipación de calor no se realiza eficientemente, comienza la sudoración a fin de recuperar la temperatura de 37°C.
En el capítulo I mencionamos que los alimentos contienen tres tipos principales
de sustancias: carbohidratos, grasas y proteínas. Para una nutrición balanceada
se requieren, además, cantidades pequeñas de vitaminas y minerales. Los carbohidratos
se convierten en glicógeno3 ![]() (almidón
animal) y energía. Durante la digestión las proteínas se rompen en aminoácidos
que el organismo reorganiza para construir sus tejidos, se queman para obtener
energía, se transforman en azúcares y contribuyen a la formación de grasa. Las
grasas también se descomponen para ser reconstituidas en productos químicos
importantes para el organismo; dan lugar a energía y nuevas grasas que se almacenan
en los tejidos. Si bien los valores energéticos de los alimentos, es decir las
Calorías, miden los requerimientos alimenticios, una buena nutrición implica
equilibrio entre carbohidratos, grasas, proteínas, vitaminas, etc.; y esto depende
de las necesidades de cada persona.
(almidón
animal) y energía. Durante la digestión las proteínas se rompen en aminoácidos
que el organismo reorganiza para construir sus tejidos, se queman para obtener
energía, se transforman en azúcares y contribuyen a la formación de grasa. Las
grasas también se descomponen para ser reconstituidas en productos químicos
importantes para el organismo; dan lugar a energía y nuevas grasas que se almacenan
en los tejidos. Si bien los valores energéticos de los alimentos, es decir las
Calorías, miden los requerimientos alimenticios, una buena nutrición implica
equilibrio entre carbohidratos, grasas, proteínas, vitaminas, etc.; y esto depende
de las necesidades de cada persona.
A continuación veremos los componentes de los alimentos desde el punto de vista energético.
Los carbohidratos son la principal fuente de energía en la dieta de casi todos los pueblos. En la forma de arroz, trigo, maíz, whiskey o cerveza, se presentan como azúcares o almidones (polisacáridos).
La glucosa, azúcar producido en los vegetales, produce 3.75 Cal/g cuando se quema totalmente a CO2 y H2O. En cambio los polisacáridos (almidones) contienen menos agua por molécula, de aquí que su combustión produce más energía, entre 3.95 y 4.18 Cal/g.
Con todo, las cifras anteriores son muy relativas. El aprovechamiento de esta
energía no es completo, el valor energético varía de un compuesto a otro y,
además, hay organismos con metabolismo tal que da lugar a enfermedades ante
el exceso de ciertos carbohidratos.4 ![]()
La falta de las enzimas invertasa, maltasa y lactasa en el organismo humano hace que la sacarosa, maltosa y lactosa no se hidrolicen formando monosacáridos (es decir, que no se digieran); al llegar al intestino grueso son atacados estos carbohidratos por microorganismos que los fermentan produciendo flatulencias.
El aprovechamiento de las proteínas está muy relacionado con la cantidad y
calidad de éstas. Un alimento puede muy bien tener los aminoácidos indispensables
para que el organismo sintetice las proteínas requeridas, sin embargo pueden
hallarse en una forma indisponible fisiológicamente. Este punto es de mucha
importancia pues está relacionado con la estructura de la proteína. Como ya
señalamos, las enzimas son muy específicas en su acción; si no encuentran los
enlaces adecuados para su acción... simplemente no actúan. El cocimiento, sea
por calor o por acción de ácidos5 ![]() de
los alimentos modifica la estructura de las proteínas (las desnaturaliza), con
lo que mejora su valor nutritivo y gastronómico.
de
los alimentos modifica la estructura de las proteínas (las desnaturaliza), con
lo que mejora su valor nutritivo y gastronómico.
Las grasas tienen mucha importancia en la dieta de la mujer y en la pupila
del hombre. La combustión de grasas produce cerca de 9 Cal/g y son los componentes
que más producen calorías. El organismo emplea las grasas para producir energía
en las mitocondrias6 ![]() de
las células. Las grasas o lípidos7
de
las células. Las grasas o lípidos7 ![]() dan
lugar; también, a dos compuestos muy importantes: el colesterol8
dan
lugar; también, a dos compuestos muy importantes: el colesterol8 ![]() y
el ergocalciferol.9
y
el ergocalciferol.9 ![]()
El tejido adiposo,10 ![]() formado
principalmente por grasas, sirve como amortiguador físico (entre otras placenteras
funciones) en el cuerpo humano; sirve también como aislante térmico y protección
de órganos como intestinos, hígado, etcétera.
formado
principalmente por grasas, sirve como amortiguador físico (entre otras placenteras
funciones) en el cuerpo humano; sirve también como aislante térmico y protección
de órganos como intestinos, hígado, etcétera.
Aunque los lípidos son necesarios tanto al hombre como a la mujer (y viceversa) el consumo excesivo produce problemas de salud como obesidad y enfermedades cardiovasculares.
Una de las tantas leyendas que narran el origen del café11 ![]() es la de Kaldi, un pastor de cabras que probó las bayas de un arbusto verde
con las que se alimentaban sus animales. La euforia que le produjeron las bayas
lo llevó a compartir su hallazgo por el año 850 d.C.
es la de Kaldi, un pastor de cabras que probó las bayas de un arbusto verde
con las que se alimentaban sus animales. La euforia que le produjeron las bayas
lo llevó a compartir su hallazgo por el año 850 d.C.
En 1650 ya había cafeterías en Londres y en 1689 en Nueva York, Boston. En México, Venezuela, etc., se establecieron cerca de 1750. Actualmente un tercio de la población mundial consume café más que cualquier otra bebida, gracias a la generosidad de Kaldi.
Independientemente del origen del café es indiscutible que su efecto estimulante ha ayudado a su popularidad.
Un factor clave en la calidad del café es el tostado. Éste hace que el grano aumente su volumen entre 30 y 100%. La razón es la misma que en las palomitas o rosetas de maíz, aunque en el caso del café es bastante menos aparatoso. El grano del maíz palomero tiene una cámara llena de celulosa casi pura (el copo de algodón es, también, casi pura celulosa). El aumento de la presión en la cámara por el aumento de temperatura hace que el maíz palomero explote y aflore la celulosa. En el caso del café el grano se esponja por la expansión del CO2 formado y de cambios químicos complejos que hacen que el café se oscurezca, tome aroma y pierda agua.
Los principales componentes del grano verde son proteínas, sacarosa y ácido
clorogénico,12
![]() casi
el 75% de los sólidos solubles. Al parecer, con el tostado se forman azúcares
que se deshidratan y polimerizan, se forman sustancias de gran masa molecular
solubles en agua y otras insolubles. Buena parte del color del café se debe
a los productos de degradación de la sacarosa.
casi
el 75% de los sólidos solubles. Al parecer, con el tostado se forman azúcares
que se deshidratan y polimerizan, se forman sustancias de gran masa molecular
solubles en agua y otras insolubles. Buena parte del color del café se debe
a los productos de degradación de la sacarosa.
Para preparar el café hay diferentes formas: desde el cómodo "Nescafé" hasta el express, pasando por el turco, irlandés, americano, de olla, etcétera.
Pero si alguien prefriere el café debe saber que el recién tostado y molido
pierde su frescura a los 4 días de exposición al aire; si no se guarda en recipientes
herméticos a los 15 días adquiere sabor rancio o estadizo.13 ![]() Con
todo, la rancidez no es debida a la oxidación de los aceites y grasas del café
sino exclusivamente de los componentes volátiles, es decir "el aroma".14
Con
todo, la rancidez no es debida a la oxidación de los aceites y grasas del café
sino exclusivamente de los componentes volátiles, es decir "el aroma".14 ![]() Sin
duda una de las cualidades más atractivas del café es su aroma. El agua caliente
libera con gran rapidez a los aceites esenciales que lo constituyen. Curiosamente
éstos no constituyen más del 1% en peso del café tostado. El sabor rancio depende
de la sensibilidad del degustante, del método empleado para hacer el café y
del tiempo de exposición del café al oxígeno. Puede influir también el tipo
de tostado y la mezcla de cafés empleada.
Sin
duda una de las cualidades más atractivas del café es su aroma. El agua caliente
libera con gran rapidez a los aceites esenciales que lo constituyen. Curiosamente
éstos no constituyen más del 1% en peso del café tostado. El sabor rancio depende
de la sensibilidad del degustante, del método empleado para hacer el café y
del tiempo de exposición del café al oxígeno. Puede influir también el tipo
de tostado y la mezcla de cafés empleada.
Los principales componentes del café verde solubles en agua son proteínas, sacarosa y ácido clorogénico, alrededor del 75% del total de sólidos solubles. Con la tostación desaparece casi toda la sacarosa. Se forman primero azúcares reductores que reaccionan rápidamente al inicio del tostado y lentamente al final. Los azúcares se deshidratan y polimerizan; se forman sustancias de alto peso molecular. Buena parte del color y sabor del café tostado se debe a los productos de la degradación de los azúcares. Se forman, además, bióxido de carbono y otras sustancias volátiles.
La cafeína es un alcaloide15 ![]() semejante
a la teobromina presente en el cacao, figura IV.1.
semejante
a la teobromina presente en el cacao, figura IV.1.
La cafeína se emplea en las bebidas de cola y en medicina como estimulante16
![]() y
diurético. Por lo anterior una taza de chocolate no propicia el sueño. Una taza
de café contiene cerca de 100 mg de cafeína. Sus propiedades estimulantes (mayor
asociación de ideas, más concentración, mejores reflejos, disminución de la
fatiga) sin duda han contribuido a su popularidad. Como era de imaginarse, la
cafeína se extrae del café o del té, que la contiene en mayor proporción.
y
diurético. Por lo anterior una taza de chocolate no propicia el sueño. Una taza
de café contiene cerca de 100 mg de cafeína. Sus propiedades estimulantes (mayor
asociación de ideas, más concentración, mejores reflejos, disminución de la
fatiga) sin duda han contribuido a su popularidad. Como era de imaginarse, la
cafeína se extrae del café o del té, que la contiene en mayor proporción.
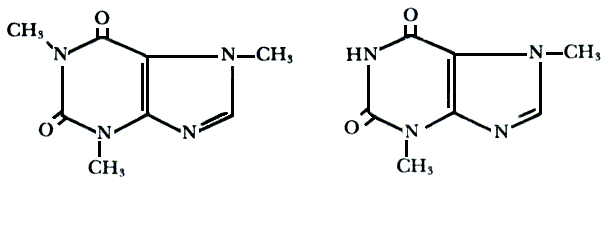
Figura IV. 1. Cafeína. Teobromina.
Básicamente son tres los métodos de preparación del café: infusión, lixiviación y decocción.
El café soluble se obtiene secando el extracto acuoso de café tostado y molido.
La mezcla, el tostado y la molienda se hacen de forma semejante en los dos tipos
de café más comunes: el café soluble y el café. En la elaboración del café soluble
se emplean temperaturas bajas para evitar la pérdida del aroma y del sabor;
igualmente se impide la presencia de aire a fin de evitar el enranciamiento.
El extracto concentrado del café se obtiene por un método muy semejante al del
café express, el agua caliente circula a presión por el café molido. Posteriormente
el extracto se seca por aspersión del líquido. Para ello pasa a través de unas
boquillas "atomizadoras"17 ![]() que
ponen a las partículas en contacto con aire caliente, a unos 250°C. La gran
superficie activa del extracto (véase en el capítulo II, "Cortar y picar....")
hace que el secado sea rápido y no se pierdan aroma ni sabor. En ocasiones se
emplea la liofilización (véase en el capítulo I, "Liofilización") para producir
el café soluble.
que
ponen a las partículas en contacto con aire caliente, a unos 250°C. La gran
superficie activa del extracto (véase en el capítulo II, "Cortar y picar....")
hace que el secado sea rápido y no se pierdan aroma ni sabor. En ocasiones se
emplea la liofilización (véase en el capítulo I, "Liofilización") para producir
el café soluble.
Aunque no se crea, el café descafeinado sí contiene café; se emplean diferentes
disolventes clorados para eliminar la cafeína del grano verde; uno de los más
empleados es el tricloroetileno.18 ![]() El
posterior secado y tostado garantiza totalmente la eliminación del disolvente
utilizado.
El
posterior secado y tostado garantiza totalmente la eliminación del disolvente
utilizado.
Cualquiera sabe que un buen café se toma sin azúcar; pero hay de gustos a gustos. Lo que es indiscutible es que por muy azucarado que a uno le guste el café hay un límite a la cantidad de azúcar disuelta en el café; a tales soluciones se les llama saturadas. Por más que se añada azúcar el café no se endulza más, el exceso queda en el fondo de la taza. Los químicos dicen que se tiene entonces una solución saturada. Sólo hace poco tiempo se llegó a la conclusión de que estas soluciones tienen un equilibrio dinámico, es decir la velocidad con que se disuelve el azúcar es igual a la velocidad con que se deposita.
No parece haber relación, pero una forma de mantener limpias las alfombras emplea la saturación... ¡de mugre! Véase el capítulo V.
Hay cristales moleculares, como el azúcar; que al ser triturados emiten luz
visible. A tal fenómeno se le conoce como triboluminiscencia.19![]()
Del mismo género es la luminosidad azul que se produce al separar la cinta adhesiva (masking tape, o cinta "Scotch"). En ambos casos las cargas eléctricas se producen por la separación de las superficies. La emisión de luz ocurre por la descarga, sea directamente por fragmentos moleculares, sea por excitación de los gases atmosféricos en la vecindad de las superficies separadas. El resplandor azul obtenido al desenrollar las cintas adhesivas se debe a la excitación producida por las descargas eléctricas en las moléculas de nitrógeno del aire.
Cabe mencionar que el fenómeno de la adherencia aún no está bien entendido:
existen fuerzas químicas, quizá semejantes a las que mantienen juntas las partículas
de un mismo trozo de material. Puesto que la adherencia requiere primero el
mojado de las superficies, se ha pensado que éste es un requisito para el contacto
a escala molecular. Los enlaces que intervienen en los pegamentos son resultado
de las fuerzas de Van der Waals, y están relacionados con la distribución desigual
de electrones en las moléculas. La sagaz lectora (o sagaz lector) habrá notado
que en una misma molécula se tendrá una zona con carga positiva y otra con carga
eléctrica negativa. A tales moléculas se les llama polares20 ![]() y
un ejemplo cotidiano de éstas es... el agua, véase el en el capítulo III, "Soluciones,
suspensiones, etc".
y
un ejemplo cotidiano de éstas es... el agua, véase el en el capítulo III, "Soluciones,
suspensiones, etc".
Un criterio para clasificar a las bebidas espirituosas es el de si resultan o no de la destilación. Entre los bebestibles destilados se hallan los licores, coñac, tequila, brandy, mezcal, aguardiente, sotol, etc.; entre los no destilados: la cerveza, tejuino, pulque, vino, champaña, sidra, etc. etc. etcétera.
Los licores no son sólo bebidas fermentadas. Han tenido, como indicamos, un proceso adicional: la destilación. Con ello aumenta el contenido de alcohol de la bebida.
Es sabido que los líquidos tienden a evaporarse. Si existe humedad en el ambiente
la tendencia del agua a evaporarse se ve compensada por la del vapor a condensarse
y se alcanza equilibrio. Esto, en términos más precisos, se dice: la presión
de vapor del líquido es igual a la presión parcial del agua en el gas. El alcohol,
como sabe cualquier bebedor; comparte esta tendencia a desaparecer de los vasos.
Y tiene una tendencia a desaparecer mayor que el agua. Así el vapor en equilibrio
con una solución alcohol-agua es más rico en alcohol. Si este vapor se transforma
en líquido se tendrá, obviamente, mayor concentración de alcohol que en el líquido
original. Y si el vapor de este nuevo líquido se condensa... ¡ya imaginará el
antojadizo lector el resultado! ¡Se obtendría alcohol puro!... Mas no; la naturaleza
dispuso las cosas de otra manera. La destilación,21 ![]() que tal es el nombre para este procedimiento, tiene en este caso un límite.
Hay un momento en que el vapor tiene la misma composición que el líquido del
cual procede. Es obvio que aquí se detiene la separación del elíxir y el agua
(al menos en lo que a destilación se refiere). Esto ocurre cuando el alcohol
es de 96°G.L., que es la pureza usual del alcohol medicinal. Éste, como
es sabido, no es potable (a no ser que haya una gran persistencia) debido a
los desnaturalizantes añadidos por razones tributarias. A fin de mantener bajo
el precio al público del alcohol medicinal y evitar que éste lo ingiera se agregan
sustancias eméticas, malolientes y repugnantes. En las bebidas espirituosas
el alcohol no tiene desnaturalizantes (aunque al día siguiente uno lo dude)
pero tiene una buena carga de impuestos fiscales, véase "¡La cerveza!" en el
capítulo I.
que tal es el nombre para este procedimiento, tiene en este caso un límite.
Hay un momento en que el vapor tiene la misma composición que el líquido del
cual procede. Es obvio que aquí se detiene la separación del elíxir y el agua
(al menos en lo que a destilación se refiere). Esto ocurre cuando el alcohol
es de 96°G.L., que es la pureza usual del alcohol medicinal. Éste, como
es sabido, no es potable (a no ser que haya una gran persistencia) debido a
los desnaturalizantes añadidos por razones tributarias. A fin de mantener bajo
el precio al público del alcohol medicinal y evitar que éste lo ingiera se agregan
sustancias eméticas, malolientes y repugnantes. En las bebidas espirituosas
el alcohol no tiene desnaturalizantes (aunque al día siguiente uno lo dude)
pero tiene una buena carga de impuestos fiscales, véase "¡La cerveza!" en el
capítulo I.
Los alquimistas, aunque contribuyeron poco al desarrollo de la química como
ciencia, fueron muy creativos en cuanto a métodos de purificación y extracción.
Los alambiques,22 ![]() figura
IV.2, el baño María, la piedra de toque,23
figura
IV.2, el baño María, la piedra de toque,23 ![]() son
recursos desarrollados por estos tatarabuelos de la química contemporánea.
son
recursos desarrollados por estos tatarabuelos de la química contemporánea.
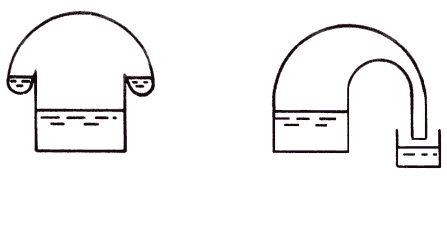
Figura IV. 2. Diversos tipos de alambiques.
La destilación tuvo una importancia capital, no sólo por los benéficos efectos
de sus productos, sino porque liberaba la "esencia" de las sustancias. En efecto,
el destilado del vino tenía "quintaesenciadas"24 ![]() sus
características vivificantes, de aquí que se le llamara en algunas partes aqua
vitae, esto es, "agua de la vida".25
sus
características vivificantes, de aquí que se le llamara en algunas partes aqua
vitae, esto es, "agua de la vida".25 ![]() Ahora
bien, la diferencia entre las presiones de vapor de los líquidos alcohol-agua
es la base de la producción de licores, brandy, tequila, mezcal, etc., esto
es, de la destilación. Puesto que el vapor es más rico en alcohol cuanto más
rico lo sea el líquido, los artesanos llegaron a un descubrimiento extraordinario.
Si se regresa un poco del condensado al líquido que destila ¡el nuevo vapor
es aún más rico en alcohol!
Ahora
bien, la diferencia entre las presiones de vapor de los líquidos alcohol-agua
es la base de la producción de licores, brandy, tequila, mezcal, etc., esto
es, de la destilación. Puesto que el vapor es más rico en alcohol cuanto más
rico lo sea el líquido, los artesanos llegaron a un descubrimiento extraordinario.
Si se regresa un poco del condensado al líquido que destila ¡el nuevo vapor
es aún más rico en alcohol!
El filántropo José Luis Gay-Lussac, a inicios del siglo pasado, encontró una manera de garantizar la calidad del bebestible que nos ocupa. Son los conocidos grados G. L. que ostentan las botellas de bebidas espirituosas. Estos hacen referencia al porcentaje en volumen de alcohol. Los brandies tienen cerca de 50°G. L. lo que significa que 10 cm3 de "Fundador" contienen 5 de alcohol. El "Madeira" llega a los 80°G. L. La cerveza, bebida de moderación, está entre 4 y 12°G. L. En Gran Bretaña y Estados Unidos el contenido alcohólico no se denota en grados G. L. sino en grados proof. En este país se definen de la siguiente manera:
Se entenderá por espíritu proof el licor alcohólico que contiene la mitad de su volumen de alcohol cuyo peso específico es 0.7939 a 60° Fahrenheit.
Tan clara como cualquier definición oficial la anterior se traduce a: "los grados proof son el doble de los grados G.L." En otras palabras, 100 cm3 de brandy de l00° proof tienen 50° G.L. y 50 cm3 de alcohol puro.
En Inglaterra los grados proof tienen, como todo, otra definición:
Un espíritu proof tiene una fuerza (concentración de alcohol) tal que, a 51° F (11°C) su peso es 12/ l3 de un volumen igual de agua.
Puesto que la graduación Gay-Lussac y la proof norteamericana se basan en volúmenes en tanto que la inglesa en pesos, no hay una correspondencia simple entre las dos primeras y la británica. La tabla IV. 1 muestra las equivalencias.
|
Tabla IV.1. Graduaciones alcohólicas más comunes.
|
||
|
|
||
|
°G.L.
|
proof E.U.A.
|
proof G.B.
|
|
|
||
|
0
|
0
|
100.00 u.p.
|
|
10
|
20
|
83.50 u.p.
|
|
20
|
40
|
16.27 u.p.
|
|
30
|
60
|
48.00 u.p.
|
|
40
|
80
|
30.60 u.p.
|
|
50
|
100
|
12.9 u.p.
|
|
60
|
120
|
4.80 o.p.
|
|
70
|
140
|
22.30 o.p.
|
|
80
|
160
|
39.90 o.p.
|
|
90
|
180
|
57.30 o.p.
|
|
100
|
200
|
76.00 o.p.
|
|
u.p. underproof
|
o.p. overproof
|
|
|
|
||
La destilación comercial del brandy comenzó en el siglo XVI. Según cuentan, un marino holandés intentó concentrar el vino por destilación a fin de facilitar su transporte. La intención era diluir posteriormente el destilado, pero la gran aceptación que tuvo el nuevo producto lo hizo innecesario.
La tabla IV.2 muestra algunos brandies típicos, su origen y región. El ingenio humano ha mostrado al respecto una creatividad que hace sumamente limitada y fragmentaria esta tabla.
EL HUMO DE LOS CIGARROS Y EL COLOR DEL CIELO
Una de las formas de afinar una guitarra es aprovechar el fenómeno acústico de resonancia. Si dos cuerdas están afinadas al pulsar una nota en una cuerda la otra entrará en vibración. Los átomos y las moléculas se comportan en forma semejante a las cuerdas de la guitarra, reemiten las ondas de energía que están en resonancia con esas partículas. Y ocurre también como con las cuerdas de la guitarra: en tanto más corta la cuerda mayor la frecuencia y en tanto más pequeña la partícula más alta la frecuencia de resonancia. Así las moléculas de nitrógeno y oxígeno, principales componentes de la atmósfera, reemiten en todas direcciones la luz de frecuencia alta. El color azul corresponde a las frecuencias altas y el rojo a las bajas, de aquí que el cielo sea azul a mediodía pero, al atardecer rojizo (la luz atraviesa una mayor distancia de la capa de polvo cercana a la superficie terrestre).
|
|
|||||
| Cognac | Uva | Francia | |||
| Ouzo | Anís | Grecia | |||
| Pisco | Uva moscatel | Perú | |||
| Tequila | Agave azul | México, Japón | |||
| Aguardiente | Caña | Latinoamérica | |||
| Grappa | Orujo de uva | Italia, Francia | |||
| Calvados | Manzana, pera | Francia | |||
| Whisky | Granos | Inglaterra, Japón | |||
| Ron | Caña | Latinoamérica | |||
| Vodka | Papa | Rusia | |||
| Ginebra | Centeno, enebro | Inglaterra | |||
|
|
|||||
En las nubes las moléculas de agua se hallan en grupos de muy diversos tamaños, cada uno con su propia frecuencia de resonancia y, por consiguiente, de reemisión de luz. El resultado global es una nube blanca.
El fumador observador habrá notado que el humo que sale del cigarrillo es azul,
pero el que sale de sus pulmones es blanco; éste consiste de partículas recubiertas
de humedad.