V. LEVANTANDO EL TIRADERO
COMO todo lo bueno en la vida termina, así ocurre con las comidas.
Y empieza el nunca acabar de lavar platos, vasos, sartenes, ceniceros... y las
frecuentes molestias de los excesos en comer, beber y fumar. Algunos principios
fisicoquímicos de esta inevitable y cotidiana etapa de la existencia (con su
ventura y desventura) son el material de este último capítulo.
El jabón1 ![]() se
conoce desde hace más de 2 000 años. Uno de los procedimientos más antiguos
de elaboración (empleado por celtas, fenicios, romanos, etc ) consiste en mezclar
grasa animal con cenizas. Curiosamente no fue sino hasta el siglo II de nuestra
era que comenzó a emplearse como jabón, esto es, para lavar. Antes se empleaba
como bálsamo y ungüento por fines medicinales exclusivamente.
se
conoce desde hace más de 2 000 años. Uno de los procedimientos más antiguos
de elaboración (empleado por celtas, fenicios, romanos, etc ) consiste en mezclar
grasa animal con cenizas. Curiosamente no fue sino hasta el siglo II de nuestra
era que comenzó a emplearse como jabón, esto es, para lavar. Antes se empleaba
como bálsamo y ungüento por fines medicinales exclusivamente.
La forma primitiva de fabricar jabón es relativamente simple: las cenizas de
plantas (que contienen carbonato de potasio) se dispersan en agua y se añade
el sebo o grasa (generalmente de animal). La mezcla se lleva a ebullición y
se añaden más cenizas a medida que el agua se evapora. En este proceso ocurre
la reacción química entre los ácidos grasos y los carbonatos alcalinos2 ![]() para
formar jabón en un proceso redundantemente llamado saponificación.3
para
formar jabón en un proceso redundantemente llamado saponificación.3![]()
Los detergentes tienen un origen mucho más reciente. Con el fin de conservar las grasas animales para otros usos durante la primera Guerra Mundial, los alemanes emplearon compuestos químicos para fabricar el "Nekal", el primer detergente utilizado en la industria textil. Este detergente no tenía una gran capacidad limpiadora porque, como veremos más adelante, empleaba compuestos liposolubles de cadena corta. A fines de la segunda Guerra ya se vendían en Estados Unidos detergentes con mejores propiedades por tener cadena larga.
Aunque los detergentes se desarrollaron con la primera intención de emplear las grasas animales en otros usos que no fueran la producción de jabón (como la fabricación de margarina, véase el capítulo I), se logró un producto superior al jabón en muchos aspectos, sobre todo cuando se emplean en el lavado las llamadas aguas duras.
Cuando el agua empleada en el lavado tiene alta concentración de iones Ca++
y Mg++ (alrededor de 400 partes por
millón)4 ![]() el
jabón pierde su poder limpiador debido a la formación de compuestos insolubles;
en el agua de lavado se forman grumos y sedimentos.5
el
jabón pierde su poder limpiador debido a la formación de compuestos insolubles;
en el agua de lavado se forman grumos y sedimentos.5 ![]() Los
iones Ca++ y Mg++
reaccionan con la cabeza polar de la molécula del jabón impidiendo la formación
de la emulsión con la grasa. A menos que se use una gran cantidad de jabón la
limpieza es imposible.
Los
iones Ca++ y Mg++
reaccionan con la cabeza polar de la molécula del jabón impidiendo la formación
de la emulsión con la grasa. A menos que se use una gran cantidad de jabón la
limpieza es imposible.
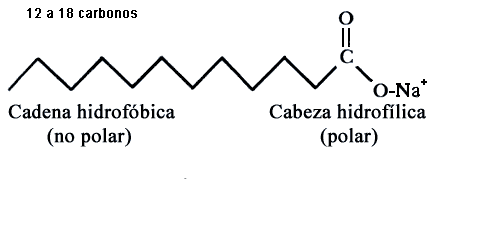
Figura V. 1. Estearato de sodio, jabón común.
La dificultad de producir espuma no es exclusiva de los jabones, se presenta
también en los detergentes6 ![]() aunque
en menor grado. Si bien suele asociarse la capacidad de lavado con la cantidad
de espuma de un jabón, la acción limpiadora de los detergentes y jabones resulta
de una gran cantidad de factores: la composición de la mugre, la composición
del jabón, la temperatura, las características del objeto por limpiar, la agitación
de la emulsión, el frotamiento, la duración del lavado, número y secuencia de
enjuagues, etc., etc. Sin embargo puede tenerse una idea simplificada considerando
que la capacidad que tienen los jabones de limpiar las grasas y el aceite de
las superficies sucias es resultado de la estructura hidrófoba-hidrófila7
aunque
en menor grado. Si bien suele asociarse la capacidad de lavado con la cantidad
de espuma de un jabón, la acción limpiadora de los detergentes y jabones resulta
de una gran cantidad de factores: la composición de la mugre, la composición
del jabón, la temperatura, las características del objeto por limpiar, la agitación
de la emulsión, el frotamiento, la duración del lavado, número y secuencia de
enjuagues, etc., etc. Sin embargo puede tenerse una idea simplificada considerando
que la capacidad que tienen los jabones de limpiar las grasas y el aceite de
las superficies sucias es resultado de la estructura hidrófoba-hidrófila7 ![]() Por
ejemplo, el ion estearato (del estearato de sodio del jabón común) consta de
una larga cadena de un hidrocarburo no polar con un grupo -COO
altamente polar en un extremo, figura V.1.
Por
ejemplo, el ion estearato (del estearato de sodio del jabón común) consta de
una larga cadena de un hidrocarburo no polar con un grupo -COO
altamente polar en un extremo, figura V.1.
Por su carácter hidrofóbico, las colas de estas moléculas se agrupan en la superficie del líquido, y se disuelven en el aceite o grasa de la ropa sucia o de los alimentos. Las cabezas hidrofílicas en cambio hacen contacto con el agua, pero como están cargadas negativamente se repelen impidiendo que las gotas de grasa se junten nuevamente. En otros términos se produce la emulsificación de la suciedad, figura V2.
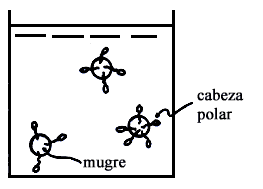
Figura V.2. Emulsificación de suciedad.
La suciedad puede estar fijada al objeto de muy diversas maneras. Puede estar adherida a la pieza por lavar, atrapada mecánicamente, unida al objeto por una capa aceitosa, etc. Las fuerzas de adherencia (conocidas como fuerzas de Van der Waals) son mayores cuando se trata de suciedad líquida. Puede haber también fuerzas electrostáticas, importantes en el caso de suciedad sólida. Con todo, la distinción anterior carece de aplicación en la vida diaria pues la mayor parte de la mugre es grasienta o cerosa.
Los detergentes tales como los alquilbencenosulfonatos (ABS) y los alquilbencenosulfonatos lineales (ASL) (usados en champúes) tienen estructuras moleculares semejantes al estearato de sodio, el jabón común. Sin embargo la cabeza polar de los detergentes es menos reactiva que la de los jabones (nótese la diferencia en las figuras V.3 y VI) razón por la cual los detergentes hacen espuma con mayor facilidad que los jabones.
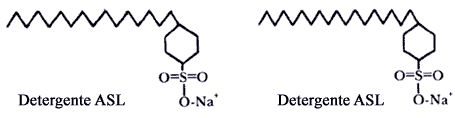
Figura V. 3. Detergentes A B S y A S L
La sal métálica de un ácido graso de cadena larga es un jabón. El ejemplo más
común es el estearato de sodio C17H35COO-Na+.
A bajas concentraciones la solución de estearato de sodio consiste de iones
individuales dispersos en la solución. Pero a altas concentraciones los iones
estearato forman grupos llamados micelas8 ![]() conteniendo
de unos cuantos a cientos de iones estearato. La micela es casi esférica y las
cadenas de hidrocarburo se hallan en el interior dejando los grupos polares
-COO- en la superficie en contacto con
el agua. Es del tamaño de una partícula coloidal y, al incorporar moléculas
de hidrocarburo en su interior; actúa como disolvente de material orgánico:
grasas, aceites, etc. La acción limpiadora del jabón depende en gran medida
de su capacidad de mantener la grasa en suspensión.
conteniendo
de unos cuantos a cientos de iones estearato. La micela es casi esférica y las
cadenas de hidrocarburo se hallan en el interior dejando los grupos polares
-COO- en la superficie en contacto con
el agua. Es del tamaño de una partícula coloidal y, al incorporar moléculas
de hidrocarburo en su interior; actúa como disolvente de material orgánico:
grasas, aceites, etc. La acción limpiadora del jabón depende en gran medida
de su capacidad de mantener la grasa en suspensión.
Si las partículas de suciedad no se mantienen dispersas de una forma estable
en el sistema detergente-mugre tienden a "flocular"9 ![]() en
agregados suficientemente grandes como para depositarse nuevamente en la superficie
por limpiar.
en
agregados suficientemente grandes como para depositarse nuevamente en la superficie
por limpiar.
Las partículas formadas por la disolución de un jabón o detergente tienen carga
eléctrica y, dependiendo de la naturaleza (o ausencia) de carga, se clasifican
como aniónicos, catiónicos, neutros o anfotéricos. Un detergente aniónico10 ![]() típico es el alquil sulfonato de sodio (ROSO3-Na+)
que, por supuesto, produce partículas coloidales cargadas negativamente. Para
una buena acción detergente, R debe tener al menos 16 átomos de carbono.
Un defecto indeseable de estos detergentes es la persistencia de su espuma,
pasa a través del drenaje llegando a los ríos y el mar agravando los problemas
de contaminación. La espuma impide la degradación biológica de los desechos
orgánicos del drenaje y causa problemas en las plantas de tratamiento de aguas
y en las zonas de riego. A partir de 1960, con la intención de que las bacterias
puedan atacar a estos detergentes (esto es, hacerlos biodegradables) se emplea
en la molécula una cadena ramificada en lugar de la lineal.
típico es el alquil sulfonato de sodio (ROSO3-Na+)
que, por supuesto, produce partículas coloidales cargadas negativamente. Para
una buena acción detergente, R debe tener al menos 16 átomos de carbono.
Un defecto indeseable de estos detergentes es la persistencia de su espuma,
pasa a través del drenaje llegando a los ríos y el mar agravando los problemas
de contaminación. La espuma impide la degradación biológica de los desechos
orgánicos del drenaje y causa problemas en las plantas de tratamiento de aguas
y en las zonas de riego. A partir de 1960, con la intención de que las bacterias
puedan atacar a estos detergentes (esto es, hacerlos biodegradables) se emplea
en la molécula una cadena ramificada en lugar de la lineal.
Los detergentes catiónicos11![]() son usualmente sales cuaternarias de sales de amonio en las cuales un grupo
alquilo es una cadena larga; el (CH3)3RN+
Cl- es un ejemplo típico con R entre 12 y 18 átomos
de carbono. En el mercado se venden en forma de polvo, pasta o líquido. Tienen
excelentes propiedades emulsificantes y espumantes... pero no son buenos limpiadores.
Su principal aplicación es... ¡el asfaltado! La emulsión detergente-asfalto
facilita la aplicación y se rompe al depositarse sobre los silicatos del terreno
pues éstos absorben al detergente. Muy por otro lado, los cirujanos los emplean
para lavarse las manos (no como Pilatos) por sus propiedades germicidas.
son usualmente sales cuaternarias de sales de amonio en las cuales un grupo
alquilo es una cadena larga; el (CH3)3RN+
Cl- es un ejemplo típico con R entre 12 y 18 átomos
de carbono. En el mercado se venden en forma de polvo, pasta o líquido. Tienen
excelentes propiedades emulsificantes y espumantes... pero no son buenos limpiadores.
Su principal aplicación es... ¡el asfaltado! La emulsión detergente-asfalto
facilita la aplicación y se rompe al depositarse sobre los silicatos del terreno
pues éstos absorben al detergente. Muy por otro lado, los cirujanos los emplean
para lavarse las manos (no como Pilatos) por sus propiedades germicidas.
Los no-iónicos dan lugar, como sospechará el lector; a partículas coloidales neutras. Se emplean donde el usuario espera una abundante espuma (por lo que ya mencionamos: se asocia el poder limpiador a la cantidad de espuma), por ejemplo champúes, detergentes para ropa fina, etcétera.
Los anfotéricos12 ![]() actúan
como aniónicos o catiónicos dependiendo del pH de la solución. Se emplean
mucho en cosméticos, champúes y en la industria electroquímica para limpiar
superficies por recubrir.
actúan
como aniónicos o catiónicos dependiendo del pH de la solución. Se emplean
mucho en cosméticos, champúes y en la industria electroquímica para limpiar
superficies por recubrir.
A grandes rasgos los componentes de un detergente comercial son los siguientes:
1) Agentes surfactantes (los mencionados anteriormente, alquil sulfonato, sulfonato de alquilbenceno) que sacan la suciedad.
2) Agentes ablandadores del agua (polifosfatos de sodio o potasio, silicatos de sodio) y alcalinizantes. Las sales de Ca y Mg aumentan el redepósito de la mugre.
3) Agentes tensoactivos, facilitan la penetración del detergente en la suciedad.
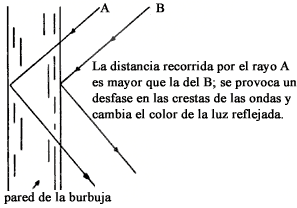
Figura V. 4. Fenómeno de interferencia.
4) Aditivos coloidales, evitan que la mugre separada se vuelva a depositar (carboximetilcelulosa).
5) Agentes auxiliares, evitan que el detergente se apelmace (sulfato de sodio).
6) Sustancias odorizantes, colorantes y germicidas.
7) Sustancias fluorescentes. Éstas hacen a los objetos lavados más brillantes (no más limpios) pues devuelven la luz ultravioleta (invisible al ojo humano) como luz azul visible. Los compuestos empleados como abrillantadores son un secreto comercial. Tienen propiedades opuestas a la mugre: deben permanecer en la tela gracias al detergente incluso después del enjuagado.
Al inicio de este parágrafo mencionamos que la temperatura es un factor que interviene en el poder detergente de los detergentes. No es difícil entender que para lavar platos se use agua caliente.
Las burbujas de jabón, como las plumas de ciertas aves, la superficie de los discos compactos, el interior de las conchas de abulón, el aceite derramado sobre agua en las gasolinerías, etc., producen muy bonitos efectos de colores. Esta iridiscencia resulta de que, en una película delgada como una burbuja de jabón, la luz que se refleja en una superficie puede interferir con la reflejada en la otra, figura V.4.
Si una burbuja de jabón se ilumina con luz blanca y el espesor es tal que se
anula la luz azul, la burbuja se ve con el color complementario13 ![]() correspondiente:
amarillo. En la parte más gruesa de la burbuja, la parte inferior; se cancela
el verde y la burbuja se ve púrpura. Si la burbuja es de gran tamaño se producen
corrientes de líquido y el espesor cambia, de aquí que también cambian sus colores,
figura V.5.
correspondiente:
amarillo. En la parte más gruesa de la burbuja, la parte inferior; se cancela
el verde y la burbuja se ve púrpura. Si la burbuja es de gran tamaño se producen
corrientes de líquido y el espesor cambia, de aquí que también cambian sus colores,
figura V.5.

El nacarado que se ve en algunos caracoles es, en principio, el mismo fenómeno. Los colores iridiscentes resultan de la interferencia de la luz por diferentes capas transparentes. También en los platos que no están bien enjuagados puede verse cierto nácar debido a la delgada película de detergente que se ha formado.
El resultado de la suma de colores en la luz es muy diferente a la suma de colores en los pigmentos. Éstos contienen partículas muy finamente divididas que reflejan luz en un gran intervalo de frecuencias. Así al mezclar pintura azul con amarilla se obtiene pintura verde (cuando se trata de luz se obtiene ¡blanco!). La pintura azul refleja además de la obvia azul, la de los colores vecinos: verde y violeta. La amarilla refleja, además de la amarilla, la naranja y la verde. Cuando se mezclan pinturas azul y amarilla se absorben: amarillo y naranja (por la azul) y azul y violeta (por la amarilla), sólo se refleja la luz verde.
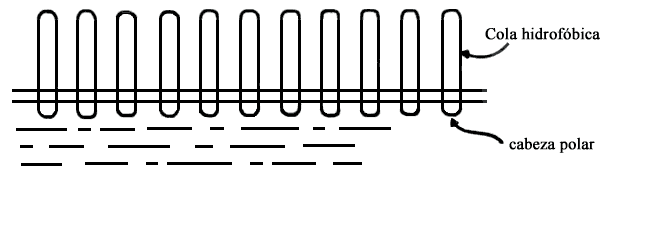
Figura V. 6. Alineamiento de las moléculas de jabón.
Como ya mencionamos, las moléculas de jabón y las de detergente están formadas por una larga cadena no polar unida a un extremo altamente polar. Cuando estas moléculas se encuentran en agua, una sustancia polar, emigran a la superficie y se orientan de forma que su parte no polar apunta al exterior; figura V.6. De esta manera la superficie del agua queda cubierta con una capa no polar, lo cual disminuye su tensión superficial y aumenta sus propiedades elásticas. En el caso de las burbujas de jabón el agua fluye hacia la parte inferior; lo que modifica el espesor de la película produciéndose, como indicamos arriba, diferentes colores por interferencia. Cuando la película se ha adelgazado mucho no soporta la presión interna del gas y la burbuja revienta.
Es interesante anotar que uno de los primeros procedimientos (desarrollado por lord Kelvin) para estimar el tamaño de las moléculas empleaba burbujas de jabón. Consideró que las burbujas, justo antes de reventar; estaban formadas por una capa monomolecular de donde concluyó que su diámetro era del orden de 0.5 angstroms, es decir, 0.000 000 005 mm.
Volviendo a la mugre, podemos afirmar que los mecanismos de retención de suciedad mencionados anteriormente operan en casi todos los materiales. En las alfombras, sin embargo, hay un agravante adicional: para facilitar la fabricación del respaldo de las alfombras se emplean fibras lubricadas, lo que aumenta la retención de polvo por el tejido.
Una alfombra, a diferencia de los niños, retiene cierta cantidad máxima de mugre; cuando está saturada, la suciedad posterior tiene poca adherencia. De aquí que uno de los métodos de acabado de alfombras que más éxito ha tenido es el de aplicar "suciedad" blanca finamente pulverizada; ésta es invisible y evita la acumulación de nueva suciedad. Para esto se emplean acabados pulverulentos de sílice y arcilla coloidales y algunos acabados resinosos (aminoplásticos).
Generalmente el lavado de platos se hace a mano. Los detergentes para este uso son diferentes de los usados para telas (no hay riesgo de daño de tejidos o decoloración) por lo que contienen gran cantidad de algún detergente orgánico y un ablandador del agua, generalmente trifosfato de sodio. No llevan silicatos ni ortofosfatos por diferentes razones: más costosos, requieren más ablandadores, para ser eficaces, son demasiado alcalinos, etcétera.
Aunque es común pensar que a más espuma más limpieza, en lo que se refiere a las máquinas lavaplatos (y las lavadoras de ropa), deben usarse jabones bajos de espuma; ésta impide el buen funcionamiento de las bombas y la aspersión del detergente por el rehilete también se ve perjudicada.
Puesto que los detergentes mencionados deben facilitar el escurrimiento del
agua para el enjuague suelen emplearse surfactantes14 ![]() (polioxietilenos
no iónicos, polímeros no iónicos de la serie plurónica,15
(polioxietilenos
no iónicos, polímeros no iónicos de la serie plurónica,15 ![]() etc.).
Los surfactantes también influyen en la calidad del lavado pues permiten escurrir
fácilmente el agua para el secado por calor que en la máquina lavaplatos es
de unos 6O°C. Para quitar la dureza del agua se emplean carbonato sódico
anhidro y sesquicarbonato de sodio (que también tiene propiedades detergentes).
Para quitar la suciedad se usan ortofosfato y metasilicato de sodio.
etc.).
Los surfactantes también influyen en la calidad del lavado pues permiten escurrir
fácilmente el agua para el secado por calor que en la máquina lavaplatos es
de unos 6O°C. Para quitar la dureza del agua se emplean carbonato sódico
anhidro y sesquicarbonato de sodio (que también tiene propiedades detergentes).
Para quitar la suciedad se usan ortofosfato y metasilicato de sodio.
Todavía se encuentran en etapa experimental las máquinas lavadoras sónicas y ultrasónicas (sólo se emplean en algunos laboratorios y en las ópticas). Estas vibraciones son un medio muy eficaz para introducir energía mecánica en un sistema ropa-mugre con lo que se logran resultados espectaculares por la velocidad y perfección del lavado.
El lavado de vasos es más difícil que el de platos no sólo por su fragilidad sino porque, de estar mal enjuagados, la película residual es fácilmente visible. En los platos mal enjuagados, inclinándolos convenientemente, puede verse una superficie irisada debida a la dificción de la luz, véase el capítulo IV.
Los limpiadores de vidrio emplean un secuestrante16 ![]() (gluconato
de sodio, por ejemplo) que evita la formación de costras o películas debidas
a la dureza del agua. Una solución diluida de amoniaco también funciona; aunque
el olor no es agradable tiene la ventaja de desaparecer al poco tiempo dejando
los objetos de vidrio muy brillantes.
(gluconato
de sodio, por ejemplo) que evita la formación de costras o películas debidas
a la dureza del agua. Una solución diluida de amoniaco también funciona; aunque
el olor no es agradable tiene la ventaja de desaparecer al poco tiempo dejando
los objetos de vidrio muy brillantes.
Y, a propósito de olores, un remedio casero para eliminar efluvios desagradables
es pasar un carbón encendido. De hecho, un trozo de carbón apagado es igualmente
efectivo. Este fenómeno, conocido como "adsorción" tiene que ver con la fuerzas
de Van der Waals mencionadas en el capítulo IV al tratar de la triboluminiscencia.
La adsorción es rápida si los poros son lo suficientemente pequeños como para
aumentar la superficie activa17 ![]() y
lo suficientemente grandes como para permitir la difusión del gas dentro del
carbón. La diferencia sutil para los químicos entre la adsorción y la
absorción es la siguiente: la adsorción se refiere a captación de gas
por un sólido; el término absorción se refiere a la captación de un gas por
un líquido; una disolución como la del CO2
en la "Coca-Cola".
y
lo suficientemente grandes como para permitir la difusión del gas dentro del
carbón. La diferencia sutil para los químicos entre la adsorción y la
absorción es la siguiente: la adsorción se refiere a captación de gas
por un sólido; el término absorción se refiere a la captación de un gas por
un líquido; una disolución como la del CO2
en la "Coca-Cola".
La adsorción se caracteriza, además, por su reversibilidad: el bicarbonato de sodio empleado en el refrigerador puede reactivarse: basta ponerlo en el horno para eliminar los gases responsables de los malos olores.
El "Teflón" es una resina plástica de tetrafluoretileno obtenida por la polimerización del gas tetrafluoretileno CF2 CF2. Se compone de largas moléculas de cadena recta que forman agregados densos. Los artículos hechos con esta resina son blancos y tenaces; al tacto se sienten resbalosos, soportan altas temperaturas y se pueden maquinar fácilmente.
La naturaleza del enlace C-F da a esta sustancia gran resistencia a los agentes químicos, al fuego y a los agentes atmosféricos.
Los compuestos de carbono completamente fluorados se comenzaron a preparar en 1935. En 1943 una planta piloto en Estados Unidos produjo esta resina para usos militares (nada menos que para la purificación del uranio empleado en la primera bomba atómica).
El politetrafluoretileno ("Teflón") resiste los efectos del aceite y el agua. A diferencia de la mayoría de los materiales que si repelen al agua aceptan al aceite (y viceversa), al "Teflón" todos los líquidos se le resbalan.
Como elemento el flúor18 ![]() es
un gas amarillo verdoso, picante y venenoso. En contraste con el carbono que
acepta pasivamente asociarse con otros átomos, el flúor es extremadamente reactivo
por lo que nunca se le halla solo en la naturaleza sino siempre combinado en
moléculas inorgánicas. La extraordinaria actividad química del flúor se debe
a la fuerza con que atrae a los electrones (propios y ajenos) y al pequeño tamaño
de sus átomos. Reacciona tan vigorosamente con el silicio que llega a corroer
el vidrio. Se combina con mucha facilidad con el hidrógeno y al simple contacto
con la lana y la madera las quema. El fluoruro de hidrógeno es tan reactivo
que muchos experimentadores al trabajar con él perdieron parte de sus manos
y sufrieron graves lesiones. El anuncio de la obtención de flúor puro fue hecho
en 1886 por Henri Moissan con un parche en un ojo: lo había perdido por el flúor.
es
un gas amarillo verdoso, picante y venenoso. En contraste con el carbono que
acepta pasivamente asociarse con otros átomos, el flúor es extremadamente reactivo
por lo que nunca se le halla solo en la naturaleza sino siempre combinado en
moléculas inorgánicas. La extraordinaria actividad química del flúor se debe
a la fuerza con que atrae a los electrones (propios y ajenos) y al pequeño tamaño
de sus átomos. Reacciona tan vigorosamente con el silicio que llega a corroer
el vidrio. Se combina con mucha facilidad con el hidrógeno y al simple contacto
con la lana y la madera las quema. El fluoruro de hidrógeno es tan reactivo
que muchos experimentadores al trabajar con él perdieron parte de sus manos
y sufrieron graves lesiones. El anuncio de la obtención de flúor puro fue hecho
en 1886 por Henri Moissan con un parche en un ojo: lo había perdido por el flúor.
Pero, precisamente por ser tan reactivo, los compuestos que lo contienen son en extremo inertes. Ya unido el átomo de flúor a otro átomo se fija con fuerza negándose a combinarse con otras sustancias. Debido a este carácter inerte se emplean compuestos fluorados como propelentes en aerosoles y refrigerantes, véase en el capítulo II, "El refri"
Los átomos de flúor y carbono del "Teflón" están unidos tan estrechamente que resulta muy difícil romper sus uniones y formar nuevas con otras sustancias. El "Teflón" no arde, no hay líquido que lo disuelva, no se corroe, no lo atacan los ácidos (sólo le quitan la mugre), se funde a 330°C y no llega a ser líquido sino un gel traslúcido. Estas características, que lo vuelven un material muy valioso, lo hacen muy difícil de manejar: no se adhiere, no se moldea, no se disuelve... El "Teflón" es un material extraordinario pero es totalmente inútil a menos de que se modifique el polímero y se empleen nuevos métodos para trabajarlo. Puesto que muchas de sus propiedades están relacionadas con su estructura molecular y la regularidad de sus cadenas, pensaron los químicos que si se hacía menos regular el polímero se volvería menos inerte pero más manejable. A tal fin consideraron otro derivado del flúor que polimerizara con el tetrafluoroetileno y eligieron al hexafluoropropileno:
El nuevo polímero resultó más amigable: se logró que el nuevo material se pudiera adherir a otras sustancias.
Ahora bien, entre los métodos para manejar el "Teflón" se encontró uno consistente
en una dispersión de Teflón" en agua; esto permite rociar los gránulos del plástico
sobre toda clase de superficies. Los pequeñísimos granos, al aumentar la temperatura,
se funden parcialmente (sinterizado) y se adhieren entre sí y a la superficie.
De esta manera se recubren sartenes y planchas de vapor; y así se evita que
se les pegue el cochambre,19 ![]() el almidón y las telas.
el almidón y las telas.
Los químicos también han creado una molécula híbrida que tiene un extremo de fluorocarbono y otro de ácido. Este extremo reacciona con las moléculas de celulosa del papel o algodón adhiriéndose a ellas, pero el extremo de fluorocarbono es repelente al agua y aceite. Ya sospechará el lector que estamos hablando del "Scotchgard" y "Zepel", los revestimientos protectores para muebles, impermeables, etcétera.
Los antiguos mexicanos empleaban tortilla quemada para la limpieza de los dientes,
así como el chicle20 ![]() y
el chapopote.21
y
el chapopote.21 ![]() Nuestras
abuelas (los que tuvimos la dicha de conocerlas) a tal fin, empleaban el infaltable
"bicarbonato".
Nuestras
abuelas (los que tuvimos la dicha de conocerlas) a tal fin, empleaban el infaltable
"bicarbonato".
Los dentífricos modernos son variantes de las numerosas sustancias abrasivas y limpiadoras utilizadas tradicionalmente.
Los recetarios caseros del siglo XIX recomendaban cenizas de nogal,
tiza, piedra pómez, jibia, cáscaras de huevo, óxido de estaño, jabón y, finalmente,
artículos patentados allá por 1860, como "jabón para los dientes". La pasta
para los dientes apareció poco tiempo después.
Actualmente se emplean preparados comerciales con los siguientes componentes:
1) Abrasivos como carbonato de calcio, sílice, hidróxido de magnesio, etc., etcétera.
2) Detergentes y agentes espumantes, arilsulfonatos alquílicos, sulfonolaurato y compuestos de amonio.
3) Esencias y edulcorantes, como esencias de menta piperita, menta verde, mentol, etétera.
4) Lubricantes, espesadores, emulsificantes y plastificantes como: aceite mineral, manteca de cacao, glicerina, almidón, tragacanto, gelatina, etcétera.
5) Colorantes. Éstos deben ser aprobados por la dependencia de salud respectiva. Véase "Los aditivos", en el capítulo I.
6) Sustancias especiales, como medicamentos: bórax, mentol, peróxido de calcio; y conservadores como ácido benzoico, ácido salicílico, éster metílico del ácido p-hidroxibenzoico.
A pesar de las alabanzas que los fabricantes de dentífricos hacen de sus productos es muy dudoso esperar de éstos otra cosa que la limpieza de los dientes en la superficie expuesta. Es poco probable que la zona interdental reciba los beneficios de un dentífrico pues hay una relación demostrada entre limpieza y abrasión. Ciertamente la superficie entre los dientes puede limpiarse con seda dental.
Los detergentes de los dentífricos facilitan la limpieza de la boca pero el elemento indispensable es el cepillo de dientes: la acción mecánica es fundamental para eliminar los restos de alimentos que dan lugar a la putrefacción bucal; la pasta de dientes no impide esta putrefacción pues no sólo se debe a los restos de alimentos sino también a la acción de microorganismos sobre las mucosas.
La fabricación de pastas de dientes es difícil porque el producto se altera fácilmente en presencia de algunos metales (p.ej. trazas de cobre). Además, para satisfacer al consumidor; debe evitarse el endurecimiento de la pasta, su licuación y la separación de sus componentes en el tubo. Para impedir esto último se emplea gel de sílice, hidróxido de magnesio, goma de tragacanto, etc. Las pastas de dientes, curiosamente, están expuestas a explosión en el tubo por desprendimiento de CO2 debido a la fermentación de sus ingredientes, por eso se emplean conservadores como benzoato de sodio o ésteres propílico o metílico de ácido p-hidroxibenzoico. La tendencia actual es reemplazar los edulcorantes como azúcar o miel y las gomas y mucílagos que fermentan.
Con el tiempo las pastas de dientes pueden tomar un sabor desagradable debido a cambios químicos en las esencias empleadas o enranciamiento del jabón.
En el capítulo II señalamos que una de las propiedades comunes a las bases (tal como dice R. Boyle en El químico escéptico, 1661) es el ser aceitosas al tacto. Esta característica se debe a la capacidad que tienen las bases para disolver los tejidos orgánicos. En otras palabras, no es que sean "untuosas" o "resbalosas" al tacto sino que, por disolver la piel, los dedos resbalan fácilmente como si hubiera aceite.
No es raro, entonces, que se usen bases fuertes como KOH (potasa) y NaOH (sosa) para disolver los tejidos y restos orgánicos que han tapado alguna cañería. Lo cual las hace muy útiles para quitar pringue y cochambre.
El radical OH - tiene una consecuencia poco agradable cuando está presente en el cocido de verduras. Ya señalamos, capítulo III, que la clorofila se descompone en medio ácido (razón por la que suele ponerse un poco de bicarbonato o tequesquite) dejando ver un desagradable color pardo. Sin embargo, un exceso de OH - (originado por el bicarbonato) reblandece los tejidos vegetales haciéndolos muy poco apetitosos. Por esta propiedad se emplea para preparar el nixtamal y frutas cristalizadas, como brevas. El OH - produce el ablandamiento del tejido exterior de la semilla (hollejo).
Puesto que el bicarbonato de sodio (mal llamado "carbonato" por muchas amas de casa) es un sólido iónico, resulta comprensible que sus aristas sean resistentes. Lo que le da propiedades abrasivas... útiles cuando se trata de limpiar cobre o algún otro metal (ej., para quitar cochambre de los implementos culinarios). El bicarbonato de sodio, aunque no tiene en su fórmula (NaHCO3) el célebre OH -- que disuelve las grasas, reacciona con el agua produciéndolo. En efecto, el bicarbonato da lugar, en solución acuosa, a una serie de reacciones que, a fin de cuentas, producen OH -
y el HC0 -3 reacciona con el agua
En esta última reacción se emplea el símbolo ó para indicar que las cuatro
sustancias se hallan presentes, esto es, la reacción es reversible químicamente
y, con el tiempo, alcanzan el equilibrio.22 ![]()
Un ejemplo de equilibrio químico es la cubeta en que "lavan" los platos en los puestos de tacos. La reacción es: Plato sucio + agua + mugre disuelta
Llega un momento en que la cubeta tiene tal concentración de mugre disuelta que los platos no salen limpios. Los recién casados conocen bien este equilibrio por lo que prefieren enjuagar los platos con agua corriente.
Un componente usual en los polvos para lavar hornos o sartenes (en general
para quitar cochambre) es el abrasivo.23 ![]() Como
el cristal de NaCl es de mayor tamaño que el de NaHCO3
es más recomendable este último por su poder abrasivo.
Como
el cristal de NaCl es de mayor tamaño que el de NaHCO3
es más recomendable este último por su poder abrasivo.
El mismo principio tienen muchos polvos limpiadores, si bien sus componentes
pueden ser muy distintos: feldespatos,24 ![]() pirofosfatos,
25
pirofosfatos,
25 ![]() carbonatos,
26
carbonatos,
26 ![]() piedra
pómez,27
piedra
pómez,27 ![]() etc.
Los polvos limpiadores (casi siempre empleados en sartenes, parrillas y hornos)
están formados por un 90% de polvo abrasivo y requieren de mucha mayor acción
mecánica que los detergentes (para ropa, telas, etc.), sin embargo también contienen
disolventes de grasas (alquilbencenosulfonato de cadena larga, por ejemplo)
y, frecuentemente, éstos hacen la diferencia entre un buen y mal polvo limpiador.
etc.
Los polvos limpiadores (casi siempre empleados en sartenes, parrillas y hornos)
están formados por un 90% de polvo abrasivo y requieren de mucha mayor acción
mecánica que los detergentes (para ropa, telas, etc.), sin embargo también contienen
disolventes de grasas (alquilbencenosulfonato de cadena larga, por ejemplo)
y, frecuentemente, éstos hacen la diferencia entre un buen y mal polvo limpiador.
Uno de los males que más atormentan a la humanidad es la llamada "cruda".
Acompañada de la acidez estomacal es el martirio semanal que todo oficinista soporta como pago de un borrascoso fin de semana o de una comida de trabajo que se prolongó más de lo debido y de lo bebido.
Las bebidas alcohólicas no contienen sólo alcohol etílico sino muchos compuestos que intervienen en el tormento que estamos tratando. Alcoholes amílico, butílico, propílico, metílico, ácidos, aldehídos, ésteres, cetonas, fenoles y taninos y, eventualmente, vitaminas y proteínas, constituyen sólo algunas de las sustancias presentes en las bebidas espirituosas; así sea de los materiales originales, así sea de las reacciones de fermentación y almacenamiento (amén de las que el fabricante haya incorporado para asegurar la venta).
Paradójicamente, las bebidas alcohólicas contienen algunas sustancias que interfieren en la absorción de alcohol etílico.
Cuando se ingiere un bebestible espirituoso se diluye en los jugos estomacales
(la saliva ya ha comenzado la dilución) y se distribuye muy rápidamente por
el organismo. El alcohol no necesita ser digerido; llega tal cual al torrente
sanguíneo desde el estómago y, sobre todo, desde el intestino delgado. La velocidad
con que ocurre depende de la cantidad bebida y del estado del estómago. Si el
estómago está vacío y la cantidad de alcohol es grande, se cierra el píloro
y casi no pasa alcohol al intestino delgado, en consecuencia los efectos son
lentos. Lo mismo ocurre si ya hay alimentos grasos en el estómago.28 ![]()
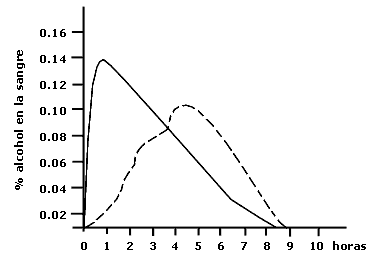
Figura V. 7: Porcentaje de alcohol en la sangre a intervalos de una hora. La curva continua corresponde a una sola dosis de 288 cm3. La curva intermitente corresponde a 4 dosis de 57 cm3 a intervalos de 1 hora.
Por el contrario, el alcohol se absorbe rápidamente si está acompañado de bebidas gaseosas ("Tehuacán", "Coca- Cola", etc.), por lo que cubas, jaiboles, campechanas, mojitos, gin&tonic, vodkatonic, etc. etc., se "suben" rápidamente.
El alcohol se difunde en proporción al contenido de agua de los tejidos del organismo. La sangre tiene 83% y el cerebro 74.5 (úsese o no). Ya asimilado el alcohol el organismo comienza a expelerlo; una pequeña proporción mediante los pulmones y las glándulas sudoríparas, una mayor por los riñones. Pero el 90% es metabolizado por el hígado donde es convertido en acetaldehído, otra sustancia tóxica, por lo que se convierte inmediatamente (con otra enzima) en acetato de etilo, el cual llega a la sangre donde se transforma en CO2 y H2O. Por cada gramo de alcohol el organismo obtiene .007 Calorías y, en este sentido, puede decirse que es un alimento.
No hay duda de que el hombre puede beber alcohol a una velocidad mayor de la que puede metabolizarlo; la figura V.7 muestra el porcentaje de alcohol en la sangre resultado de una y varias dosis.
Tampoco hay pruebas de que beber pequeñas cantidades de alcohol regularmente tenga efectos dañinos. Si bien una intoxicación alcohólica, por leve que sea, trae aparejada una gran cantidad de perturbaciones bioquímicas: las glándulas adrenalinas secretan hormonas, las reservas de azúcar del hígado se movilizan, se altera el balance electrolítico, se altera el metabolismo del hígado, etc. Estos cambios no tienen consecuencias posteriores y el organismo rápidamente regresa a la normalidad. Sin embargo, una intoxicación alcohólica severa puede producir desde dolor de cabeza, gastritis, sed (debido a la pérdida de agua dentro de las células) hasta malestar físico y mental; si la intoxicación alcohólica es frecuente se produce deterioro físico y mental gradual. Lo anterior resulta, con todo, un precio bajo para algunos bebedores debido al bienestar y euforia efímeros que les produce el alcohol. Bienestar y euforia que, en rigor; son muy discutibles. En efecto, con un par de "tragos" uno puede tener mayor agilidad mental y humor; con cuatro, regresa al nivel normal y, con seis o más, se deterioran la memoria, el juicio, etc.; sin embargo, lo que mejor recuerda el bebedor es aquello para lo que tuvo buena memoria: la primera etapa de la pítima, cogorza, borrachera, beodez o papalina.
Es cierto que una pequeña cantidad de bebida alcohólica puede servir para disminuir la ansiedad y la tensión, puede incluso producir buen humor y "achispar". Pero también es probable que tales estados se deban a que, socialmente, hay mayor tolerancia y permisividad en las reuniones donde se bebe. En este sentido el alcohol no sólo es una droga psicoactiva sino también socioactiva.
Afortunadamente la química interviene para disminuir algunas dolencias de los mortales debidas a un ligero exceso en la bebida.
Los ácidos resultantes de la descomposición de los alcoholes pueden ser neutralizados de la siguiente manera: el Alka-Seltzer contiene bicarbonato de sodio y un ácido débil (como el ácido tartárico). Al poner las tabletas salvadoras en un vaso con agua se produce ácido carbónico (H2CO3), otro ácido débil. Sin embargo, parte del NaHCO3 que produce el ácido carbónico reacciona también con los ácidos del estómago del sufrido paciente y los neutraliza. En realidad la hidrólisis del ion HCO3- es la clave del alivio. El ion HCO3- reacciona según
produciendo el mismo ácido carbónico que contiene el "Tehuacán". Pero, ¡ojo! también se produce OH- que sirve para neutralizar al fatídico H+ de los ácidos.
El H2CO3, a su vez, se descompone:
con lo que un reconfortante regüeldo termina con algunos de los malestares por excesos en el beber.
Básicamente estas reacciones son las mismas que se tienen cuando se emplean
jugo de limón y bicarbonato, o sal de uvas. Para terminar el "Alka-Seltzer",
como la "Sal de uvas29 ![]() Picot",
tiene un poco de ácido acetilsalicílico para combatir el dolor de cabeza.
Picot",
tiene un poco de ácido acetilsalicílico para combatir el dolor de cabeza.