IV. EN DONDE ARRECIAN LOS DESCUBRIMIENTOS DE SUSTANCIAS AERIFORMES Y NO SE PERCIBE LO QUE SE TIENE BAJO LA NARIZ. Y EN DONDE SE VE QUE UN SIGLO DESPUÉS DE LOS PRINCIPIA SE ENUNCIA UNA LEY FUNDAMENTAL Y NACE LA QUÍMICA
EN UNA mañana de noviembre de 1772, bien abrigado, con gorro, bufanda y dos
abrigos desgastados, llegó el joven Carlos Guillermo Sheele ante la puerta de
la botica adosada a la sacristía de la catedral de Upsala. Después de luchar
con la congelada llave entre sus dedos ateridos para abrir la puerta, se apresuró
a colgar el letrero de "abierto" y a volverla a cerrar. Encendió la estufa,
colocó el tintero encima para que se descongelara la tinta, y sin quitarse los
guantes mojó la pluma y continuó el relato suspendido desde la noche anterior.
Llevaba fielmente la bitácora de sus descubrimientos desde que tenía 15 años,
cuando era aprendiz con Herr Bauch, y ahora ya de 30, se ocupaba de escribir
un relato coherente de todos ellos. Ciertamente que llegaría el día en que su
escrito aparecería en las actas de la Real Academia de Ciencias sueca... "pero
antes debo establecer mi punto de vista sobre el flogisto, no pienso que sea
como afirma la mayoría, una substancia contenida en lo que arde. Pienso que
está contenido en el fuego mismo y que las llamas son la mezcla de flogisto
con el aire, pienso por lo tanto que el fuego no es un elemento. Concluyo esto
porque he encontrado que no siempre es necesaria la presencia de carbón para
reducir un calx a metal, en cambio, siempre es necesario calentar. Tal es
el caso del nitro de plata,1 ![]() si
lo caliento hasta el rojo, obtengo la plata metálica y el flogisto necesario
fue proporcionado por el fuego que calentó al crisol". Al llegar a este punto,
Scheele atizó la estufa y procedió a prepararse un té, le atormentaba el origen
del flogisto, miró el reloj y vio que todavía contaba con una hora para escribir
a sus anchas antes de que se presentara el primer cliente. Se frotó las manos
y preocupado su puso a acomodar los frascos. Después de un rato, se sentó y
continuó escribiendo..."Me di cuenta de la necesidad de aprender acerca del
fuego. Pronto vi que no era posible formarse una opinión al respecto mientras
uno no comprendiera el aire. Y después de que llevé a cabo cierto número de
experimentos, vi que el aire penetraba en el material que arde (el combustible)
y se convertía así en un componente de flamas y chispas."
si
lo caliento hasta el rojo, obtengo la plata metálica y el flogisto necesario
fue proporcionado por el fuego que calentó al crisol". Al llegar a este punto,
Scheele atizó la estufa y procedió a prepararse un té, le atormentaba el origen
del flogisto, miró el reloj y vio que todavía contaba con una hora para escribir
a sus anchas antes de que se presentara el primer cliente. Se frotó las manos
y preocupado su puso a acomodar los frascos. Después de un rato, se sentó y
continuó escribiendo..."Me di cuenta de la necesidad de aprender acerca del
fuego. Pronto vi que no era posible formarse una opinión al respecto mientras
uno no comprendiera el aire. Y después de que llevé a cabo cierto número de
experimentos, vi que el aire penetraba en el material que arde (el combustible)
y se convertía así en un componente de flamas y chispas."
Sonó en ese momento la campanilla de la puerta.
—¡Buenos días, Herr Scheele, he venido para que me haga favor de preparar una mezcla para la tos de mi hijo!
—¡Adelante Frau Bergman! Tengo aquí una mezcla de gordolobo y de una bella flor; Bougainvillea spectabilis, ambos de la Nueva España, que es magnífica en infusión para desterrar la tos, yo mismo la he probado. Que la tome ya metido en la cama.
Después de pagar; Frau Bergman se alejó, confortada por la cortesía del querido boticario y reconfortada por la calidez que emanaba del solo nombre de esa lejana tierra.
Por su parte, Scheele, se frotó las manos y continuó con su relato..."y así se puede notar que el aire confinado en contacto con diferentes substancias se contrae. Por ejemplo, cuando puse hígado de azufre, aceite de linaza, y virutas de fierro húmedas, materiales todos ricos en flogisto según la opinión corriente, en todos los casos observé disminución de la presión del aire. Después de unos cuantos días, el aire absorbido por estas substancias era una cuarta parte del inicial. En todos los casos advertí que el aire residual apaga un cerillo encendido. Por lo que afirmo que difiere del aire común. Si este aire fuera la unión de aire común con flogisto, habiéndose contraído, debería ser más denso que el aire común. Pero un matraz muy delgado que llené con este aire y que pesé de la manera más exacta posible, no sólo no contrapesó un volumen igual de aire ordinario, sino que resultó un poco más ligero. De donde concluyo que el aire no es un elemento, sino que esta compuesto de dos fluidos, que difieren uno del otro. Uno de ellos no manifiesta en lo más mínimo la propiedad de atraer al flogisto (no arde), mientras que el otro que constituye una tercera o cuarta parte de la masa total del aire, está peculiarmente dispuesto a tal atracción. Al primero lo he llamado aire mefítico y al segundo aire empíreo.
"He verificado la contracción del aire también en el siguiente caso. Puse un
poco de fósforo en un matraz delgado bien cerrado. Lo calenté un poco hasta
que el fósforo se encendió, se produjo una nube blanca que se depositó formando
flores sobre la pared del matraz. Cuando se hubo apagado el fósforo, abrí el
matraz bajo el agua y ésta se precipitó a su interior para ocupar una tercera
parte de su volumen. Pude comprobar otra vez que el aire restante, la parte
mefítica, no sostiene la combustión. Otro caso en el que pude verificar la contracción
del aire atmosférico fue cuando hice arder la substancia inflamable de Boyle;
coloqué esquirlas de estaño en vitriólico diluido, en un frasquito bien cerrado
pero comunicado con el exterior mediante un tubo largo; sumergí el frasquito
en una cubeta de agua caliente (para ayudar a que el desprendimiento de la substancia
fuese abundante), encendí la substancia en la punta del tubo y deslicé un matraz
invertido por la longitud de él. Inmediatamente el agua subió por el cuello
del matraz. En vista de que no comprobé formación de ninguna substancia nueva,
concluyo que lo que ha ocurrido es que el aire-inflamable se combinó con el
aire-empíreo2 ![[Nota 2]](../img/mcommnt.gif) y
tal combinación es el calor que escapa por el vidrio del matraz:
y
tal combinación es el calor que escapa por el vidrio del matraz:
pienso que es inevitable identificar el aire inflamable de Boyle con el flogisto.
Para estar completamente seguro de que el calor es esta combinación, ensayé
diversos métodos para descomponerlo y liberar el aire-empíreo. La idea es sencilla,
simplemente exponer al calor alguna substancia que tenga una atracción mayor
por el flogisto de la que tiene el aire empíreo para que se lo robe y quede
liberado el aire empíreo. Una de tantas formas de realizar la descomposición
del calor; que llevé a cabo varias veces, consistió en lo siguiente. Calentar
en la retorta el mercurius calcinatus per se (calx de mercurio):3 ![]()
|
calx merc. + calor
|
®
|
mercurio + aire-empíreo.
|
|
|
||
|
f+ aire-empíreo.)
|
(calx merc. + f)
|
|
"Es seguro que los productos de la reacción son mercurio y el gas aire-empíreo
porque este último colectado en una vejiga se absorbió completamente
al confinarlo con hígado de azufre; la vejiga se plegó completamente sobre el
hígado al no quedar aire-empíreo libre en su interior que resistiera la presión
del aire exterior a ella. Pero no sólo esto, también comprobé que después de
arder fósforo en un matraz delgado, cerrado, lleno de aire empíreo, al enfriarse
estallaba, lo que demuestra que casi todo el aire empíreo fue consumido, dejando
un vacío tal que las paredes del matraz no pudieron resistir ellas solas la
presión del aire exterior. Repetí la combustión del fósforo en aire empíreo
en un matraz grueso y cerrado y no pude extraer el tapón bajo el agua; lo que
ocurrió fue que se sumió el tapón y se precipitó el agua al interior llenándolo
por completo." En ese momento, entró con gran estrépito de la campanilla, de
su vozarrón y de palmadas, un campesino en busca de un remedio para su vaca
enferma. Ahí dejamos a Scheele con su lugar en la gloria bien asegurado.4 ![[Nota 4]](../img/mcommnt.gif)
El sonido alegre de una campanilla avisando que ya estaba lista la comida reverberó en el cálido mediodía de agosto de 1772 y despertó de su abstracción al hombre que absorto mordisqueaba una varita sentado al pie de un roble con un libro sobre las rodillas. Se enderezó, se sacudió la yerba del fino satín de sus calzas, recogió su libro y su bastón de malaca y puño de plata mexicana, y se dirigió con paso rápido a la entrada de la huerta, donde la silueta vaporosa y elegante de la joven Madame Lavoisier destacaba el rosa de su organdí contra el cielo azul.
—Antoine, chéri, vino monsieur Maréchal de la Academia de Ciencias y te dejó un paquete de papeles, me dijo que se explican por sí solos. Los puse sobre tu escritorio. Traía prisa y dijo no poder detenerse a hablar contigo ni a comer. Me intrigó por un instante, con una profunda inclinación ofreciendo sus más calurosas felicitaciones, "para mi eminente esposo". Pero ya lo conoces, ¡es tan formal y ceremonioso!
Sin contestar, el hombre se inclinó a besar la mejilla de su mujer y ambos se dirigieron en silencio a la terraza donde estaba ya dispuesta una mesa para el almuerzo.
— Te veo pensativo, ¿ocurre algo? Desde que se llevaron a cabo los experimentos
con los diamantes5 ![]() te
estás obsesionando con la explicación de la combustión y de la calcinación,
¿puedo saber qué has estado pensando?
te
estás obsesionando con la explicación de la combustión y de la calcinación,
¿puedo saber qué has estado pensando?
Como Lavoisier moviera dubitativamente la cabeza, la joven prosiguió.
—¡Oh Antoine, Antoine! ¿No te habrás quedado dormido bajo el roble? Aunque no te culparía, el rumor de las cigarras adormece hasta las lechuzas.
—No, querida, no —contestó Lavoisier mientras abría el paquete—. ¡Otra vez, más trabajos que revisar! Uno, relacionado con la combustión del fósforo... otro, relacionado con destilaciones... ¡En latín! ¿Estos alemanes no podrían escribir en francés y no en esta antigualla?... Este otro, en inglés. ¡Vas a tener mucho trabajo traduciéndolos, están muy largos! Pero esta vez hay algo más... —dijo rebuscando en el fondo del paquete y extrayendo un pliego—. ¡Mira! —exclamó con orgullo—. ¡Tienes ante ti al nuevo miembro correspondiente, clase química, de la Academia de Ciencias! —y tendió una carta a María Ana—.
Cuando ella la hubo leído, no pudo contener su júbilo, y abrazando a Lavoisier; lo obligó a valsar alrededor de la mesa. Por fin, calmada, lo dejó caer en un sillón.
—¡Tenía que ser querido! ¡Nada más justo!
—¡Tenemos que partir inmediatamente, tengo preparada una secuencia de experimentos de la mayor importancia!
—¡Cómo, chéri, tenemos que celebrar! Una hora más para comer y otra media para que fumes tu pipa no van a retrasarte.
— Sonriente ante el argumento, Lavoisier aceptó—.
—¿Te parece que ordene descorchar una botella de champaña? ¡Tenemos que celebrar! Por lo demás, le sentará muy bien al menú de hoy: pato. Tendré que enviar una nota de agradecimiento a la marquesa de Cinq-Cygne que nos lo envió ya desplumado y preparado.
Poco después, con una tacita de aromático café al lado e instalado en la terraza, Lavoisier releyó la carta donde se le notificaba su nombramiento.
Madame Lavoisier insistió voluble.
—Cuenta, ¿te ayudará el nuevo nombramiento a conseguir fondos para nuevos
equipos de laboratorio? ¿Por eso has estado tan caviloso? ¡Mayores han de ser
las prerrogativas de un miembro correspondiente que las de un mero adjunto 6![]()
—No querida. Te lo vuelvo a repetir, pero recuerda que es algo estrictamente
confidencial, la administración pública está cosida de deudas. Es imposible
que la Corona otorgue ningunos fondos a la Academia. ¡Vamos, con trabajos siguen
recibiendo su sueldo los trabajadores de la pólvora! La deuda de la nación con
la Compañía General de Recaudaciones asciende ya a cerca de un de libras. Por
otra parte, no es posible subir más los impuestos, prefiero que me paguen con
puntualidad, aunque no sea mucho, a tener que andar detrás de la gente amenazándola
con la Bastilla y creándome enemigos innecesarios.Todavía es rentable ser miembro
de la Compañía Recaudadora.7 ![]()

Figura 16. Los Lavoisier (cuadro de David).
—Pero ¿qué han dicho el contralor general del reino y la comisión de asuntos
económicos de tus propuestas de reforma económica?8![[Nota 8]](../img/mcommnt.gif)
—No dicen nada, pero no se atreven a tomar medidas de ahorro. La nobleza de nuestra época es realmente irresponsable, no admite que los campesinos están empobrecidos en forma inhumana.
—Pero, entonces ¿qué se puede hacer? De alguna parte tiene que salir el dinero...
—Sí, hay varios agujeros en nuestra organización, que aprovechan los evasores
de impuestos; el principal es el contrabando de mercancías a la ciudad de París.
Pero no es eso lo que me preocupa más por el momento, todavía tengo una reserva
para material de vidrio. Lo que me tiene caviloso, y podría decir que me ha
calentado la cabeza, son varios datos, todos interrelacionados, y no puedo evitar
el sentir que debe haber una teoría que los explique. Para comenzar por algún
lado, está este ensayo, precisamente del contralor general, monsieur
de Turgot, sobre el estado aeriforme de la materia9 ![[Nota 9]](../img/mcommnt.gif) dijo
Lavoisier al tiempo que encendía su pipa—. Este pensador señala con justa
razón que toda substancia, siempre y cuando se le proporcione una cantidad
de calor adecuada, puede adquirir el estado aeriforme. Toma como ejemplo el
agua; si tiene poco calor es hielo, si tiene un poco más es agua común, y si
se le añade aún más, se hace aeriforme, se convierte en vapor de agua, y como
diría Van Helmont, en un gas. La cosa es que, una vez que el vapor ha pasado
al aire, no nos damos cuenta de que ya no se trata de aire puro, sino de una
mezcla de dos gases, el aire y el vapor; que lleva el calor que se mezcló con
él. Ahora bien, la espina que se me ha metido entre ceja y ceja es que, si todas
las substancias son susceptibles de tomar el estado aeriforme y tal estado no
es exclusivo del aire, ¿cómo sé yo que lo que estoy considerando como el elemento
aire, no es en realidad una mezcla de elementos aeriformes?
dijo
Lavoisier al tiempo que encendía su pipa—. Este pensador señala con justa
razón que toda substancia, siempre y cuando se le proporcione una cantidad
de calor adecuada, puede adquirir el estado aeriforme. Toma como ejemplo el
agua; si tiene poco calor es hielo, si tiene un poco más es agua común, y si
se le añade aún más, se hace aeriforme, se convierte en vapor de agua, y como
diría Van Helmont, en un gas. La cosa es que, una vez que el vapor ha pasado
al aire, no nos damos cuenta de que ya no se trata de aire puro, sino de una
mezcla de dos gases, el aire y el vapor; que lleva el calor que se mezcló con
él. Ahora bien, la espina que se me ha metido entre ceja y ceja es que, si todas
las substancias son susceptibles de tomar el estado aeriforme y tal estado no
es exclusivo del aire, ¿cómo sé yo que lo que estoy considerando como el elemento
aire, no es en realidad una mezcla de elementos aeriformes?
—Por lo pronto, mira, en este paquete viene un informe sobre una substancia
aeriforme distinta del aire que un tal José Priestley ha identificado y a la
que denomina gas silvestre o aire fijo. Al menos es lo que afirma en el resumen.
Desde luego que lo verificaremos; te ruego, linda, que le des prioridad a la
traducción de este trabajo. ¡He aquí justamente un hallazgo que prueba la conjetura
de Turgot! Pero ya desde hace varios años es conocida la tesis doctoral de Black10
![[Nota 10]](../img/mcommnt.gif) sobre
la descomposición de la magnesia alba y de otros álcalis suaves que, al ser
calcinados o tratados con ácido, desprenden cantidades prodigiosas del gas llamado
aire fijo.
sobre
la descomposición de la magnesia alba y de otros álcalis suaves que, al ser
calcinados o tratados con ácido, desprenden cantidades prodigiosas del gas llamado
aire fijo.
—¿El mismo de Priestley? —preguntó María Ana, que estaba al día, pues Lavoisier compartía sus ideas con ella y ella participaba en los experimentos, en capacidad de dibujante, para hacer las ilustraciones de las memorias—.
—Parece que sí, lo verificaremos. Pero no sólo esto, está también la memoria
que presentó sobre los "aires facticios" ante la Academia de Ciencias inglesa
el respetabilísimo Cavendish.11 ![[Nota 11]](../img/mcommnt.gif) Así
que, por lo pronto, parece que contamos con diversos gases distintos
del aire atmosférico: el vapor de agua, el aire fijo, el aire inflamable, el
aire mefítico y el gas de los pantanos; uno obtenido por suministro de calor;
otro obtenido por calcinación de algunas substancias sólidas, no expandibles,
donde se encontraba fijo; esto es, atrapado. ¿En qué forma? —dijo besuqueando
la nariz de María Ana y continuó—. Otro, obtenido por reacción química entre
substancias no expandibles; uno más, formado a partir del aire común por la
respiración de los animales; y el último, de la putrefacción de la materia vegetal.
Es indudable que deben ser muchas las substancias que se encuentran en el estado
aeriforme, permanentemente, o que pueden ser obtenidas, liberándolas de las
substancias no expandibles donde se encuentren fijas, por adición de calor.
Así
que, por lo pronto, parece que contamos con diversos gases distintos
del aire atmosférico: el vapor de agua, el aire fijo, el aire inflamable, el
aire mefítico y el gas de los pantanos; uno obtenido por suministro de calor;
otro obtenido por calcinación de algunas substancias sólidas, no expandibles,
donde se encontraba fijo; esto es, atrapado. ¿En qué forma? —dijo besuqueando
la nariz de María Ana y continuó—. Otro, obtenido por reacción química entre
substancias no expandibles; uno más, formado a partir del aire común por la
respiración de los animales; y el último, de la putrefacción de la materia vegetal.
Es indudable que deben ser muchas las substancias que se encuentran en el estado
aeriforme, permanentemente, o que pueden ser obtenidas, liberándolas de las
substancias no expandibles donde se encuentren fijas, por adición de calor.
—¡Qué curioso! —exclamó María Ana—. Hace casi 50 años que Hales12
![]() publicó
sus experimentos de atrapar los gases y no pareció darse cuenta de que se trataba
de substancias diferentes.
publicó
sus experimentos de atrapar los gases y no pareció darse cuenta de que se trataba
de substancias diferentes.
—¡Exactamente! —replicó Lavoisier; después de chupar con fuerza la pipa y exhalar el humo con deleite—. Para él, todas esas substancias aeriformes que atrapó eran aire atmosférico, más o menos contaminado con partículas o "efluvios" ajenos a él. Por eso fue tan importante el trabajo de Black, porque fue el primero que demostró la existencia de un "aire" diferente del aire común, aunque Black sólo se dio cuenta de que, a diferencia del aire común, el aire apodado fijo se fija en el agua de cal volviéndola opaca. El asunto es que Hales los dejó escapar, sin mayor examen que pesarlos en una balanza muy burda, y eso no siempre. Te aseguro que no contaba con balanzas como las nuestras que casi compiten en sensibilidad con las de la Casa de Moneda. Pero, además, ¿no crees que es posible que si hay gases que se obtienen como producto de una reacción entre substancias no aeriformes, no puedan los gases a su vez participar en una reacción con una substancia no expandible, o entre ellos, fijándose en forma de un producto sólido o líquido?
Después de reanimar su pipa que ya se estaba apagando, Lavoisier continuó:
—A esta inquietud, añádele el hecho de tantos informes sobre el aumento de peso de los calces metálicos respecto del peso del metal, cuando éste se calcina; y las sugerencias que se han hecho, olvidadas por la mayoría de los químicos actuales; una, la de Boyle, de que el aumento se debe a la fijación de partículas de fuego, y la otra, de que se debe a absorción de aire.
—Mira, esos otros papeles que llegaron también en el paquete —dijo tendiéndoselos a la joven— son memorias donde se informa sobre ganancia de peso de distintas substancias al ser calcinadas. Desde luego que los verificaremos. Ahora bien, este aumento del peso es un asunto muy serio. Es un hecho, cómo decirte, que para mí demuestra la falsedad de la teoría de que el flogisto se escapa del metal cuando éste es calcinado. Es ridículo suponer una substancia con la propiedad absurda de "antipeso", todo eso está chueco.
—¿Sí? —preguntó María Ana con timidez—.
—Tengo la convicción de que el aumento de peso de los calces se debe a fijación del aire, pero si éste fuera una mezcla, el aumento se debería a la fijación ¿de uno, de varios de sus componentes? Habría que probar esto. Ya sea una cosa o la otra, los calces no serían elementos, y por lo tanto debo hallar la forma de llevar a cabo su descomposición, recuperando el aire absorbido. Demostrarlo con algún calx sería suficiente por el momento.
—Has dicho varias veces: habrá que verificarlo, ¿por qué?
—Porque los experimentadores no prestan la atención que deben al fenómeno que tienen enfrente, pesan los calces, pero no controlan la presencia del aire, no lo pesan, ni miden la disminución de presión en un recipiente cerrado para calcular cuánto se consumió.
—Comprendo la idea de medir la presión y el volumen que el gas ocupa y
darse cuenta de que se consumió, pero el resultado es variable, depende del
estado del tiempo13 ![[Nota 13]](../img/mcommnt.gif) ¿Cómo
pesarlo en forma precisa?
¿Cómo
pesarlo en forma precisa?
—Hay diversos modos, uno muy químico e indirecto. Es el empleado por Cavendish para sus estudios del gas inflamable.
—Lavoisier tomó uno de los informes que habían llegado en el paquete y procedió a garrapatear en la parte posterior mientras le explicaba a María Ana.
—Se pesan el frasco A, el tubo de comunicación B y el tubo secante C, lleno de álcali fuerte, se verifica que los tubos y el frasco ajusten perfectamente entre sí. Se pesa una cantidad de ácido que se coloca en el frasco y se voltean sobre él las virutas de metal previamente pesadas, inmediatamente se cierra el aparato. Toda humedad y ácido que salpique se atora en el tubo secante. Cualquier aire fijo que pudiera desprenderse se fija en el álcali fuerte. Así, sólo escapa el aire inflamable y como se conoce el peso inicial, la diferencia entre éste y el nuevo peso, que es menor, no puede ser otra que el peso del gas desprendido.
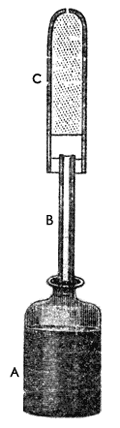
Figura 17. Aparato de Cavendish para calcular el peso del gas desprendido en la reacción que ocurre en el frasco.

Figura 18. Lavoisier trabajando en la descomposición del óxido mercúrico.
—¿Y cómo probar o desmentir la hipótesis de Boyle?14 ![]()
—¡Ah, hay algo que los químicos están ignorando! Y que me he dado cuenta que es indispensable probar y de lo que estoy íntimamente convencido, que la masa total de los reactantes en una reacción química es igual a la masa total de los productos. ¡En la Naturaleza y por lo mismo en el laboratorio, nada se crea, sólo se transforma! Por lo mismo, si llevo a cabo una calcinación en un recipiente cerrado y compruebo que su peso es el mismo después de que se enfrió que al inicio, cuando cerré el recipiente, antes de empezar a calentar; como estoy seguro que ocurrirá, la hipótesis de Boyle quedará descartada, porque la masa total, del recipiente cerrado será la misma, y cuando, una vez abierto, se compruebe que el peso del calx es mayor que el peso del metal original, se tendrá que concluir que el calx es el resultado de la fijación del aire con el metal y no con el calor o con el fuego. Ninguno de ellos lleva a cabo las calcinaciones de metales en recipientes cerrados. He estado planeando una serie de experimentos bien controlados para probar mis conjeturas.
—Bueno, en resumidas cuentas, Boyle no tiene razón porque el flogisto no es el causante del aumento de peso de los calces, pero tampoco tiene razón Stahl, porque es imposible que los calces sean el metal desprovisto de su flogisto; entonces, según tú, los calces son el metal más aire. Pero ¿y las flamas qué son?
—No va a ser fácil echar abajo la teoría de que el flogisto se desprende del metal. Habrá que explicar de otra forma la mayoría de los hechos que el flogisto dizque aclara. ¡Deben poder ser comprendidas la combustión, la calcinación y la respiración en forma racional, newtoniana!
—¿Quieres decir con esto una explicación en términos de átomos?
—¡No, no! Quiero decir en términos de substancias reales todas ellas con el primer atributo de toda materia, su masa, y no ese comodín aberrante llamado flogisto. ¡No en balde hemos nacido después de Isaac Newton!... Ahora bien,... sí... las flamas... Estoy preparado para admitir que el flogisto existe combinado en el aire, se desprende en la luz y el calor de la flama, con lo que el aire pierde sus expansividad y se fija en el metal.
Al ver el asombro de María Ana, quien con dificultad lo seguía, Lavoisier explicó.
—Digo esto, basado en la teoría de Turgot, fíjate bien. Si un líquido se convierte en vapor; es porque absorbió calor; esto es, fuego; entonces, las substancias en estado aeriforme indudablemente son compuestos de ellas mismas con el flogisto, al que deben su expansividad. No veo por qué el aire haya de ser la excepción.
Al ver la expresión de comprensión en el rostro de María Ana y que se transformaba en adoración abierta, Lavoisier no resistió puntualizar.
—Nota que en mi conjetura se explica el aumento de peso del calx, se explica la flama y no se requiere suponer una substancia misteriosa que a veces pese y a veces no, basta con suponerla siempre muy ligera y sutil.
—Sí, bellísimo, pero hay en todo esto un detalle que no comprendo bien —dijo María Ana juntando las manos bajo la barbilla—, a veces dices peso, a veces dices masa...
—¡Oh! Cuando digo masa me estoy refiriendo a la propiedad de la inercia ante el cambio del estado de movimiento por acción de un agente externo al cuerpo en cuestión, como se entiende en mecánica, que interpreto como cantidad de materia. El peso, por otra parte, es la fuerza con que una porción de materia es atraída por la Tierra; su magnitud es igual al producto de la masa por la aceleración de la gravedad. Masa y peso son propiedades diferentes. Ahora, ocurre que la balanza compara los tirones de la Tierra sobre los objetos colocados en sus platillos. Así, cuando se equilibra, se están igualando los pesos,
aquí g representa la aceleración de la gravedad que en un mismo lugar de la Tierra es la misma para todos los objetos, entonces la puedo cancelar en la ecuación, con lo que obtengo que igualdad de pesos implica igualdad de masas y, por ello, de manera descuidada a veces digo masas y a veces digo pesos.
—¡Eah, basta ya de veraneos, regresemos a París al laboratorio! —Y Lavoisier se incorporó— ¡A sacar punta a los carbones, mi dibujante!—. ¡Si tengo razón, podré armar una teoría de la combustión que ponga a la química como una verdadera ciencia, a la altura de la mecánica y de la astronomía y deje para siempre su lugar de artesanía mágica.
Mientras María Ana disponía lo necesario para el inminente regreso a París,
no podía menos que comprender que lo que su marido le había confiado, seguro
lo lograría. ¿No había demostrado la inexistencia de la transformación del agua
en tierra, no hacía mucho?15 ![]()
El 1º de noviembre de ese mismo año, Antonio Lavoisier depositó un sobre sellado para ser abierto en 1773, en la Académie de Sciences en él describía sus experimentos iniciales sobre la combustión del fósforo e informaba del aumento de peso del azufre y del fósforo al arder, explicando que la ganancia de peso se debía a la absorción de una "prodigiosa cantidad de aire". Subraya en esa comunicación que azufre y fósforo no habían perdido peso como pudiera esperarse de haber perdido flogisto, y que, en contraste, el litargo (calx de plomo), al ser calentado con carbón formaba plomo en peso menor que el peso del litargo empleado, acompañándose la formación de plomo con un prodigioso desprendimiento de aire. "Este descubrimiento me parece que es uno de los más interesantes que se hayan hecho desde Stahl, y puesto que es difícil no dejar escapar en la conversación con los amigos información que pueda ponerlos sobre la pista correcta, creo que debo depositar esta nota en manos del secretario de la Academia, para que permanezca sellada hasta el momento en que publique mis experimentos." Sin embargo, no especificaba la naturaleza de los gases absorbidos o desprendidos.
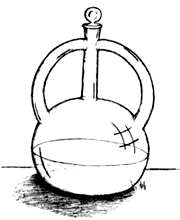
Aparato de Lavoisier. Pelícano.
En este momento Lavoisier adquiere conciencia de ser el único capaz de sistematizar a la química como una ciencia. Dedica los últimos meses de 1772 y el principio de 1773 a los preparativos materiales e intelectuales para desarrollar y comprobar sus brillantes conjeturas. El mes de febrero inaugura una bitácora de laboratorio: "Antes de comenzar la larga serie de experiencias que me propongo realizar sobre el fluido elástico que se desprende de los cuerpos, sea por la fermentación, sea por la destilación, sea finalmente por las combinaciones de todas clases, lo mismo que sobre el aire absorbido en la combustión de un gran número de substancias, creo necesario expresar por escrito algunas reflexiones para formularme a mí mismo el plan que debo seguir." A continuación, enumera lo conocido hasta entonces sobre los distintos aires y señala la confusión existente en la que se tiende a multiplicar el número de ellos, en vez de averiguar si sus diferencias no se deben a mezclas o a la presencia de impurezas en número pequeño, de gases definidos. Finaliza diciendo:
La importancia del tema me ha inducido a retomar todo este trabajo
que me pareció apto para producir una revolución en la física y en la química.
Creí necesario considerar tan sólo como indicaciones todo lo que había sido
hecho con anterioridad; me he propuesto repetirlo todo con nuevas precauciones16
![[Nota 16]](../img/mcommnt.gif) a
fin de relacionar lo que conocemos sobre el aire que se fija o que se desprende
de los cuerpos con los otros conocimientos adquiridos y formar una teoría. Los
autores de los trabajos que acabo de citar, considerados desde este punto de
vista, me han presentado secciones separadas de una gran cadena, de la que se
han unido sólo algunos eslabones. Pero falta aún una inmensa serie de experiencias
para formar una continuidad [...] Esta manera de encarar el tema me ha hecho
sentir la necesidad, primero, de repetir, y luego, de multiplicar, las experiencias
que absorben el aire a fin de que, conociendo el origen de esta substancia,
pueda rastrear sus efectos en todas las diferentes combinaciones. Las operaciones
por las cuales se puede llegar a fijar el aire son la vegetación, la respiración
de los animales, la combustión, en alguna circunstancia la calcinación y, por
último, algunas combinaciones químicas. He creído necesario comenzar por estas
experiencias.
a
fin de relacionar lo que conocemos sobre el aire que se fija o que se desprende
de los cuerpos con los otros conocimientos adquiridos y formar una teoría. Los
autores de los trabajos que acabo de citar, considerados desde este punto de
vista, me han presentado secciones separadas de una gran cadena, de la que se
han unido sólo algunos eslabones. Pero falta aún una inmensa serie de experiencias
para formar una continuidad [...] Esta manera de encarar el tema me ha hecho
sentir la necesidad, primero, de repetir, y luego, de multiplicar, las experiencias
que absorben el aire a fin de que, conociendo el origen de esta substancia,
pueda rastrear sus efectos en todas las diferentes combinaciones. Las operaciones
por las cuales se puede llegar a fijar el aire son la vegetación, la respiración
de los animales, la combustión, en alguna circunstancia la calcinación y, por
último, algunas combinaciones químicas. He creído necesario comenzar por estas
experiencias.
A finales de 1773, llevando a cabo el programa propuesto, realiza la calcinación de plomo bajo sello de mercurio utilizando una lente para concentrar el calor del Sol. Comprueba que una vela se apaga en el gas residual y comprende ya sin lugar a dudas que una parte del aire se ha fijado en el metal. En febrero de 1774 lleva a cabo la calcinación de cantidades conocidas de plomo y de estaño en ampollas cerradas de peso conocido, y al final del experimento comprueba que no ha habido variación del peso total. Así comprueba su intuición de que el fuego no ha cedido materia al metal. Al abrir las ampollas comprueba el soplo de aire que se precipita al interior; pesa los calces obtenidos, y deduce el peso del aire absorbido. Así, en contraste con la teoría de Stahl, que interpretaba:
|
plomo
|
®
|
litargo + f
|
|
|
|
|
|
(metal + f)
|
(calx de plomo)
|
|
|
calx de plomo + F
|
®
|
plomo
|
|
|
||
|
(contenido en el carbón)
|
||
|
Plomo + aire atmosférico
|
®
|
calx de Plomo + f
|
|
|
||
|
aire + f
|
|
calx de Plomo + carbón
|
®
|
Plomo + aire desprendido
|
|
(aire o aire fijo + f)
|
En este primer esquema, aunque todavía se cree en la existencia del flogisto,
ahora convertido en lo que se conoció como el calórico,17 ![[Nota 17]](../img/mcommnt.gif) se
toma en cuenta el desprendimiento de un gas durante la reducción de un calx,
fenómeno que la teoría de Stahl no explica y que aparentemente nadie había informado
antes.
se
toma en cuenta el desprendimiento de un gas durante la reducción de un calx,
fenómeno que la teoría de Stahl no explica y que aparentemente nadie había informado
antes.
Nos hallamos ahora en el laboratorio de Lavoisier; una noche de octubre del año 1774. En silencio y con profunda concentración, Lavoisier pesa un residuo que con cuidado infinito ha desprendido de las paredes de una redoma. María Ana irrumpe en el laboratorio invadiendo su atmósfera acre con una exhalación de violetas.
—¡Los invitados están tocando ya a la puerta! ¡Querido, por favor, cambiante la peluca y ponte esta chaqueta!
—Gracias. ¿Quién dices que viene hoy?
—El reverendo José Priestley, en capacidad de bibliotecario, compañero literario y tutor de los hijos del conde de Shelburne y marqués de Lansdowne.
—¡Ah, qué bien! Tengo enorme interés por conocer al reverendo, es un experimental de primera. Sus trabajos sobre gases compiten con los de Cavendish en originalidad mas no en rigor. ¿Viene también el marqués?

Figura 19. Cubas y probetas de Priestley. Nótese el ratón en el tubo al frente y el vegetal en el tubo del lado derecho.
—Sí, desde luego. ¡Oigo sonar la campanilla otra vez, han de ser el secretario de la Academia y nuestro amigo Maréchal!
Después de la soupe a l'oignon, el Chateaubriand acompañado de un tinto de primera, y la habilidad de María Ana como anfitriona especializada en científicos, la formalidad y tiesura habían desaparecido dando lugar a un ambiente de cordialidad.
—Reverendo Priestley, ¿no encuentra difícil conciliar sus deberes ministeriales con la práctica de la química? —preguntó Maréchal—.
—¡De ninguna manera! Son más bien mis feligreses los que viven en un permanente
estado de asombro al ver a su pastor metido siempre entre frascos, vapores y
tubos. Siempre hay murmuraciones de que sirvo a dos altares, pero en realidad
más bien creo que les divierte y les enorgullece tener un pastor "avanzado",
al fin y al cabo mi congregación es disidente.18 ![]()
—Tengo entendido que ha tenido dificultades en el pasado. —comentó Maréchal—.
—Debidas a mi práctica de la química, en realidad, no. Mis dificultades más bien han sido resultado de mis opiniones teológicas independientes. Las gentes de la Iglesia de Inglaterra se aferran a la letra de la Biblia de un manera visceral y les molesta que yo les muestre una lectura crítica de ella. Me imagino que aquí en Francia pasará lo mismo.
—Nosotros —terció el secretario de la Academia—, por el contrario;
encabezados por Voltaire, más bien nos hallamos en plena etapa de fervor racionalista,
incluyendo a nuestro propio clero.19 ![[Nota 19]](../img/mcommnt.gif) Por
otra parte, aquí en Francia una discrepancia en asuntos teológicos, además de
no estar de moda, no implica una discrepancia política como ocurre en Inglaterra,
en donde el rey encabeza la Iglesia.
Por
otra parte, aquí en Francia una discrepancia en asuntos teológicos, además de
no estar de moda, no implica una discrepancia política como ocurre en Inglaterra,
en donde el rey encabeza la Iglesia.
—¡Cuánta razón tiene su excelencia! Esta unificación de Iglesia y monarquía es una de las razones que me impulsaron a la disidencia. Cambiando de tema, tengo una inquietud que quisiera discutir con el señor Lavoisier, y es que usted en su informe a la Academia de Ciencias francesa afirma que es aire combinado con el metal lo que forma un calx, y además informó que, al calentar el calx con carbón, se halla un desprendimiento enorme de aire. ¿Es éste el aire fijo de Black?
—Tengo una opinión absolutamente segura al respecto, pero es difícil admitir que lo sea, pues proviene del calx que absorbió aire atmosférico cuando éste se formó, y he comprobado que es imposible la formación de calx en aire fijo, por lo que no puede ser aire fijo el que se absorbe en la calcinación.
—¿Entonces, se absorbe aire común en la formación del calx y se desprende aire fijo en su descomposición? Quisiera saber su opinión al respecto.
—Me faltan todavía diversos experimentos para poder darle una respuesta definitiva. No es sorprendente que se combine, en la calcinación, un gas, y en la reducción, se desprenda el otro. Note usted que este aire que se desprende tiene un origen complicado, no olvide al carbón. He comprobado que opaca el agua de cal y no sostiene la combustión. Así que usted dirá.
—Hmm... Es que yo he llevado a cabo la calcinación de un calx durante la cual se obtiene un gas diferente del aire fijo y del aire común. Esto es, si usted tiene razón en que, durante la calcinación de un metal, una porción del aire común se absorbe o se combina con el metal, yo encuentro que en la reducción del calx se desprende un gas diferente del aire común y del fijo, pero sin haber usado carbón.
—¿Cómo? —exclamaron los comensales asombrados—. ¡Está usted diciendo
lo mismo que Pedro Bayen y Cadet de Gassincourt! ¿Es posible obtener el mercurio
metálico del precipitado rojo de mercurio sin necesidad de carbón? Pero ¿usted
dice que con desprendimiento de un gas diferente del aire común y del aire fijo?20
![[Nota 20]](../img/mcommnt.gif) —Unos
a otros se miraron extrañados y empezaron a comentar entre sí con escepticismo—.
—Unos
a otros se miraron extrañados y empezaron a comentar entre sí con escepticismo—.
—Escuchemos al reverendo —dijo el marqués de Lansdowne alzando ligeramente la voz—. Adelante Joseph, su narración es fascinante, oigámoslo, —añadió—.
Priestley permaneció callado, en concentración, con las manos juntas mordiéndose los nudillos. María Ana, con una discreta seña, indicó al mesero que sirviera una segunda ronda de café y de Armagnac
—Me procuré un lente de 12 pulgadas de diámetro y 20 de distancia focal, y procedí con entusiasmo a examinar; con su ayuda, cuál clase de aire desprenden una gran variedad de substancias naturales y facticias. Después de diversos experimentos, el 1 de agosto de este año me propuse extraer aire del mercurius calcinatum per se. Encontré que con la ayuda del lente muy fácilmente se desprendía aire.
En ese momento María Ana se dio cuenta de que la respiración de su marido se
alteraba aunque su exterior permanecía inmutable.21![[Nota 21]](../img/mcommnt.gif)
—Comprobé —siguió diciendo Priestley— que no se embebe en el agua. No me sorprendió, desde Hales sabemos que muchísimas substancias sólidas despiden aire al ser fuertemente calentadas. Pero lo que me sorprendió más allá de lo que pueda expresar es que una vela arde en ese aire con vigor; brillantez y tamaño aumentados. Fue un movimiento instintivo, tenía la vela encendida a un lado y miles de veces he introducido velas para descubrir la presencia de aire fijo o de aire flogisado, o de aire nitroso o aire muriático... y cuando esperaba que se apagaría, ¡oh sorpresa, oh destello! Estaba, estoy emocionado. Inmediatamente me dispuse a preparar más y más aire a partir del calx de mercurio; esa noche no dormí. Inserté una brasa en otro frasco del gas, y vi que echaba chispas y crepitaba exactamente como el papel impregnado de solución de salitre cuando se quema. La brasa se consumió rapidísimamente. En otro frasco con el gas, introduje un alambre de fierro al rojo, destelló y se puso al rojo-blanco como poseído de un espíritu.
Priestley calló y apoyó la cabeza en las manos. Todos aguardaban en expectante silencio.
—Han de saber —continuó— que entonces me puse a preparar varias jaulas para atrapar ratones. Hasta el momento he podido hacer una sola prueba preliminar con uno de ellos. Para mi sorpresa, el ratón pareció animarse y permaneció activo más del doble de tiempo de lo que suelen permanecer en el mismo volumen de aire común. Entonces, me arriesgué e inhalé un poco yo mismo y me sorprendí porque me sentí muy bien. ¡Qué pueda estar ocurriendo, no lo sé!
—Entonces —intervino Maréchal con sorna imperceptible—, usted parece haber obtenido a partir de un calx ¡el pábulo de la vida!
—¿Y ha continuado con sus experimentaciones? —preguntó María Ana lanzando un mirada enojada en dirección de Maréchal—.

Figura 20. Ampolla de vidrio en la que hacía saltar chispas eléctricas Cavendish.
—No, desgraciadamente se ha agotado el lote que tenía de mercurium calcinatum per se, y no deseo fabricarlo yo mismo con el poco mercurio que tengo y que utilizo para sello en las cubas neumáticas. Pensamos comprar aquí en París una buen cantidad para continuar; sobre todo para comprobar el efecto de este aire en los ratones, y verificar más allá de toda duda si viven más en el gas que en el aire común.
—¿Está usted seguro, reverendo Priestley, de que el calx empleado era puro? —preguntó Lavoisier—.
—Lo estoy, razonablemente. Esa es una de las razones de haber venido a
París a comprarlo. Tener la certidumbre de que utilizo el compuesto puro. Por
otra parte, he repetido el experimento con litargo y obtenido el mismo resultado,
desprendimiento de un gas que aviva las llamas, pero el experimento es más difícil
por más lento. Además, tengo el escrúpulo de que pudiera tratarse del mismo
aire nitroso22 ![[Nota 22]](../img/mcommnt.gif) que
he descubierto hace tiempo y que también aviva la llama, aunque... de un modo
distinto.
que
he descubierto hace tiempo y que también aviva la llama, aunque... de un modo
distinto.
Las últimas palabras de Priestley desencadenaron un recuerdo en Lavoisier.
Hacía cosa de un mes había recibido una carta de un tal Scheele, de Suecia,
con el extraño requerimiento de que tratara de calentar álcali suave de plata23
![]() con
ayuda de una lente. El remitente decía no haber podido hacerse de una, por lo
que le rogaba que realizara el experimento, absorbiera el aire fijo resultante
en agua de cal y viera si en el aire que aún quedaba ardía o no una vela.
con
ayuda de una lente. El remitente decía no haber podido hacerse de una, por lo
que le rogaba que realizara el experimento, absorbiera el aire fijo resultante
en agua de cal y viera si en el aire que aún quedaba ardía o no una vela.
En ese momento, un ligero roce de la mano de María Ana sobre su manga de seda hizo volver a Lavoisier a la realidad circundante.
—¿Y tiene usted en mente una teoría que explique lo ocurrido? —preguntó con una voz en la que sólo María Ana percibió tensión y expectación—.
—Bueno, no soy teórico —dijo el ministro con una sonrisa de modestia—, pero de acuerdo con Stahl —replicó inocente—, una vela al arder da flogisto y se apaga cuando el ámbito que la rodea se satura de él. Entonces, he pensado que el aire ordinario soporta la combustión porque sólo está parcialmente saturado de flogisto y está por así decir en posición de absorber más. Las substancias combustibles arden en el aire común con flama moderada. En este nuevo aire, la flama es vívida, mucho más, oh sí, mucho más. Uno podría concluir que este aire es un aire deflogisticado, ¿no les parece? ¿Y que la porción de aire que queda de una combustión en aire común es aire flogisticado?
Hizo ademán Priestley de buscar dónde anotar y con qué, y María Ana, siempre preparada, pensó que tenía enfrente un sabio despistado, por lo que hizo una seña discreta al mesero, quien como por encanto produjo un tintero con su pluma de ganso y un pliego de papel, salvando así la blancura amenazada del mantel. Priestley escribió:
Lavoisier; sereno asintió con la cabeza. Maréchal intervino comentando.
—¡Qué cosas de la ciencia! ¿Cuál espíritu angélico le hizo tomar la vela e introducirla en el frasco?
—Le digo, yo no tenía una finalidad concreta al hacer este experimento y realmente no esperaba mucho de él. Si no hubiera ocurrido que tenía enfrente la vela, quizá jamás hubiera hecho la prueba. Más se debe a lo que llamamos el azar que a cualquier designio o teoría anticipada.
Lavoisier volvió a asentir con gravedad y la conversación se generalizó hacia las políticas científicas de los reinos; al poco rato, el secretario de la Academia se levantó anunciando que ya era muy tarde, que se retiraba, con lo que desencadenó la desbandada de los invitados. Al despedirse, Lavoisier recordó al ministro y al marqués que los esperaba al día siguiente para que visitaran su laboratorio.
En los primeros meses de 1775, Lavoisier colectó el aire producido por la reducción sin carbón del calx rojo de mercurio y lo probó para determinar si era o no aire fijo. Halló que no opacaba el agua de cal cuando se burbujeaba en ella y registró en su bitácora que "lejos de extinguir una flama, ésta se avivaba más que en el aire". Concluyó que este gas era no sólo no aire común "sino más puro que el aire en el que vivimos". Una vez confirmado el resultado experimental de Priestley, hizo notar que calcinando mercurio se podría analizar el aire atmosférico en sus componentes. En abril de 1776, estudió el aire residual de una calcinación prolongada de mercurio y verificó que si bien no sostenía la combustión, no era aire fijo sino aire mefítico.
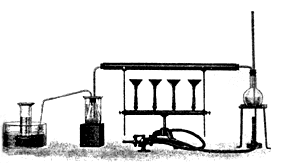
Figura 21. Aparato para generar hidrógeno a partir de agua, de Lavoisier.

Figura 22. Tabla de los elementos químicos propuesta por Lavoisier.
Fue finalmente el 5 de septiembre de 1777 cuando en una memoria leída ante la Academia hizo pública su teoría de la calcinación y de la combustión:
i) El aire es una mezcla de dos fluidos elásticos, uno de ellos es la parte eminentemente respirable, la otra es el aire mefítico que llamo ázoe.
ii) Los calces son compuestos de metal con la parte eminentemente respirable del aire que llamo oxígeno. Son óxidos del metal.
iii) El aire fijo es un compuesto de carbón con oxígeno.24
![]()
iv) Todos los ácidos son compuestos formados por substancias no metálicas
y oxígeno.25 ![[Nota 25]](../img/mcommnt.gif)
v) Los metales, el oxígeno, el ázoe, son elementos químicos en el sentido
que usó Boyle para la palabra elemento, porque hasta ahora no se han podido
reducir en substancias más simples, ni se han podido transformar unos en los
otros. Concomitantemente, no son elementos químicos ni el aire, ni la Tierra,
ni el fuego. Este último es el proceso, que ocurre en el lugar donde vemos la
flama, de combinación de oxígeno con el combustible durante el cual se desprenden
calórico,26 ![]() luz
y aire fijo.
luz
y aire fijo.


Figura 24. Algunos elementos. Comenzando por la esquina inferior izquierda y siguiendo en el sentido de las manecillas del reloj, cristales de yodo en un vidrio de reloj, cristales de azufre, cobre nativo; en la redoma (Erlenmeyer) y bromo al frente en otro vidrio de reloj.
vi) En la combustión de las substancias orgánicas, leña, alcohol, etc., más
gases se desprenden de los que se absorben en la oxidación, y en estos casos
las cenizas resultantes pesan menos que el material original. Se desprende vapor
de agua, aire fijo y monóxido de carbono... Muchos químicos y físicos encontraron
la teoría de Lavoisier inaceptable. Quedaba un obstáculo serio por vencer y
era el siguiente. Al disolverse un calx de metal en ácido diluido en agua y
evaporar el agua se obtiene una sal. Este hecho innegable, se escribía:27
![]()
| i) |
calx + ácido
|
®
|
sal.
|
Ahora bien, cuando se disuelven virutas de metal en una solución acuosa de ácido, se desprende el gas inflamable y al evaporar el agua se encuentra la misma sal:
| ii) |
metal + ácido
|
®
|
sal + gas inflamable.
|
Preguntas. ¿Por qué hay desprendimiento gaseoso en (ii) y no en (i)? ¿De dónde proviene el gas inflamable? ¡A ver; que conteste Monsieur Lavoisier! —decían los flogistonistas—. ¡No puede contestar! —decían regocijados—, porque, según él, el calx es compuesto de metal con aire deflogisticado, así que tiene que interpretar; la reacción (i) como:
pero entonces, para la reacción (ii) tendría que escribir:
con lo que estaría diciendo que el gas salió de la nada. En cambio, nosotros tenemos una respuesta: los metales no son elementos, el gas inflamable proviene del metal y es el flogisto. Nuestro razonamiento es el siguiente.
Ya desde 1766 Cavendish, y recientemente en 1782, el señor Priestley, han demostrado que los calces calentados en ambiente de gas inflamable se reducen al metal:
la conclusión es irrefutable, el gas inflamable es f. Así como el aire fijo se obtiene por calentamiento de los álcalis suaves, hecho demostrado irrefutablemente por Black, así se obtiene el gas inflamable del metal por acción de los ácidos. Como por (i) la sal es (calx + ácido), al disolverse las virutas metálicas en (ii), se intercambia el ácido con el flogisto y este último se libera:
Si fuésemos fatalistas, diríamos que el destino escogió a Cavendish y a Monge para el magno hallazgo con el cual Lavoisier respondería a la objeción de los flogistonistas y emprendería su campaña abierta en contra del flogisto. Pero no hay destino preordenado en ciencia. Lo que hay o no, desde luego contando con ganas e inteligencia, es el factor imponderable consistente en estar en el lugar adecuado, a saber; con el equipo experimental adecuado y con la información adecuada. Por ello, los científicos para producir viajan no sólo a presentar sus resultados ante la crítica implacable de sus colegas, sino sobre todo a oír y a intercambiar la información más reciente, como quien dice a comer y a que no les coman el mandado. Así, nos transladamos ahora a Londres a principios de 1783...
La campanilla seguía repiqueteando en la cocina y Cordelia hubo de secarse las manos artríticas parar ir a abrir.
—¡Carlos! —murmuró—. ¡Este muchacho nunca está cuando se le necesita! ¡Ayudante, mucho que ayuda! ¡Señorito, eso es lo que es!
Al abrir la puerta, un viejo, atildado como un príncipe, y envuelto en neblina helada, sin saludarla, le ordenó:
—¡Anuncie al señor Cavendish que el representante del banco Lloyds & Peabody desea hablar con él!
—Eso es imposible, caballero, el señor ha ordenado que por ningún motivo se le interrumpa.
—¡No me diga! Haga el favor de anunciarme. —En ese momento apareció Carlos en la puerta, el representante en forma igualmente cortante repitió su solicitud—.
—Creo que lo mejor es que el caballero pase. Yo lo acompañaré hasta la puerta del laboratorio.
A medida que fueron subiendo las escaleras, se hicieron perceptibles varias explosiones cuyo estrépito de vidrios la pesada puerta de roble no alcanzaba a atenuar. Con una ligera inclinación y una sonrisa irónica, Carlos señaló la puerta diciendo:
—¿Y por qué he de ser yo el que toque? —replicó el representante—.
—Porque si lo hago yo, perderé el empleo.
—¡Pero qué servidumbre tan fresca tiene este Cavendish; un millón de libras en el banco, el hombre más rico de Inglaterra y no tiene un mayordomo digno de ese nombre! —pensó el representante y moviendo la cabeza, llamó a la puerta. Después de unos segundos, se oyó otra explosión. Carlos y el representante se miraron, pero este último no iba a darse por vencido e insistió.
La puerta se abrió con violencia y un hombre vestido con ropas viejas del siglo pasado, fulminó con la mirada a los impertinentes que lo interrumpían.
—Le advertí al señor representante del banco —se adelantó a aclarar Carlos— que su señoría ha dado órdenes de que no se le interrumpa por ningún motivo, pero insistió en llamar él mismo.
Antes de que el representante pudiera abrir la boca, Enrique Cavendish le dijo mientras lo recorría con una mirada helada:
—He depositado mi fortuna con ustedes porque los creí capaces de tomar las decisiones necesarias sin que me estén molestando. En vista de que no es éste el caso, retiraré mi dinero para depositarlo en otra parte.
Al ver que la puerta se cerraba, el representante bancario metió el pie al tiempo que exclamaba contrito:
—¡Le aseguro, señor Cavendish, que esto no volverá a repetirse! —El científico lo miró, miró el pie y, cuando el representante lo retiró, cerró la puerta. Regresó al lado de la enorme mesa de su laboratorio y enroscándose el pelo con la mano derecha, empezó a mascullar sus pensamientos—.
—Parece que no cabe duda, este gas de Boyle, gas inflamable, es el mejor candidato para ser el tan buscado flogisto. El hecho más importante para esta afirmación es la reducción de los calces metálicos con él.
—Es 11 veces menos pesado que el aire, los animales no pueden respirar en él, su flama es azul, no deja huella de carbón y explota cuando se encuentra mezclado con aire atmosférico, aunque sólo en mezclas de determinadas proporciones. No es soluble en agua, no es soluble en soluciones de álcalis.
—En cuanto a su obtención, se obtiene tanto por acción de vitriólico diluido, como por acción del ácido muriático sobre hierro, estaño o zinc. Este hecho y el más importante, a saber; que a iguales cantidades de metal disuelto en el ácido, se obtienen iguales cantidades del gas, me hace sospechar que proviene de los metales y que si bien la calcinación es combinación del metal con oxígeno como descubrió Lavoisier, el flogisto de todos modos está fijo en el metal.
—Lo que interesa ahora es aclarar dos cosas sobre la explosión del gas inflamable con el gas deflogisticado. Una es averiguar si la explosión da lugar a una disminución de peso como afirma Warltire, cosa que dudo mucho y la otra es examinar el rocío que Priestley me advirtió se forma y que ya he observado... Hmph... sí.
Cavendish se inclinó a recoger un trozo de vidrio y acariciándolo se dio cuenta de que estaba húmedo.
—Sí, no cabe duda —siguió pensando—, además es verdad lo que Maquer afirma... al colocar una pared fría sobre la llama del gas inflamable, se colecta rocío que parece ser agua... aunque un poco ácida al gusto... Se combinan los gases y más que una explosión lo que ocurre es una implosión, las paredes de vidrio no han aguantado la presión atmosférica cuando los gases se fijan en forma de líquido. ¿Tendrá esto que ver con lo que informó Beccaria de que al pasar descargas eléctricas en agua parece desprenderse un gas? ¿Cuál gas podrá ser? Hmmf... El aparato para producir chispas eléctricas da lugar a una fuerza tremenda... ahí está lo de los 100 monjes, que en fila y cogidos de la mano pegaron tremendo salto al descargarse el aparato a través de ellos... una fuerza tremenda...
En ese momento se deslizó al laboratorio el ayudante.
—¡Carlos! ¿Están ya listos los globos de vidrio reforzado?
—Sí señor; están perfectamente limpios, en este instante los conecto a la bomba para hacerles el vacío.
—¡Cuidado, ponte los guantes de tela para manejar los globos ya limpios! La mezcla que introduciremos en ellos será de dos partes de gas inflamable por una de gas deflogisticado, con esta proporción la implosión es óptima. ¿Están ya listos los tubos para secar la mezcla antes de introducirla en los globos?
—Sí, sí señor; los sacaré de la estufa en el último momento para estar seguros de que no tienen ninguna humedad y de que chuparán cualquiera que pueda haber en los gases. ¿Preparo ya la mezcla? Los globos ya están vacíos.
—No, ya la tengo lista y medida en este matraz. Ahora conectemos el matraz de la mezcla gaseosa al tubo secante. Eso es. ¿Con qué dices que lo rellenaste?
—Con padecería limpia de papel filtro.
—Ahora, conectemos el globo vacío en el otro extremo del tubo secante, así, abre las dos válvulas de conexión... ¡Eso es!... ya pasó parte de la mezcla gaseosa al globo. Ahora, sube el nivel de mercurio en el matraz para que toda ella pase al globo. Muy bien, ya está. Ahora desconecta y pesa el globo.
En ese momento Cordelia llamó a la puerta del laboratorio y en voz alta dijo:
—En la nota que el señor me dejó en la mesa del hall, dice que compre una pierna de borrego para la cena.
—¡Maldita sea! —murmuró para sí el investigador y alzando la voz dijo:—
—Es que hoy vendrán sus amigos de la Sociedad Real.

Figura 25. Portada del libro de Sheele Tratado químico del aire y de fuego.
—¡Es que, señor; no va a alcanzar una pierna para cinco!
—¡Pues compre dos! —contestó enojado Cavendish— ¡Mujeres! —murmuró para sí—.
—El peso del globo es de 400 g —declaró Carlos—. ¿Conecto ya los electrodos?
—No, retírate lejos, no estamos seguros de que estos nuevos globos aguanten—. Y diciendo y haciendo, Cavendish hizo la conexión, un relámpago destelló en el globo, se opacó su interior y un copioso rocío bañó sus paredes.
—¡Bravo! ¡Aguantó! —exclamó Carlos entusiasmado y ni tardo ni perezoso procedió a desconectar los electrodos y a pesar el globo bajo la mirada intensa de su maestro—.
—¡400 g! Ya me lo imaginaba, la masa permanece constante, Walrtire debió cometer un error. Ahora pesemos el líquido que se ha formado y midamos su densidad... 1.00 g/ml. —Tomó Cavendish la pluma y anotó en la bitácora de laboratorio los datos. Procedieron luego a calentar el líquido hasta evaporación total y comprobaron que no dejaba residuo ninguno. Un sinnúmero de veces se repitió este rito con las operaciones auxiliares de limpieza del equipo y preparación de mezclas medidas de aire inflamable con oxígeno, durante varias semanas. En una de tantas, no pudo resistir ya más Carlos y dijo:
—Maestro, ¿me permite probarlo? ¡Creo que se trata del agua más pura que haya visto jamás!
—Si quieres... ¡Desde luego que es agua!
Cavendish se sentó ante su escritorio y escribió en la bitácora:
"Pienso que debo conceder que el aire deflogisticado no es otra cosa sino agua deflogisticada; o en otras palabras, que el agua consiste de aire deflogisticado unido a flogisto; y que el aire inflamable es o puro flogisto; como supone el doctor Priestley, o agua unida a flogisto. Esto último es lo que creo más probable, en resumidas cuentas:
Carlos, después de leer lo escrito por el maestro comentó:
—Entonces, el agua, un elemento en el sentido de Boyle, preexiste en los gases, y la causa de la deflagración es una redistribución de flogisto. —Cavendish no contestó, simplemente asintió, era hombre de pocas palabras—.
En mayo o junio de 1783, sir Carlos Blagden, ayudante de Cavendish y recientemente nombrado secretario de la Sociedad Real, visitó a Lavoisier en su nuevo laboratorio del arsenal. En esa reunión le comentó sobre los experimentos de obtención del agua que había estado haciendo Cavendish. Lavoisier; por su parte, había estado muy intrigado por el producto de la combustión del hidrógeno en oxígeno, pensando que no siendo el hidrógeno un metal, debía al igual que el azufre y el fósforo dar lugar a un ácido al combinarse con el oxígeno. En 1783, ya había determinado hacer el experimento en gran escala para atrapar el producto cualquiera que éste fuese. Así que todo fue abrir la boca Blagden que Lavoisier se precipitó delante del mismo Blagden a repetir el experimento de Cavendish. Quizá por la prisa hubo algunas fugas de gas, los datos cuantitativos no coincidieron muy bien. Sin embargo, el 25 de junio, después de discutir con su amigo el gran matemático Pedro Simón Laplace, presentó una comunicación ante la Academia de Ciencias de París que comenzaba diciendo: "Los señores Lavoisier y Laplace anuncian que han repetido últimamente, en presencia de varios miembros de la Academia, la combustión del aire inflamable con el aire deflogisticado..." Mas adelante se afirmaba, "... El agua no es un elemento, con lo que se quiere decir no es una substancia simple, sino que es el compuesto constituido por aire inflamable y oxígeno".
Al año siguiente, Lavoisier y el ingeniero Meusnier después de largas discusiones con Laplace, a quien tampoco le hacía mucha gracia el flogisto, llegaron a la conclusión de que el gas inflamable provenía del agua. Propusieron como respuesta a la objeción de los flogistonistas la siguiente interpretación de la reacción (ii) en dos pasos:
|
agua
|
.
|
|
|
|
||
|
metal + (hidrógeno + oxígeno)
|
= =
|
calx + hidrógeno |
|
calx + ácido = = sal.
|
||
es decir; proponían que el hidrógeno provenía del agua.28
![]() Pero
no sólo eso, sino que habiendo sido convocado un concurso para producir hidrógeno
en grandes cantidades, destinado al globo dirigible de los hermanos Montgolfier,
Lavoisier y Meusnier ganaron el concurso mediante la obtención de hidrógeno
a partir de agua. Hicieron pasar vapor de agua sobre limaduras de fierro al
rojo, encerradas en un tubo de escopeta.
Pero
no sólo eso, sino que habiendo sido convocado un concurso para producir hidrógeno
en grandes cantidades, destinado al globo dirigible de los hermanos Montgolfier,
Lavoisier y Meusnier ganaron el concurso mediante la obtención de hidrógeno
a partir de agua. Hicieron pasar vapor de agua sobre limaduras de fierro al
rojo, encerradas en un tubo de escopeta.
La reacción que tiene lugar en este caso es:
Ni qué decir que las virutas de fierro se cubrieron de óxido de fierro, un polvo negro, mientras que por uno de los extremos del tubo se hacía burbujear alegremente al hidrógeno, es decir; al "generador de agua".
La celebración del buen éxito de este experimento, que representó el tiro de gracia para el flogisto, consistió en la ceremonia fúnebre de su entierro, a los 100 años de la muerte de Joaquín Becher. Madame Lavoisier; vestida como sacerdotisa de la ciencia y rodeada de las celebridades científicas de París, puso fuego a los escritos de Becher y de Stahl sobre un altar improvisado, mientras la concurrencia entonaba un réquiem.

Figura 26. Portada de libro de Priestley Experimentos y observaciones sobre diferentes clases de aire.
![[Inicio]](../img/begin.gif)